双咪唑啉基硼酸酯衍生物的合成及其缓蚀行为
2020-09-12贾群坡何冠宁
吕 松,贾群坡,何冠宁,袁 斌
(广东工业大学 环境科学与工程学院,广州510006)
咪唑啉类衍生物因其可在金属表面形成紧密的吸附层,可作为盐酸[1-4]、硫酸[5]、二氧化碳[6-12]和H2S腐蚀的缓蚀剂[13-14],因此被广泛应用于油气田的生产和化工生产过程中。近年来,低毒、高效、用量少的咪唑啉衍生物及天然植物绿色缓蚀剂[15-16]成为研发热点,其合成也备受关注。目前,咪唑啉化合物多采用脂肪酸和乙二胺或其衍生物为原料来合成,而以双甘油酸硼酸酯为原料制备出咪唑啉类化合物的研究却鲜有报道。为此,本工作采用双甘油酸硼酸酯(BDG)和乙二胺或其衍生物进行闭环脱水反应合成了双(2-咪唑啉基)乙二醇硼酸酯(a)、双(1-N-胺乙基-2-咪唑啉基)乙二醇硼酸酯(b)和双(1-N-β-羟乙基-2-咪唑啉基)乙二醇硼酸酯(c)三种缓蚀剂;并研究了它们在5%(质量分数,下同)HCl酸洗液中对Q235碳钢的缓蚀行为。
1 试验
1.1 缓蚀剂的合成
将10 mmol双甘油酸硼酸酯(按文献[17]自制)分别与20~22 mmol乙二胺或二乙烯三胺或β-羟乙基乙二胺反应,在20 mL二甲苯溶剂中,氮气保护下,搅拌并逐渐加热至微沸腾,酰胺化反应4~6 h后,再逐渐升温,环化温度200~210℃条件下,环化脱水反应6~8 h后,得到粗产物经减压(20 mmHg)蒸溜后,用无水乙醇或丙酮重结晶,真空干燥,得到黑褐色固体产物(a)(R=H)、(b)(R=CH2CH2NH2)、(c)(R=CH2CH2OH),收率58%~89%。熔点分别为30~31℃、39~40℃和 45~46℃。目标产物的结构式见图1。

图1 目标产物的结构式Fig.1 The structural for mula of target products
1.2 试样和溶液
分别配置三种缓蚀剂溶液,将其加入到5%HCl酸洗液中,缓蚀剂加入量为10~180 mg/L;本试验取Q235钢为腐蚀材料,经逐级打磨、除油,水清洗后,置于干燥皿中干燥备用。其中,电化学试样的电极工作面积为1 c m2。
1.3 试验方法
将试样置于60℃含不同缓蚀剂的5%HCl酸洗液中浸泡6 h后,去除试片表面腐蚀产物,按照国标[18]计算缓蚀率(η)。采用三电极系Multi Autolab/204型电化学工作站,工作电极为试样,辅助电极和参比电极分别为铂电极和饱和甘汞电极(SCE),在扫描范围为-200~-800 mV(相对于SCE)的室温下测定极化曲线,测试扫描速率为5 mV/s,由动电位极化曲线得到自腐蚀电流密度(Jcorr)和自腐蚀电位(Ecorr),利用Origin软件拟合曲线,得到阳极和阴极Tafel斜率。电化学阻抗谱(EIS)的测试频率为10-2~105Hz,正弦交流波信号的振幅为10 mV,采用工作站自带软件对EIS数据进行拟合,得到等效电路图以及溶液电阻和电荷转移电阻等参数。采用TM3030型扫描电子显微镜,在15 k V加速电压条件下,观察金属表面腐蚀产物形貌。
2 结果与讨论
2.1 腐蚀失重试验
由图2可见:随着三种缓蚀剂加入量的增大,其对Q235钢在5%HCl酸洗液中的缓蚀率随之增大,当缓蚀剂的加入量达到一定值后,缓蚀率趋于平缓。在60℃的5%HCl酸洗液中,经过6 h腐蚀后,当缓蚀剂的加入量为100 mg/L时,三种缓蚀剂的缓蚀率均超过97%。

图2 三种缓蚀剂的缓蚀率随缓蚀剂加入量的变化曲线Fig.2 Change curves of corrosion inhibition rate with the amount of three corrosion inhibitors

图3 试样在含不同缓蚀剂5%HCl酸洗液中的极化曲线Fig.3 Polarization curves of samples in 5%HCl pickling solution containing different corrosion inhibitors
2.2 电化学试验
2.2.1极化曲线
由图3和图4可见,试样在含三种缓蚀剂试验溶液中的极化曲线变化规律相似,故下文以a缓蚀剂为例进行分析。随着5%HCl酸洗液中缓蚀剂a用量的增加,试样的腐蚀电流密度Jcorr明显减小(从3.985 mA·c m-2降至0.102 mA·c m-2),自腐蚀电位Ecorr正移(从-465 mV升至-410 mV),阴、阳极的塔菲尔斜率bc、ba均有变化,而且阴极斜率变化较大,证明缓蚀剂a在5%HCl酸洗液中是以抑制阴极反应为主的混合型缓蚀剂,其他两种缓蚀剂也有类似情况。
2.2.2电化学阻抗谱
由图5可见:加入缓蚀剂并未改变电化学阻抗电容弧的形状,说明缓蚀剂的加入并未改变Q235钢在5%HCl酸洗液中的腐蚀反应机理;且电容弧的直径随着缓蚀剂加入量的增加而增大,即Q235钢的耐蚀性随缓蚀剂加入量的增加而逐渐增强。
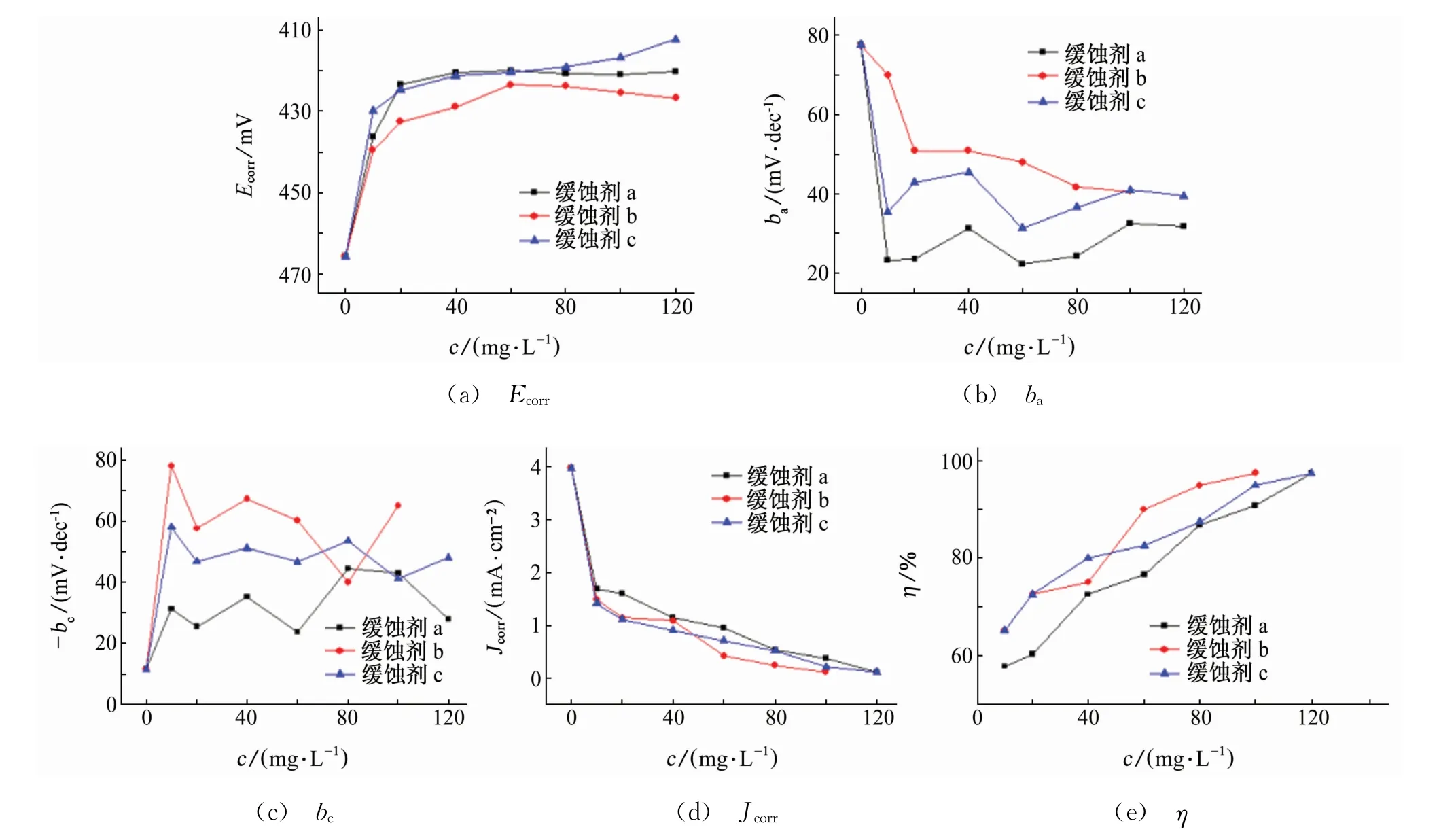
图4 极化曲线数据拟合结果曲线Fig.4 Fitting result curves of polarization curve data

图5 试样在含不同量缓蚀剂的5%HCl中的电化学阻抗谱Fig.5 EISof samples in 5%HCl with different concentrations of corrosion inhibitors
电化学阻抗谱的等效电路如图6所示,应用该等效电路对电化学阻抗谱的数据进行拟合,图中Rs为溶液电阻,CPE为常相位角元件,Rct为电荷转移电阻。拟合得到的等效电路中各等效元件对应电化学参数,见图7。

图6 电化学阻抗谱的等效电路Fig.6 Equivalent circuit for EIS
通常可用EIS的溶液电阻Rs、电荷转移电阻Rct以及弥散系数n来评价缓蚀剂的缓蚀能力[19],Rct的大小表示电化学反应的快慢,n值越趋近于1,双电层越接近理想电容。由图7可见,缓蚀率η和电荷转移电阻Rct均随着缓蚀剂用量的增加而增大,这与前述的浸泡法和极化曲线法所得试验结果相一致。

图7 电化学阻抗谱的拟合结果曲线Fig.7 Fitting result curves of EIS
2.3 表面形貌观察
由图8可以看出:在空白溶液中腐蚀6 h后,Q235碳钢试片表面出现了凹凸不平的腐蚀基坑,说明其在5%HCl中金属发生了严重的腐蚀;加入80 mg/L缓蚀剂后,试片表面相对平整,颜色光亮。由此证明:在酸性介质中,合成的缓蚀剂能在金属表面上形成良好的吸附膜。
2.4 吸附等温式及自由能
利用腐蚀失重试验所得的体系中缓蚀剂的浓度c和缓蚀率η数据(详见2.1节),采用Langmuir和Freudich吸附等温式进行数据拟合,试验结果满足式(1)所示的Langmuir等温式,线性相关系数R2均大于0.999。

式中:Kads为吸附平衡常数,θ近似为η。根据式(1),三种缓蚀剂在Q235钢表面上的吸附等温线见图9。
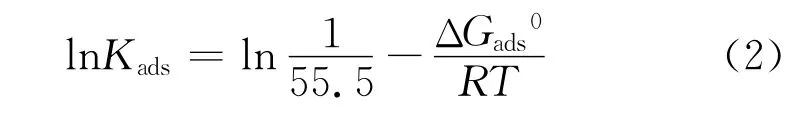
式中:R=8.314 kJ/(mol·K)为理想气体常数;T为热力学温度;55.5为水分子浓度,mol/L。

图8 试样在60℃,不含和含80 mg/L缓蚀剂的5%HCl酸洗液中腐蚀6 h后的表面SEM形貌Fig.8 Surface SEM morphology of samples after being corroded in 5%HCl pickling solution without(a)and with(b~d)80 mg/Linhibitors at 60℃for 6 h

图9 三种缓蚀剂的表面吸附等温线Fig.9 Surface adsorption isother mcurves of three corrosion inhibitor

表1 吸附等温直线拟合数据及ΔG ads0计算结果Tab.1 Calculation results of line fitting data of adsorption isother mandΔG ads 0
3 结论
采用双甘油酸硼酸酯和乙二胺或其衍生物为原料,经酰胺化-环化脱水反应合成了三种双咪唑啉基硼酸酯衍生物a、b和c。
失重腐蚀试验结果表明,三种合成缓蚀剂对Q235钢的缓蚀能力次序为:a>c>b;在60℃,5%HCl酸洗液中,当三种缓蚀剂加入量为100 mg/L,腐蚀时间6 h的条件下,缓蚀率均超过97%。
电化学试验结果表明:阴、阳极化曲线的腐蚀电流密度随着缓蚀剂加入量增加而减小,且阴极塔菲尔斜率变化显著,说明缓蚀剂在5%HCl酸洗液中是以抑制阴极反应为主的混合型缓蚀剂;添加三种缓蚀剂后,随加入量的增大,容抗弧直径和电荷转移电阻均显著增大。
