榴莲瓤皮/果核提取物对铜在硫酸溶液中的缓蚀机理
2020-09-12胡毓哲樊保民范贵锋
胡毓哲,樊保民,刘 浩,范贵锋,郝 华,杨 彪
(1.北京工商大学 材料与机械工程学院,北京100048;2.中国科学院 化学研究所,北京100190)
铜及其合金具有良好的热/电传导性、可加工性和较高的机械强度,被广泛用于热交换器、水/汽管网、制冷装置等工业核心设备[1]。服役过程中,腐蚀产物与污垢易随工作介质在设备表面沉积,形成锈/垢层,在影响生产效率的同时,还可能会造成严重的事故[2]。因此,需要定期使用特定的矿物酸(如硫酸)清洗工业设备以去除表面锈/垢沉积层;另一方面,若不采取必要的防护措施,用于清洗的酸溶液也会对设备基体产生强烈的电化学腐蚀。
使用缓蚀剂具有操作简便、成本低且效率高等诸多优点,已经成为减缓金属在各类介质中腐蚀的最常用方法之一[3-4]。有机缓蚀剂的分子结构中具有N、S、P和O等杂原子,不饱和键与共轭体系,易在金属表面吸附并组装形成保护层,具有较好的缓蚀效果,是近年来缓蚀剂研究的热点。咪唑衍生物[5]、喹啉衍生物[6]、曼尼希碱[7]等常用作酸洗缓蚀剂,在有效清除锈、垢的同时,可使基材表面钝化,有效保护金属。然而,随着环保理念的日益普及,开发环境友好型缓蚀剂已成为一个重要发展方向。提取植物组织内的有效成分,并以其为缓蚀剂减缓金属腐蚀具有资源丰富、成本低且可生物降解等优势,备受研究人员关注[8]。近年来,一些植物提取物相继被开发用作金属在腐蚀介质中的缓蚀剂,例如,银杏叶[9]、散沫花[10]、冬青树叶[11]、薄荷叶[12]。此外,从植物废弃物,如核桃青皮[13]、荔枝皮/果核[14]、豆粕[15]、醋栗壳[16]中提取缓蚀剂对助推我国垃圾分类回收与资源高值利用具有显著意义,而目前,关于从榴莲瓤皮及果核中提取缓蚀剂以减缓铜在硫酸溶液中腐蚀的研究还鲜见报道。
计算化学的发展为从电子或原子尺度解释缓蚀剂的缓蚀机理奠定了基础。多数情况下,腐蚀介质中有机缓蚀剂可通过静电作用、van der Waals力、电子转移等形式吸附于金属表面。借助基于密度泛函理论的量子化学计算可阐释缓蚀剂分子的电子结构与前线轨道分布,明确其与金属表面原子的可能作用位点。另一方面,使用分子动力学模拟可以明晰缓蚀剂分子在特定金属表面的吸附构型与能量特征。因此,通过理论计算以深入探讨腐蚀介质中缓蚀剂对金属的缓蚀机理逐渐被研究人员重视。
本工作以榴莲废弃物(瓤皮与果核)为原料,使用乙醇浸提法提取有效成分,并以此为缓蚀剂,通过电化学测试研究其对纯铜在0.5 mol/L H2SO4溶液中的缓蚀作用;结合表面分析技术,明确榴莲瓤皮/果核提取物(DPSE)在铜表面的吸附规律;借助量子化学计算与分子动力学模拟,阐明DPSE对铜在0.5 mol/L H2SO4溶液中的缓蚀机理,以期为植物废弃物的资源化利用提供有益参考。
1 试验
1.1 试样与溶液
榴莲白色内瓤皮与果核为金枕榴莲(原产地:泰国)剥离食用部分后的废弃物,经去离子水洗净、自然风干、50℃烘箱干燥3 h后浸入液氮冻干、取出、研磨得到干燥粉末(DPS,粒径约300μm),将其置于干燥器中备用。无水乙醇、丙酮、浓硫酸(H2SO4,98%)产自北京化工厂,均为分析纯。采用T3紫铜(纯度:99.99%,江苏扬州伟光机械厂)作试验基材;使用稀释后的H2SO4溶液(0.5 mol/L)作为腐蚀介质。
1.2 榴莲瓤皮/果核提取物(DPSE)的制备与分析
将15 g DPS粉末置于三口瓶中,倒入450 mL体积分数为70%的无水乙醇溶液,25℃搅拌混合1 h,继续于70℃回流提取5 h;滤去固形物,混入丙酮除去胶状物后,70℃旋转蒸发浓缩提取物,65℃真空干燥,得到淡黄色颗粒,即为提取物(DPSE,约1.6 g,产率10.7%)。使用i N10 MX型傅里叶变换红外光谱仪(FTIR,美国Ther mo Nicolet公司)分别对DPS与DPSE进行分析,波数4 000~400 c m-1。
1.3 电化学测试
电化学试验在Autolab PGSTAT302N型电化学工作站(瑞士Metrohm公司)上完成,采用三电极体系:有效面积1 c m2的纯铜为工作电极,Ag/Ag Cl电极为参比电极,铂网为辅助电极。试验溶液为含不同 量DPSE(0,150,300,450,600 mg/L)的0.5 mol/L H2SO4溶液,试验温度为25℃。电化学测试前,采用耐水砂纸(400~2 000号)逐级打磨工作电极表面至镜面,无水乙醇超声清洗,丙酮擦拭后氮气吹干,置于干燥器中备用。动电位极化测试扫描电位为-150~250 mV(相对开路电位),扫描速率为1 mV/s,根据腐蚀电流密度(Jcorr)计算缓蚀率(ηp),见式(1):

式中:Jcorr,0与Jcorr,i分别为试样在未添加和添加缓蚀剂的硫酸溶液中的腐蚀电流密度,μA/c m2。
在开路电位下进行电化学阻抗谱(EIS)测试,频率范围为10 mHz~100 k Hz,交流振幅为10 mV,根据等效电路拟合得出电荷转移电阻(Rct,Ω·c m2),并计算缓蚀率(ηe,%),见式(2):

式中:Rct,0与Rct,i分别为未添加和添加缓蚀剂的H2SO4溶液的电荷转移电阻,Ω·c m2。每个水平试验设置三组平行试样。
1.4 表面分析
将尺寸为1 c m×1 c m×1 c m的铜片按1.3节所述方法打磨至镜面,分别浸泡在未添加与添加600 mg/L DPSE的0.5 mol/L H2SO4溶液中24 h,取出后采用无水乙醇超声清洗,氮气吹干后使用Quanta FEG 250型扫描电子显微镜(美国FEI公司)进行表面形貌观察,加速电压10 k V。
1.5 理论计算
利用Materials Studio 8.0软件(美国BIOVIA公司)理论分析DPSE对铜的缓蚀机理。基于密度泛函理论,在Dmol3模块下采用广义梯度近似(GGA)的Perdew-Burke-Ernzerhof(PBE)泛 函DNP基组,引入隐性水溶剂模型(COSMO),对DPSE主要组分进行结构优化与能量分析,获取最优构型、分子偶极矩(μ,Debye)、最高占据轨道(HOMO)、最低未占轨道(LUMO)分布及对应能量(EHOMO与ELUMO,e V)。基于Lukovits理论,根据式(3)~(5)计算得到能隙(ΔE,e V)、全局硬度(γ,e V)与绝对电负性(χ,e V)等量子化学描述符。

借助分子动力学模拟研究DPSE主要组分在铜表面的吸附机理。选取并切割Cu(111)面为吸附表面,包含5层Cu原子(模拟过程中“冷冻”),构建12×12超晶胞,拓展模拟空间为2.86×2.86×3.84 n m3,具有周期边界条件,包含618个水分子(密度:1 g/c m3)、3个H3O+、3个SO42-与1个缓蚀剂分子;在Forcite模块下,选择NVT正则系统完成时长1 000 ps的动力学模拟,模拟时间步长1 fs,温度设置为298 K(Nose恒温器控制)。观察最后100 ps的结果,输出吸附平衡构型,并根据式(6)计算不同组分在Cu(111)面的相互作用能(Einter,kJ/mol)与结合能(Ebind,kJ/mol)。

式中:Etotal为系统总能量,kJ/mol;Esurf+sol为Cu表面及溶剂的总能量,kJ/mol;Einh为缓蚀剂分子的能量,kJ/mol。
2 结果与讨论
2.1 榴莲瓤皮与果核提取物的表征
DPSE的主要成分为咪唑衍生物、有机酸与多元醇,其中具有显著含量的化合物结构如图1所示,即1-甲基-4-硝基-1 H-咪唑(AIC)、3,5-二羟基苯甲酸(DBA)与3-(苄 氧 基)丁 烷-1,2,4-三 醇(BBT)[17]。由2图可见:3 402 c m-1处的宽吸收峰归属于醇羟基及伯氨基的伸缩振动;3 192 c m-1处的峰归属于羧酸基团上羟基的伸缩振动,同时对应羰基的伸缩振动峰出现在1 681 c m-1处;2 923 c m-1处的峰为-CH2-的伸缩振动峰,其弯曲振动峰位于1 455 c m-1处[16];1 650 c m-1处的峰为酰胺基团上羰基的伸缩振动峰;位于1 550 c m-1左右的吸收带为苯环分子骨架的振动吸收带[18];1 323 c m-1处的峰归属于C-N伸缩振动;1 035 c m-1处的峰为C-O的伸缩振动峰[13]。据此,从DPSE的FTIR谱图中获取的特征价键信息与图1所列化学结构具有良好的对应关系。对比图2中DPS与DPSE的谱图发现,干燥粉末的谱图缺少部分特征价键吸收峰。这是由于较多挥发性黄酮类化合物存在于DPS中,因这些化合物较强的“笼蔽效应”,在其FTIR谱图中未能充分体现特定基团的吸收峰。

图1 DPSE主要成分的结构式Fig.1 Chemical structures of main components of DPSE:(a)5-amino-1 H-imidazole-4-carboxamide(AIC);(b)3,5-dihydroxybenzoic acid(DBA);(c)3-(benzyloxy)butane-1,2,4-triol(BBT)
2.2 电化学行为
2.2.1动电位极化曲线
由图3可见:加入DPSE后,铜在0.5 mol/L H2SO4溶液中腐蚀过程的阴、阳极反应均向低电流方向移动;同时表1也显示Jcorr值随DPSE量的增加而减小:当DPSE加入量为600 mg/L时,Jcorr降至0.62μA/c m2,缓蚀率达92.6%。这说明DPSE可有效吸附于铜表面,形成保护层,隔离腐蚀性离子与溶解氧,进而减缓腐蚀[19]。Ecorr值随DPSE量的增加而略微负移,最大改变幅值仅为20.5 mV(小于85 mV),说明DPSE属于阴极抑制为主的混合型缓蚀剂[20]。进一步观察图3与表1发现,所有极化曲线阴极线性部分近似平行且bc随DPSE量的增加改变并不明显,说明添加DPSE不改变腐蚀反应的阴极过程。然而,添加DPSE后,ba逐渐增大,说明阳极反应活性因缓蚀剂吸附而被显著抑制。当DPSE加入量为450,600 mg/L时,阳极高电位区域出现斜率突然改变,这说明DPSE在铜表面吸附趋于饱和,部分缓蚀剂分子在高电位诱导下发生脱附。同时,当DPSE加入量高于600 mg/L时,Jcorr改变不显著,也说明DPSE在金属表面的吸附已趋于饱和。据此,600 mg/L可视为25℃下DPSE对铜在0.5 mol/L H2SO4溶液中的最佳缓蚀浓度。

图2 DPS与DPSE的红外光谱Fig.2 Fourier transfor minfrared spectra of DPS and DPSE

图3 25℃下铜在含不同量DPSE的0.5 mol/L H2SO4溶液中的动电位极化曲线Fig.3 Potentiodynamic polarization curves of copper in 0.5 mol/L H 2SO4 solution containing different concentrations of DPSEat 25℃

图4 25℃下铜在含不同量DPSE的0.5 mol/L H2SO4溶液中的电化学阻抗谱Fig.4 EISof copper in 0.5 mol/L H2SO4 solution containing different concentrations of DPSEat 25℃
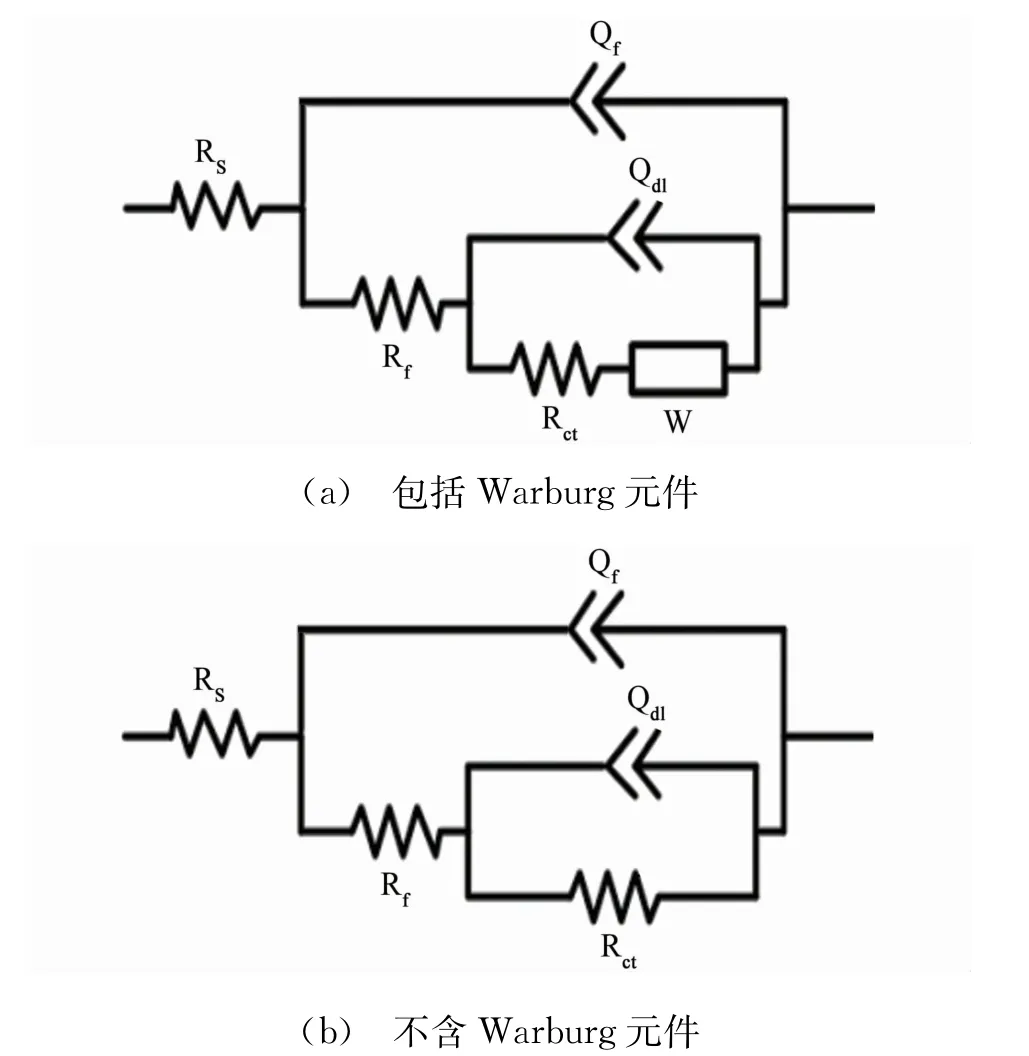
图5 电化学阻抗谱拟合等效电路Fig.5 Equivalent circuits for the obtained impedance spectra:(a)with Warburg element;(b)withoutWarburg element

表1 极化曲线拟合结果Tab.1 Fitting results of polarization curves
2.2.2电化学阻抗谱
图4所示为25℃下铜在含不同量DPSE的0.5 mol/L硫酸溶液中的电化学阻抗谱,采用图5所示等效电路拟合得到溶液电阻(Rs)、膜电阻(Rf)、电荷转移电阻(Rct)与War burg阻抗(W)等参数。此外,鉴于铜电极表面的固有粗糙度与不均一性,拟合过程中使用常相位角元件(Q)替代纯电容(C),并通过式(7)计算得到膜电容(Cf)与双电层电容(Cdl):
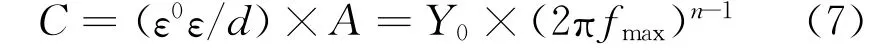
式中:ε0与ε分别为真空与吸附层介电常数,F/c m;d为吸附层厚度,c m;A为电极有效面积,c m2;Y0为比例系数,sn/Ω;fmax为最大频率,Hz;n为相移指数。所有阻抗参数列于表2。
由图4可见:加入DPSE后,所有Nyquist曲线在高频区均呈现不规则容抗弧,说明DPSE仅抑制铜在腐蚀介质中的反应活性,不改变腐蚀反应机理[21]。铜在未添加与添加150,300 mg/L DPSE时的曲线于低频区出现Warburg阻抗,说明在铜/溶液界面存在离子或溶解氧的扩散过程[22]。高频区容抗弧的曲率半径随DPSE添加量的升高而逐渐增大,表明DPSE吸附于铜表面并逐渐形成均一防护层,致使发生电化学反应的电荷转移电阻逐渐升高。值得注意的是,当DPSE质量浓度达到450 mg/L以上时,低频区未出现Warburg阻抗,充分证明缓蚀剂分子在铜表面的吸附已趋于致密饱和,有效隔离金属表面与腐蚀介质接触,进而减缓阳极溶解过程。由表2可见:随DPSE量的增加,Rf由10.2Ω·cm2(空白)升至202.1Ω·cm2(600 mg/L DPSE);同时,Rct由0.65 kΩ·cm2(空白)显著提升至8.02 kΩ·c m2(600 mg/L DPSE),表明DPSE的吸附增加了铜在H2SO4溶液中发生电化学腐蚀的动力学电阻。另一方面,Cdl随DPSE量的增加逐渐下降;由式(7)可知,DPSE在铜表面的吸附驱替了预先吸附的水分子及等离子,增加双电层厚度的同时,降低其介电常数并减少电极活性面积,进而Cdl降低。

表2 电化学阻抗谱拟合结果Tab.2 Fitting results of EIS
综合电化学分析的结果可得出推论:DPSE可有效减缓铜在0.5 mol/L硫酸溶液中的腐蚀,缓蚀率达92.6%;DPSE吸附于铜表面,同时抑制腐蚀反应的阴、阳极过程并显著提升界面电荷转移电阻。
2.3 吸附等温式
通过吸附等温式可以明确硫酸溶液中DPSE在铜表面的吸附机理。基于动电位极化所得缓蚀率,计算DPSE在铜表面的吸附覆盖率(θ=ηp/100),并使用多种吸附等温式进行拟合;本工作采用式(8)所示Langmuir等温式进行拟合(R2=0.992),结果如图6所示。拟合线斜率接近于1,说明DPSE以单分子层的形式在铜表面形成保护层,且吸附层内不同缓蚀剂分子间的相互作用可忽略。由式(9)可计算得到DPSE在铜表面的吸附自由能(ΔGads)为-33.5 kJ/mol。ΔGads为负值,说明DPSE在硫酸溶液中可自发吸附于铜表面。另一方面,若ΔGads大于-20 kJ/mol,认为吸附过程为物理吸附;若ΔGads小于-40 kJ/mol,则认为吸附过程为化学吸附[23]。H2SO4溶液中DPSE在铜表面吸附的ΔGads接近-40 kJ/mol,表明DPSE在铜表面的吸附是以化学吸附为主的混合型吸附[24]。

式中:C为缓蚀剂质量浓度,mg/L;Kads为吸附平衡常数;Cwater为水的质量浓度,1 000 g/L;R为普适气体常数,8.314 J/(K·mol);T为热力学温度,K。
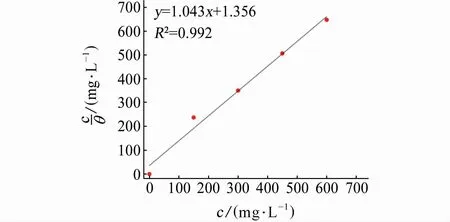
图6 DPSE在铜表面的吸附等温式Fig.6 Adsorption isother mof DPSE on copper surface

图7 25℃下铜在不含和含600 mg/L DPSE的0.5 mol/L H2SO4溶液中浸泡24 h后的表面形貌Fig.7 Surface morphology of copper after immersion in 0.5 mol/L H2SO4 solution without(a)and with 600 mg/L DPSE(b)at 25℃for 24 h
2.4 表面形貌
由图7可见:在不含缓蚀剂的25℃0.5 mol/L硫酸溶液中浸泡24 h后,铜表面出现大量坑与裂缝等严重的均匀腐蚀;在含600 mg/L DPSE的25℃0.5 mol/L H2SO4溶液中浸泡24 h后,铜表面较平整,未现明显腐蚀迹象,且表面还可观察到因机械抛光出现的划痕。这表明DPSE可有效减缓铜在0.5 mol/L硫酸溶液中的腐蚀。
2.5 理论模拟
2.5.1量子化学计算
基于密度泛函的量子化学计算,在隐性溶剂模型(COSMO)下获取DPSE主要成分AIC、DBA与BBT的最优分子构型、HOMO与LUMO轨道分布,从原子尺度解释DPSE对铜在硫酸溶液中的缓蚀机理,结果如图8所示。由图8可见:AIC、DBA与BBT的最优分子构型均呈现平面结构,这有利于以平行取向吸附于金属表面。由前线轨道理论可知[25],分子内HOMO区域具有较强供电子倾向,可向金属原子空置d轨道提供电子形成化学键;而LUMO区域则具有较强的接收电子能力,可接收因界面电化学反应从金属表面逸出的自由电子形成反馈键。
观察图8发现,AIC分子的HOMO与LUMO轨道贯穿于整个分子;DBA分子的HOMO轨道集中于羧基以外的部分,而LUMO则遍布分子整体;BBT分子的HOMO分布于端羟基以外的部分,而LUMO集中在具有缺电子效应的苯环部分。

图8 榴莲瓤皮/果核提取物主要成分的最优空间构型(上)、HOMO(中)与LUMO(下)轨道分布Fig.8 Optimized structures(upper),HOMO(middle)and LUMO(lower)distributions of identified components in durian peel and stone
表3列出了AIC、DBA与BBT分子的全局量子化学描述符。一般认为缓蚀剂分子的EHOMO越高,其供电子能力越强;ELUMO越低,越易接收外界电子;能隙(ΔE)越小,缓蚀剂分子越易在金属表面吸附形成保护层[26]。由表3可见:AIC分子的EHOMO最高(-5.16 e V),其向铜表面提供电子的能力最强;DBA分子的ELUMO最低(-2.56 e V),其接收铜表面自由电子的能力最强;同时,DBA分子的能隙最小(3.15 e V),且绝对电负性(4.14 e V)与偶极矩(8.21 Debye)最高,表明其倾向于在铜表面提供电子并产生分子极化以牢固吸附于金属表面。根据软硬酸碱理论,金属被是软酸,易与软碱发生反应[27]。三种化合物的硬度(γ)均较小,同时具有得电子能力,可认作软碱;因此,它们均可与铜表面原子发生反应,形成吸附层。
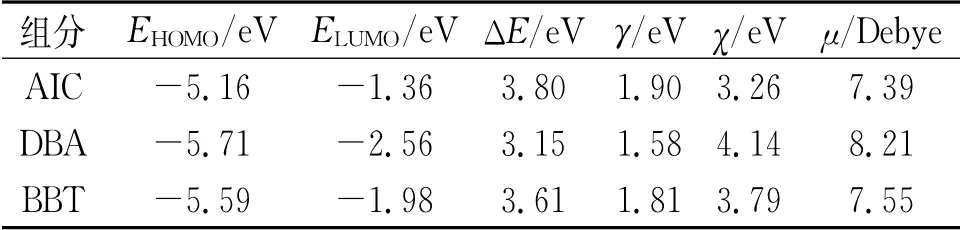
表3 榴莲瓤皮/果核提取物主要成分的量子化学描述符Tab.3 Quantumchemical descriptors of the identified components in durian peel and stone
2.5.2分子动力学模拟
298 K条件下DPSE的三种主要成分在Cu(111)面吸附过程的动力学模拟结果如图9所示。由图9可知,溶液环境中AIC、DBA与BBT均以平行的分子构象吸附于铜表面,这与上述基于量子化学计算结果得出的推论保持一致。同时,三种化合物分子平行吸附于金属表面有利于最大限度地覆盖活性反应位点,进而有效抑制腐蚀反应[28]。缓蚀剂在金属表面的吸附强度可用相互作用能(Einter)与结合能(Ebind)评价,三种化合物在Cu(111)面吸附的相关能量列于表4。由表4可知,AIC、DBA与BBT在Cu(111)面吸附的Einter值均为负数,表明三种分子在铜表面的吸附均属于热力学有利过程[29];同时,吸附过程的Ebind均较高,说明三种分子均可牢固吸附于Cu(111)面。对比不同分子的Ebind值发现,DBA分子的最高,其在铜表面的吸附最稳定,这与基于量子化学描述符得出的结论相互吻合。
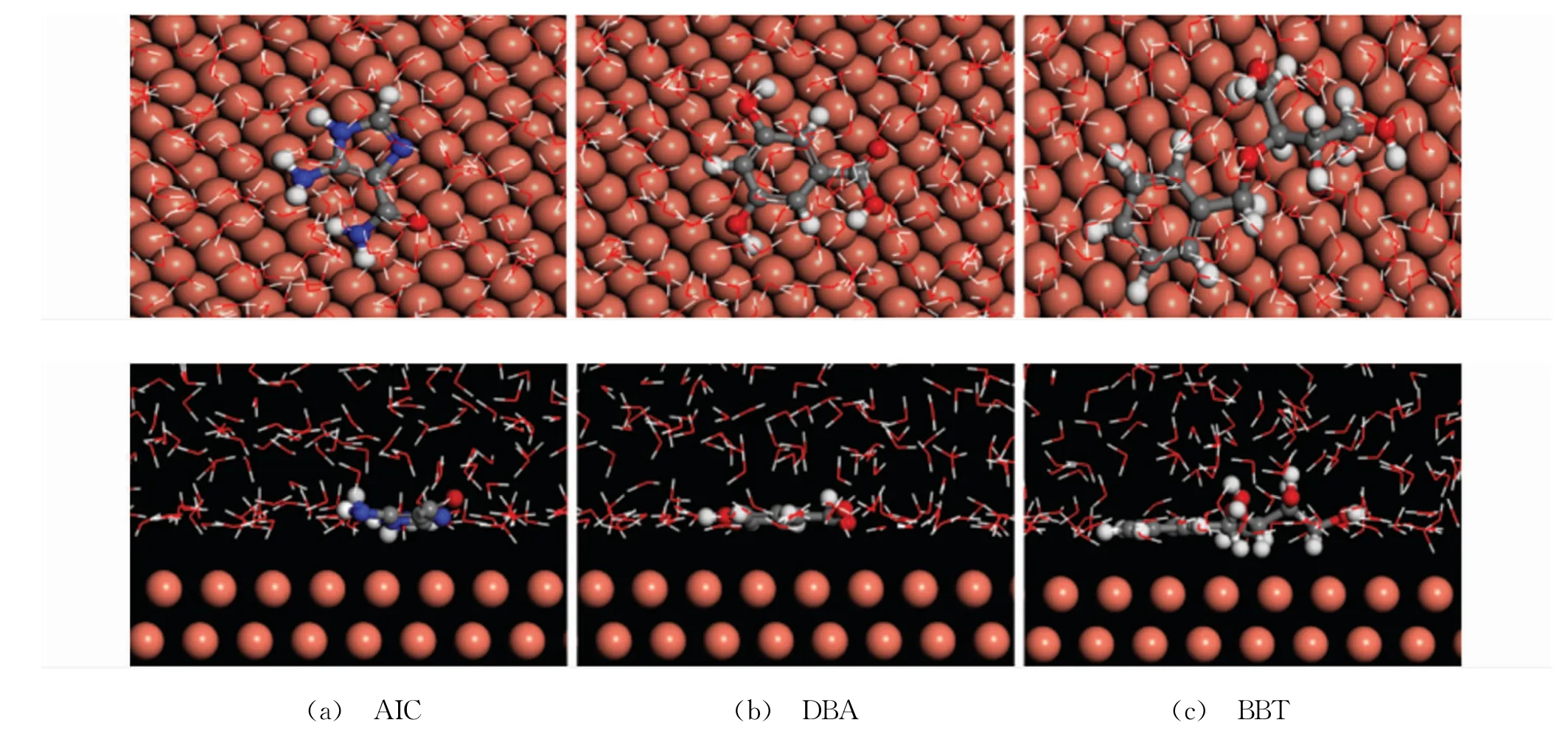
图9 298 K下DPSE的三种主要成分在Cu(111)面的平衡吸附构型的顶(上)、侧(下)视图Fig.9 Equilibriumadsorption configuration for different components of durian peel and stone extract on Cu(111)plane at 298 K

表4 DPSE的三种主要成分在Cu(111)面的相互作用能与结合能Tab.4 Interaction energy and binding energy for different components of DPSEon Cu(111)plane
3 结论
(1)榴莲瓤皮/果核提取物(DPSE)含有较丰富的端羟基、氨基、羧酸与酰胺基团,主要组分对纯铜在0.5 mol/L H2SO4溶液中具有显著的缓蚀作用;缓蚀效果随DPSE量的增加而增强,当DPSE加入量为600 mg/L时,缓蚀率可达92.6%。
(2)DPSE主要以化学吸附的形式组装于铜表面,符合Langmuir吸附等温式,可同时抑制铜在H2SO4溶液中腐蚀的阴、阳极过程,减小腐蚀电流密度并显著增强界面电荷转移电阻,属于阴极抑制为主的混合型缓蚀剂。
(3)DPSE的三种主要组分的最优构型与前线轨道分布利于它们以平行取向吸附于铜表面,其中以3,5-二羟基苯甲酸的吸附最稳定(Ebind=393.23 kJ/mol)。
