大鼠心脏缺血再灌注后发生复杂室性心律失常对左心室功能的影响△
2020-09-08唐咏文崔同涛许玲玲
唐咏文,崔同涛,王 敏 ,郭 涛,许玲玲 ,刘 津,谭 宁
(1.广东省心血管病研究所成人超声科广东省人民医院(广东省医学科学院),广州510080;2.广州医科大学附属第一医院心血管内科,广州510120)
随着社会人口老龄化,心肌梗死(myocardial infarction,MI)的发病率逐年升高。血管急性闭塞不仅导致心肌丢失,还会使心室重构导致慢性心力衰竭[1]。尽早开通血管恢复灌注可以减轻心肌坏死、重构并改善预后[2]。心肌组织再灌注后出现心肌损伤及功能恶化,诱发心肌细胞坏死和凋亡加重[3-4],即缺血再灌注损伤(ischemia reperfusion injury,IRI)。心律失常,特别是复杂室性心律失常包括频发室性期前收缩、室性心动过速是再灌注损伤的常见表现,且与心功能关系密切[5-6]。研究再灌注损伤致心律失常的特征和转归影响,对临床工作有指导意义。临床中发现急性MI 患者延迟再灌注后心功能改善不明显,甚至出现病情恶化[7]。了解心律失常如何影响再灌注损伤可以帮助进一步认识延迟再灌注心肌损伤。动物心肌IRI 模型建立方法包括体内原位冠状动脉结扎或Langendorff 离体心脏缺血再灌注方法[8]。我们通过原位结扎法观察大鼠心肌再灌注时心律失常与左心室功能变化及细胞凋亡改变,探讨心律失常对再灌注损伤左心室功能的影响。
1 材料和方法
1.1 实验动物
取 7~8 周 龄 、体 质 量 180~220 g 雄 性 SD(Sprague Dawley)大鼠[许可证号:SCXK(粤)2013-0034],按随机数字表法分成3 组,每组至少12 只。操作遵守国家卫生研究院实验动物福利实验指南。实验已通过广东省医学科学院动物实验伦理审批,编号:[GDREC2014016H(R1)],且在中山医科大学无特定病原体(SPF)级实验室完成(登记号:2016-218DS)。
1.2 分组及干预
实验设计为大鼠原位心脏前降支血管结扎及释放术。大鼠分为对照组、MI再灌注组和延迟再灌注组(n≥12)。对照组为假手术,前降支下仅穿线无结扎;MI再灌组(缺血1 h后再灌注,A组)为前降支结扎60 min 后释放复灌注;延迟再灌注组(缺血4 h后再灌注,B 组)为结扎4 h 后释放复灌注。观察并记录复灌注后大鼠心肌颜色、心电图改变;术后24 h和3 d分别记录大鼠心电图及心律失常。复杂室性心律失常(complex ventricular arrhythmias,CVTA)指频发室性期前收缩或短阵室性心动过速[9]。术后72 h 行超声评估左心室功能变化;Masson′s 染色评估MI 区域形态及TUNEL 染色检测心肌凋亡。
1.3 缺血再灌注模型建立
SD 鼠3 d 适应期后禁食过夜,术前称体质量。10%水合氯醛以0.35 mL/100 g 剂量经腹腔给药麻醉大鼠后以18G 留置针经口腔行气管插管接呼吸机。大鼠四肢连接心电图机导联,于胸骨旁0.5 cm 处第3 至5 肋间切开皮肤约2 cm,钝性分离皮下组织、肌肉[10]。将小棉团放在左心耳下帮助暴露左前降支(left descending artery,LAD)。以6-0 带针眼科无损缝线于肺动脉圆锥根部进针,于左心耳下 2~3 mm 处出针过线,针宽 2~3 mm,深0.5~1.0 mm。轻提缝线如见前壁心肌颜色变淡,可初步判断结扎有效。放置一段(5 mm)橡皮PE段于结扎处心脏表面,在橡皮PE 段上打结。前壁心肌呈苍白色及肢Ⅱ导联ST 段弓背抬高1 mm 以上提示缺血成功。复灌30 s 后通过观察前壁心肌颜色恢复及心电图ST段回落判断再灌注成功。
1.4 M 型超声检测左心形态及功能
建模72 h 后大鼠在乙醚麻醉下行M 型超声检测。在左心室长轴切面测量左心室舒张末期内径(left ventricular end diastolic dimension,LVEDD)、左心室收缩末期内径(left ventricular end-systolic dimension,LVESD)和左心室短轴缩短率(left ventricular fraction shortening,LVFS);四腔心切面计算左心室舒张末期容量(left ventricular end-diastolic volume,LVEDV)、左心室收缩末期容量(left ventricular end-systolic volume,LVESV);Simpson′s 法计算左心室射血分数(left ventricular ejection fraction,LVEF)、每搏射血量(stroke shot,SS)和心排血出量(cardiac output,CO)。检测由专业超声技师在Visual Sonics Vevo2100 动物超声机上完成。
1.5 心肌组织学染色和TTUUNNEELL 法检测细胞凋亡
再灌注后 72 h 行 Masson′s 染色及 TUNEL 染色反映各组心肌缺血危险区组织形态学及细胞凋亡改变。取结扎点下2 mm 处心肌组织于4%多聚甲醛固定,酒精脱水后石蜡包埋并切片。行Masson′s染色后在光学显微镜下观察。采用改进的TUNEL方法[11],石蜡包埋切片预处理、脱蜡后多聚甲醛固定;2 mg/mL的蛋白酶K溶液通透样本;加入450 μL荧光素片段末端标记反应混合物以及50 μL TdT酶行标记反应,封片并荧光激发。在绿色荧光滤片下观察被标记的红色荧光凋亡细胞。
1.6 统计学分析
数据采用SPSS 18.0 进行统计学分析。计量资料经Levene′s 检验为正态分布以()表示,组间比较采用独立样本t检验或单因素方差分析(one-way ANOVA);组内多重比较用最小意义差异检验LSD法或Dummetts(方差不齐时)。计数资料以[n(%)]表示,组间比较用卡方(χ2)检验。以P<0.05为差异有统计学意义,所有检验均为双侧检验。
2 结 果
2.1 各组大鼠左心室功能超声指标比较
再灌注A 组和延迟再灌注B 组大鼠SS、LVEF、LVFS 和CO 较对照组明显下降,差异有统计学意义(P<0.05),见表1。再灌注A 组和延迟再灌注B组大鼠LVESV 呈增加趋势,但两组比较差异无统计学意义(P>0.05)。LSD 法分析结果显示,延迟再灌注B 组较对照组大鼠LVESD 明显增加(f=1.0,P=0.038);延迟再灌注B 组较对照组大鼠 LVESV 明显增加(f=46.40,P=0.03);SS、LVEF 和 LVFS 均明显下降(f=33.70,P=0.02;f=21.53,P=0.003;f=14.67,P=0.002),差异有统计学意义。再灌注A 组较对照组大鼠SS、LVEF 和LVFS 均明显下降(f=25.71,P=0.02;f=14.21,P=0.04;f=8.71,P=0.04);再灌注A 组和延迟再灌注 B 组大鼠 SS、LVEF 和 LVFS 比较,差异无统计学意义(f=7.98,P=0.33)。再灌注A组及延迟再灌注B 组大鼠CO 较对照组均明显下降,差异有统计学意义(A 组vs.对照组:f=8.93,P=0.01;B 组vs.对照组:f=11.92,P=0.001)。再灌注 A 组和延迟再灌注B 组大鼠心率、体质量及LVEDD 及LVEDV比较,差异无统计学意义(P>0.05)。
2.2 再灌注后发生CCVVTTAA 亚组和无CCVVTTAA 亚组大鼠左心室超声指标比较
延迟再灌注B 组大鼠再灌注后心律失常发生率为67%(8/12),其中 1 例为心房颤动,1 例为偶发房性期前收缩;50%(6/12)例表现为室性期前收缩二联律或短阵室性心动过速。再灌注A 组大鼠中发现3 例短阵室性心动过速、1 例频发室性期前收缩二联律及2 例房性期前收缩。再灌注A 组大鼠CVTA 发生率为 33%(4/12),延迟再灌注B 组大鼠CVTA 发生率为50%(6/12),两组比较差异无统计学意义(χ2=0.69,P=0.41)。再灌注发生CVTA亚组和无CVTA 亚组大鼠体质量、心率、LVEDD 和LVEDV 比较,差异无统计学意义(P>0.05);再灌注发生CVTA 亚组大鼠心脏收缩功能明显下降,包括 LVESD 和 LVESV 增大,SS、LVEF、LVFS 和 CO 下降,差异有统计学意义(P<0.05),见表2。
2.3 再灌注后及延迟再灌注后发生CCVVTTAA 亚组和无CCVVTTAA 亚组大鼠左心室超声指标比较
与再灌注后无CVTA 亚组大鼠比较,再灌注后发生CVTA 亚组大鼠的LVESD(f=-4.57,P=0.001,图1A)、LVESV(f=-4.12,P=0.002,图1C)、LVEDD(f=-2.75,P=0.02,图1B)和LVEDV(f=-2.76,P=0.02,图1D)增大;SS(f=2.51,P=0.04,图1E)、LVEF(f=5.62,P<0.001,图1F)、LVFS(f=5.08,P=0.001,图1G)、CO(f=2.61,P=0.03,图1H)下降,差异有统计学意义。
表1 3 组大鼠左心室超声指标比较 [n=12,±s]
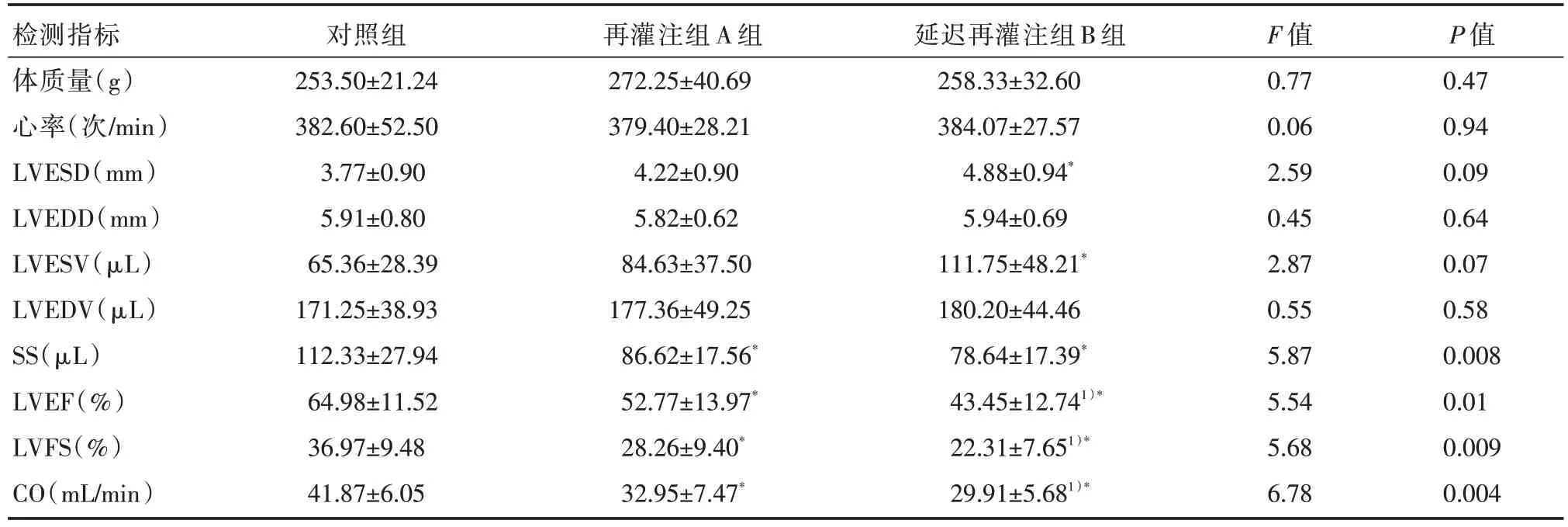
表1 3 组大鼠左心室超声指标比较 [n=12,±s]
注:与对照组比较,*P<0.05;与再灌注组A 组比较,1)*P<0.05
检测指标体质量(g)心率(次/min)LVESD(mm)LVEDD(mm)LVESV(μL)LVEDV(μL)SS(μL)LVEF(%)LVFS(%)CO(mL/min)对照组253.50±21.24 382.60±52.50 3.77±0.90 5.91±0.80 65.36±28.39 171.25±38.93 112.33±27.94 64.98±11.52 36.97±9.48 41.87±6.05再灌注组A 组272.25±40.69 379.40±28.21 4.22±0.90 5.82±0.62 84.63±37.50 177.36±49.25 86.62±17.56*52.77±13.97*28.26±9.40*32.95±7.47*延迟再灌注组B 组258.33±32.60 384.07±27.57 4.88±0.94*5.94±0.69 111.75±48.21*180.20±44.46 78.64±17.39*43.45±12.741)*22.31±7.651)*29.91±5.681)*F 值0.77 0.06 2.59 0.45 2.87 0.55 5.87 5.54 5.68 6.78 P 值0.47 0.94 0.09 0.64 0.07 0.58 0.008 0.01 0.009 0.004
表2 再灌注后发生CVTA 亚组和无CVTA 亚组大鼠左心室超声指标比较 [±s]

表2 再灌注后发生CVTA 亚组和无CVTA 亚组大鼠左心室超声指标比较 [±s]
检测指标n体质量(g)心率(次/min)LVESD(mm)LVEDD(mm)LVESV(μL)LVEDV(μL)SS(μL)LVEF(%)LVFS(%)CO(mL/min)再灌注无CVTA 组14 264.71±40.13 385.62±24.08 4.05±0.93 5.74±0.76 77.63±43.08 166.45±49.26 88.82±20.41 55.65±12.78 30.02±8.51 34.05±7.49再灌注发生CVTA 亚组10 266.10±33.54 376.29±31.97 5.12±0.53 6.28±0.39 126.97±28.14 200.94±27.20 73.97±6.67 37.55±68.14 18.65±3.84 27.76±2.68 F 值-0.09 0.82-3.27-2.06-3.16-2.0 2.21 4.07 3.93 2.90 P 值0.93 0.42 0.004 0.051 0.005 0.058 0.038<0.001 0.001 0.01
与延迟再灌注无CVTA 亚组大鼠比较,延迟再灌注发生 CVTA 亚组大鼠 LVEF(f=2.76,P=0.04,图1F)、LVFS(f=3.79,P=0.03,图1G)减少,LVESV(f=-2.22,P=0.02,图1C)增加,差异有统计学意义;两亚组大鼠SS(f=1.05,P=0.32,图1E)、CO(f=1.20,P=0.26,图1H)、LVESD(f=-1.36,P=0.21,图1A)、LVEDD(f=-0.87,P=0.41,图1B)、LVEDV(f=-0.79,P=0.45,图1D)比较,差异无统计学意义。
2.4 形态学染色及凋亡染色结果分析
如图2A 所示,Masson′s 染色可见再灌注发生CVTA 亚组大鼠心肌纤维断裂范围均较大;同时心肌纤维化程度更加明显,心肌细胞明显萎缩,而心室肌层无明显变薄。图2B 中TUNEL 染色显示绿染的心肌凋亡细胞核占比在再灌注发生CVTA 亚组大鼠中均较再灌注无CVTA 组大鼠增多,提示发生CVTA 亚组大鼠心肌细胞丢失更多。在延迟再灌注组有更多心肌细胞发生凋亡,对左心功能影响更明显。
3 讨 论
本实验结果显示,再灌注后室性心律失常在延迟再灌注组大鼠的发生率约为延迟再灌注组大鼠的1.4 倍。CVTA 在再灌注即刻至再灌注后数天均可观察到。无论是在再灌注组或延迟再灌注组,大鼠发生室性心律失常对其LVESV、LVEF 和LVFS 均有明显的负性影响。根据既往对4 400 例MI 行再灌注治疗的患者报道,再灌注损伤伴室性心律失常可高达20%~25%,其中室性心动过速最为常见,约占所有心律失常的35%,且无论再灌注时抑或晚期室性心律失常均增加患者院内及院外3~5 倍死亡风险[5]。同期有研究采用心脏核磁共振(CMR)方法评估损伤心肌,提示延迟再灌注下的心肌受损更严重,表现为心肌坏死面积增大和血管微循环阻力增加[12]。
心肌细胞再灌注后细胞线粒体内过氧自由基释放及细胞内抗氧化能力减弱;细胞膜脂质的过氧化作用导致其通透性增加并影响细胞功能[13-14]。钙超载后心肌细胞内钙离子增加会导致心肌细胞早后除极,心肌细胞自律性降低,诱导心律失常发生[15]。同时过氧自由基产生后可激活线粒体K+(ATP)通道过多开放,影响线粒体膜电位[16-17],同时也可激发内源性细胞凋亡途径致心肌细胞凋亡。在本实验中,心脏Masson′s 染色提示再灌注后发生室性心律失常亚组大鼠的纤维化程度更加明显,心肌细胞萎缩也更加明显。而TUNEL 染色也提示发生CVTA 亚组大鼠心肌细胞核凋亡比例均较再灌后无CVTA 亚组大鼠增多;结合超声结果可发现其显著影响左心室的收缩功能,表现为LVEF、LVFS 下降且 LVESV 变大。
再灌注损伤的干预可以采用缺血预处理[18](ischemic preconditioning,IP)和远端预处理[19](remote post-conditioning)方法进行预防。基础研究提示远端肢体IP 通过影响心肌K+(ATP)通道有效保护心脏收缩功能,并可有效减少再灌注后心律失常发生[20]。同样在临床中,首次医疗接触后给予急性胸痛患者外周动脉IP,可以有效减少介入治疗中心脏靶血管无复流的发生率[19]。同样冠状动脉缺血后处理(ischemic post-conditioning)可以通过对靶血管多次短暂的开通和阻断操作实现。既往研究发现,缺血后处理可明显降低室性心律失常持续时间,是减少再灌注后心肌损伤和改善预后的一种治疗策略[21]。同时联合新型的抗血小板药物和抗凝剂,也可以大约降低35%~50%心肌最终受损面积。抗氧自由基药物如辅酶Q10 可以通过改善心肌细胞能量代谢;钙通道阻滞剂可以通过降低钙超载的直接心肌损害和通过降低后负荷,增加CO 改善MI 后心律失常和改善后续可能的心力衰竭[20]。结合本实验观察结果,提示再灌注后发生CVTA 可以显著影响左心室收缩功能;特别是在延迟缺血再灌注条件下,室性心律失常对左心室功能影响更加明显。
总之,MI 再灌注后发生CVTA 可致左心室收缩功能进一步下降;同时伴有更加明显的心肌细胞萎缩、细胞凋亡和组织纤维化。
