免疫检查点抑制剂的毒副作用及其管理
2020-09-08李文宇李灵常霍介格
李文宇,李灵常,霍介格
李文宇,南京中医药大学第三临床医学院 江苏省南京市 210028
李灵常,霍介格,南京中医药大学附属中西结合医院 江苏省南京市 210028
0 引言
近年来,免疫疗法的发展为肿瘤治疗开辟了新途径,特别是以细胞毒性T淋巴细胞相关抗原4 (cytotoxic T lymphocyte-associated antigen-4,CTLA-4)和程序性死亡受体1 (programmed death-1,PD-1)及其配体1(programmed death-ligand-1,PD-L1)为治疗靶点的免疫检查点抑制剂(immune checkpoint inhibitors,ICI)已广泛用于各种实体瘤的治疗.ICI类药物以免疫系统为靶点,通过与T细胞或肿瘤细胞表面免疫负性调节因子结合,影响 T 细胞活性,继而发挥抑制肿瘤免疫耐受和逃逸的作用[1].当前,随着ICI治疗适应症的扩大,临床运用越来越广泛,其毒副作用(immune-related adverse events,irAEs)日渐凸显.鉴于irAEs的复杂性及其管理的必要性,欧洲临床肿瘤协会[2]、美国临床肿瘤学[3]、美国国家综合癌症网络[4]、国际肿瘤免疫治疗协会[5]和中国临床肿瘤学会[6]相继发布了irAEs管理指南.但随着ICI在临床大量使用,新的联合方案不断出现,因而一些新的、少见的毒性反应也逐渐显现.本文结合各临床指南和最新研究,分别从临床表现和管理措施两个方面对抗CTLA-4单抗和抗PD-1/PD-L1单抗在治疗中的常见irAEs进行综述,以期为临床提供借鉴.
1 irAEs及其管理概述
irAEs的发生率及严重程度通常与药物种类、肿瘤类型、irAEs既往史及其他免疫相关性病史有关.如在抗CTLA-4单抗单药治疗中任何级别的irAEs发生率为72%[7],在抗PD-1/PD-L1单抗单药治疗中为66%[8],ICI联合治疗中具有更高的发病率[9,10];在单药治疗中,CTLA-4阻断剂诱导的3-5级不良事件较PD-1/PD-L1阻断剂而言更为常见(20%-25%vs7%-12%)[11,12];不同肿瘤患者常见的毒性类型也不尽相同,如与非小细胞肺癌患者相比,恶性黑色素瘤患者的胃肠道毒性和皮肤毒性更为常见,而肺炎相对少见[13];此外,既往有自身免疫性疾病或既往有irAEs病史的患者,在接受ICI治疗后,可有原发病症状恶化、既往irAEs复发或新生irAEs发展的风险[14].
irAEs通常发生于ICI疗程的前4 mo内[15],但第一次用药后的急性发生事件和ICI治疗结束后数年的迟发性事件亦有报道[2,3].irAEs可影响机体的所有器官,由轻到重可表现为对生活质量的轻微影响到对生命的威胁.常见的irAEs包括皮肤、胃肠道和内分泌毒性,高致命风险的irAEs包括神经毒性、心脏毒性和肺毒性[16].同时,irAEs相关性死亡事件通常发生于治疗早期,其在ICI联合治疗和单药治疗中的中位发生时间分别为14.5 d和40 d[14].
irAEs的管理是多方面,应注重多学科的相互协作.主要包括特殊人群筛查、基线评估、定期监测、鉴别诊断、治疗管理等.前期筛查评估重点是围绕ICI禁忌者、irAEs高风险者及原发病预后差者展开,临床医生必须充分权衡利弊,谨慎选择ICI治疗.当前,由于缺乏irAEs相关病理学确诊依据,对于免疫相关毒性的早期诊断主要在于对肿瘤进展、基础疾病和感染等并发症的鉴别.irAEs的治疗管理普遍遵照常见不良反应事件评价标准4.03版的处理原则,在很大程度上依赖于糖皮质激素的使用(内分泌相关毒性除外).临床医生应根据毒性分级来判断是否使用糖皮质激素,以及使用激素方式、剂量和剂型[6].特别是对于严重的毒性反应,例如心脏、肺及神经系统毒性,要首选静脉滴注高剂量糖皮质激素[17].若糖皮质激素治疗无效,应考虑使用其他免疫抑制剂,包括TNF-α抑制剂(如英夫利西单抗)、吗替麦考酚酯(mycophenolate mofetil,MMF)、他克莫司及生物性免疫制剂如抗胸腺细胞免疫球蛋白(anti-thymocyte globulin,ATG)等[6].
2 皮肤毒性
皮肤毒性是ICI治疗中出现时间早且发生率高的毒副反应[18],通常于ICI治疗后的3-6 wk出现[19].据报道,在接受PD-1/PD-L1阻断剂治疗的患者中,约30%-40%的患者会发生皮肤毒性反应,而CTLA-4检查点抑制剂具有更常见且严重的皮肤毒性,总发生率及3-5级毒性发生率分别约为47%-68%和2%.此外,CTLA-4和PD-1/PD-L1联合阻断的皮肤毒性发病率高达58%-71%[19-22].
皮肤毒性常表现为皮疹、瘙痒和白癜风.皮疹以红斑、丘疹或丘脓疱疹为主要特征,多分布于四肢和躯干,常合并瘙痒[23].白癜风多见于黑色素瘤患者的抗PD-1单药治疗中,白癜风的发生率和药物疗效呈正相关[24,25].在一项关于PD-1阻断剂的Meta分析中显示,白癜风在帕博利珠单抗和纳武单抗单药治疗中的发病率分别为8.3%和7.5%,且都见于黑色素瘤患者,极少见于其他恶性肿瘤的ICI治疗[23].严重的皮肤毒性文献亦有涉及,但发生率极低,包括大疱性天疱疮(bullous pemphigoid,BP)、约翰逊-史蒂文斯综合征(Stevens-Johnson syndrome,SJS)、中毒性表皮坏死松解症(toxic epidermal necrolysis,TEN)及伴嗜酸性粒细胞增多症和全身症状的药物反应(drug reaction with eosinophilia and systemic symptom,DRESS)等[18,26].
大部分的皮肤毒性的程度(表1)都是低级别的(1-2级),无需停止ICI治疗,可采取局部使用润肤剂、口服抗组胺药和/或局部使用中效皮质类固醇激素对症处理[27].对于经治疗的2级皮肤毒性患者,若症状未见改善,应考虑停止ICI治疗.3-4级的皮肤毒性反应较为罕见,需暂停ICI治疗,改用高效皮质类固醇激素局部积极治疗[2,4],并组织皮肤科专家会诊.对于出现SJS、TEN或DRESS等严重的毒性反应,应永久性停止ICI治疗,可在皮肤活检、专家会诊前考虑全身性的应用皮质类固醇激素[28].
3 胃肠道毒性
胃肠道毒性是ICI治疗中的第二大常见毒副反应,其并发症在ICI相关毒性死亡中占有较高比例,3-4级的胃肠道毒性反应是导致ICI治疗停止的最常见原因[29].据文献报道,不同检查点抑制剂的胃肠道毒性具有不同的发病特点,如抗CTLA-4单抗的胃肠道毒性发生率及严重程度明显高于抗PD-1/PD-L1单抗[30,31],胃肠道毒性可出现于抗CTLA-4单抗治疗过程中的任意时间点,甚至结束治疗后的数月[32],而抗PD-1/PD-L1单抗的胃肠道毒性中位发病时间为开始治疗后的2-4 mo[33].此外,相同药物在不同肿瘤治疗中的胃肠道毒性发病率也具有差异性,如PD-1抑制剂在黑色素瘤患者中的胃肠道毒性发生率高于非小细胞肺癌和肾细胞癌患者[13].
参考日本橙皮书“奥美拉唑肠溶片”溶出曲线测定用介质[5]以及日本厚生劳动省颁布的《仿制药生物等效性试验原则》[6]中对肠溶制剂溶出测定用介质的要求, 选择 pH 1.2、pH 5.5、pH 6.0、pH 6.8 和水介质进行溶出曲线研究。
腹泻和结肠炎是最常见的胃肠道毒性表现,其在抗CTLA-4单抗的治疗中的发生率分别为27%-54%和8%-22%[29],主要症状为腹泻、腹痛、血便、黏液便及发热等.实验室检查可显示贫血、C反应蛋白升高和低蛋白血症[32].大多数病变部位发生于乙状结肠和直肠[32],内镜下可见黏膜红斑、血管形态丧失、糜烂和溃疡.接受CTLA-4阻断剂治疗的患者的结肠组织病理学特征主要为粘膜中性粒细胞、嗜酸性粒细胞浸润,弥漫性或局灶性片状隐窝脓肿,部分病例可表现为炎症性肠病的特征,包括隐窝结构的破坏、基底浆细胞增多甚至肉芽肿.而接受PD-1/PD-L1阻断剂治疗的患者可见有固有层扩张、绒毛缩短、上皮内中性粒细胞性和淋巴细胞浸润.现有研究发现,ICI介导的结肠炎与非甾体抗炎药物的使用、炎性肠病病史、肠道菌群之间存在相关性[32,34,35].此外,部分患者还可伴有多种肠外病变,如上消化道病变(口腔溃疡、呕吐、吞咽困难)、肛门病变、胰腺炎、肝炎、内分泌紊乱等.上述实验室检查、内镜和组织病理学特征有助于ICI介导胃肠道毒性的诊断、评估及治疗.同时,腹部和盆腔的CT检查有助于对症状的分析和炎症的评估,粪便的病原学检查常用于对感染性胃肠炎的鉴别诊断.
治疗免疫相关性结肠炎应早期发现,积极地治疗,及时地升级策略以改善预后.治疗措施是根据腹泻/结肠炎的严重程度分级对待(表2),轻度(1级) 胃肠道毒性患者临床可使用洛哌丁胺或苯乙哌啶以减轻腹泻,并密切观察、及时补液.对于持续2级或更高级的胃肠道毒性患者,应停止ICI治疗,开始使用糖皮质激素.并组织胃肠道专家会诊和内镜评估,以确认诊断并评估炎症的严重程度.在激素治疗有效的患者中,中度(2级)胃肠道炎症的治疗通常可以在2-4 wk内逐渐减量,重度(3级)患者的治疗通常可以在4-8 wk内逐渐减量.对于激素治疗无效者,可加用英夫利昔单抗或维多珠单抗治疗.现有研究表明,与长期激素治疗相比,短期激素加英夫利昔单抗治疗可降低各种机会性感染的风险[36].粪便菌群移植可用于对激素、英夫利昔单抗或维多珠单抗耐药的胃肠道感染病例中[37].
4 肝脏毒性
免疫介导的肝脏毒性常发生于ICI治疗开始的8-12 wk[38],其发病率约为5%-30%,相较于PD-1/PD-L1抑制剂,抗CTLA-4单抗具有更明显的肝脏毒性.据报道,在接受CTLA-4抑制剂的患者中,肝脏毒性的发生率高达15%,而在PD-1/PD-L1的患者中,其发生率为5%-10%[39].在联合治疗(伊匹利单抗联合纳武单抗)的患者中,肝炎发生率为25%-30% (其中15%的患者表现为3级及以上的肝脏毒性)[30,40].

表1 免疫相关性皮肤毒性的分级

表2 免疫相关性胃肠道毒性的分级

表3 免疫相关性肝脏毒性的分级
免疫相关性肝脏毒性缺乏特定的临床特征,通常表现为血清转氨酶的升高,伴有或不伴有高胆红素血症,ICI介导的急性肝衰竭文献亦有报道[41].因此,定期的肝功能检查对早期发现和毒性评估具有重大意义.ICI相关性肝脏毒性的诊断具有挑战性,其重点在于其他病因的排除,主要包括药物性肝炎、急性病毒性肝炎、自身免疫性肝炎、肝转移、胆道阻塞、肝门静脉血栓.临床症状、血清学检测及相关影像学检查可予以鉴别,必要时可进行肝活检[42].
基于血清转氨酶的升高水平,对肝脏毒性患者采取分级治疗管理(表3).对于1级肝炎患者,ICI治疗可继续进行,应在治疗过程中应密切监测患者肝功能变化[5].对出现2级及以上的肝炎患者,需暂停ICI治疗,在排除其他病因后,应使用皮质类固醇治疗(建议持续4 wk以上,并逐渐减量)[43,44].当肝功能损伤改善至1级,患者可考虑恢复ICI用药.若患者出现3-4级肝功能损伤或伴有胆红素升高,应永久停止ICI治疗,升级皮质类固醇治疗的初始剂量,并组织肝病专家会诊及肝活检[5].对3 d内肝功能未见明显改善的皮质类固醇治疗无效患者,应考虑添加MMF治疗[45].由于英夫利昔单抗具有潜在的肝脏毒性,因此不推荐用于ICI介导的肝炎治疗[46,47].ATG被报道可成为皮质类固醇和MMF不耐受者的替代药物[48],常用于爆发性肝炎的治疗[49].
5 内分泌相关毒性
ICI治疗可以引起多种内分泌不良反应,总发病率约为10%[50],包括甲状腺功能障碍、垂体炎、原发性肾上腺功能不全和Ⅰ型糖尿病.其中,内分泌相关毒性以垂体炎和甲状腺功能障碍为多见,而Ⅰ型糖尿病和原发性肾上腺功能不全则相对少见[51,52].
5.1 甲状腺功能障碍 甲状腺功能障碍多见于抗PD-1/PD-L1单抗治疗和联合治疗中,其发病率分别为5%-10%和20%[11,40,53,54].甲状腺功能障碍的中位发病时间是开始治疗的第4周以后[55],在停药数年后发病的病例亦有报道[56,57].大多数患者是无症状的,通常是在血液常规检查中发现,包括甲状腺功能亢进和甲状腺功能减退.甲状腺功能减退比甲状腺功能亢进更为常见,总发病率分别为6.6%和2.9%[50].此外,与PD-L1抑制剂相比,在使用PD-1抑制剂单药治疗的患者中,甲状腺功能亢进更为多见[50].甲状腺功能亢进通常是暂时性的,多进展为甲状腺功能减退[2].在一项对45例抗PD-1单抗或联合治疗中出现甲状腺功能障碍患者的回顾性研究中发现,22%的患者最初表现为甲状腺功能减退,其余78%的患者最初表现为甲状腺功能亢进,其中80%甲亢患者发展为甲状腺功能减退[58].甲状腺功能障碍的毒性分级如表4所示,患者应定期进行甲状腺功能检查,其中,有症状的甲减患者(2级及以上),应考虑使用甲状腺激素替代治疗(老年、心脏病患者应从低剂量开始使用),必要时可组织内分泌专家会诊.对于有症状的甲亢患者(2级及以上),需使用β受体阻滞剂对症治疗,但需注意通过实验室检查、影像学检查与甲状腺炎、毒性弥漫性甲状腺肿(Graves病)作鉴别.
5.2 垂体炎 与PD-1/PD-L1抑制剂相比,垂体炎多见于使用CTLA-4抑制剂治疗的患者中[59].据报道,在CTLA-4抑制剂治疗的患者中,垂体炎多发生于男性和老年患者[60],中位发病时间在8-9 wk的治疗后[61],且呈剂量依赖性,如3 mg/kg和10 mg/kg的伊匹利单抗单药治疗中垂体炎的发病率分别为1%-4%和16%[53,62,63].而垂体炎在PD-1/PD-L1抑制剂治疗中较为少见,其中在纳武单抗和帕博利珠单抗单药治疗中,垂体炎的中位发病时间分别是在开始治疗后第4.9个月(范围为1.4-11 mo)和第3.3个月(范围为1 d至7.2 mo)[57].
垂体炎的症状表现与下丘脑-垂体-靶细胞轴的功能紊乱有关,主要包括中枢性甲状腺功能减退、低促性腺激素性功能减退和中枢性肾上腺功能不全[57],尿崩症、低泌乳素血症和生长激素水平异常亦有发生,但较为罕见[64].临床上,垂体炎患者多以头痛、疲倦为首发症状[65],可伴有一种或多种垂体激素缺乏的相关症状,少数病例可有视觉障碍(垂体增大压迫视神经).有上述临床特征的患者应进行甲状腺、肾上腺和性腺轴的检查及垂体影像学检查,以有助于诊断[4].通常,垂体的影像学异常先于实验室和临床特征出现[66],约60%以上的患者表现有垂体增大[67].垂体炎继发的肾上腺功能不全通常是永久性的,继发性甲状腺功能减退和性腺功能减退的恢复率分别在6%-64%和11%-57%之间[64].垂体炎的治疗主要是糖皮质激素(甲泼尼龙或泼尼松)的应用和缺乏激素的替代支持[2,4],但目前尚缺乏足够数据证明糖皮质激素对垂体功能的改善[14].
5.3 Ⅰ型糖尿病和原发性肾上腺功能不全 Ⅰ型糖尿病和原发性肾上腺功能不全的患者相对罕见,发病率分别为0.2%和0.7%[50].对于ICI诱导的高血糖患者,需通过C肽水平、抗谷氨酸脱羟酶抗体(anti-glutamic acid decarboxylase antibody,GABA)和胰岛细胞抗体(islet cell antibody,ICA)的检测以进行Ⅰ和Ⅱ型糖尿病的鉴别,并对是否存在糖尿病酮症酸中毒(diabetic ketoacidosis,DKA)进行评估.根据免疫相关性糖尿病的毒性分级(见表5),其治疗主要通过饮食调整和注射胰岛素来控制,由于糖皮质激素的高血糖作用,以及缺乏改善ICI相关性糖尿病的数据支持,故不适宜应用[2,4].若存在DKA,应停止免疫治疗,并住院管理,待DKA得以纠正且血糖平稳,可考虑恢复免疫治疗[67].
对考虑有肾上腺功能减退的患者,需通过检测清晨空腹促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)和血浆皮质醇水平来评估肾上腺功能[2,4],并警惕肾上腺危象的发生.对于原发性肾上腺功能不全者,需停止ICI治疗,在替代治疗前优先使用皮质类固醇避免肾上腺危象的发生.
6 肺毒性
肺炎是ICI治疗中最常见的肺部毒性[5],中位起病时间为治疗开始的第2.8个月[68],常见于PD-1/PD-L1单药治疗或联合疗法中[68],且具有致命风险,其引起的死亡事件约占PD-1/PD-L1抑制剂相关性死亡的35%[16].此外,联合治疗诱导的肺炎可表现有更高的发病率、更早的起病时间及更严重的毒性反应[69].亦有研究表明,非小细胞肺癌中ICI相关性肺炎的发病率高于其他恶性肿瘤[70].PD-1抑制剂相关性肺炎的发生率和严重程度高于PD-L1抑制剂[71].同时,潜在的肺部疾病(如间质性肺病、哮喘和慢性阻塞性肺病)、先前的胸部放疗及吸烟史可能是ICI相关性肺炎的危险因素[72,73].

表4 免疫相关性甲状腺功能障碍的毒性分级
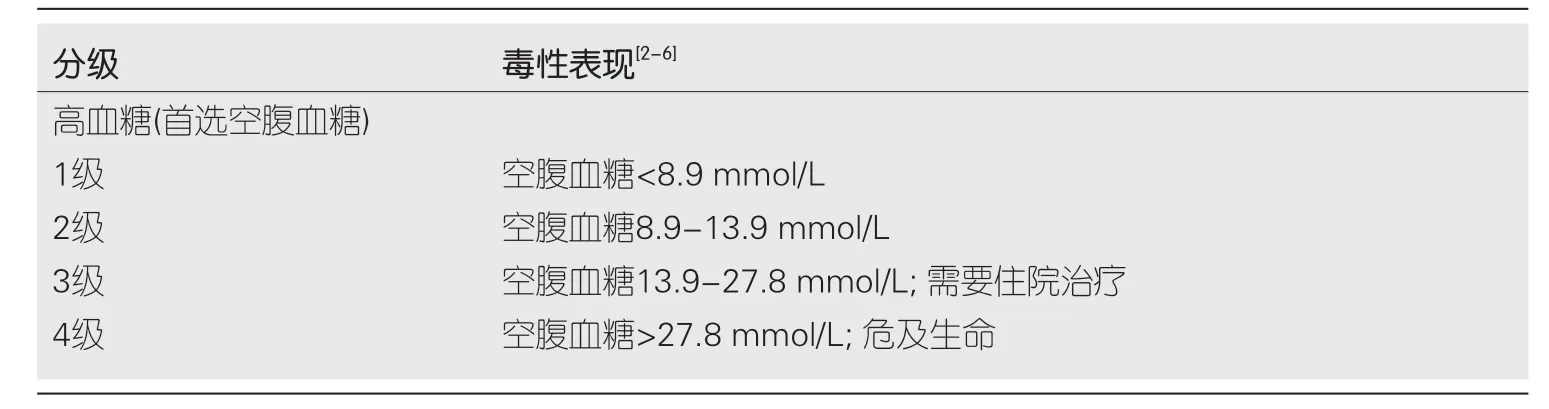
表5 免疫相关性糖尿病的毒性分级

表6 免疫相关肺毒性的分级
ICI相关性肺炎患者的临床表现和影像学结果是复杂多样的,不具有特异性.通常,患者可表现为咳嗽、气促、缺氧和胸痛等呼吸道症状.然而亦有文献报道,约33%的患者在诊断时无症状表现[68],极少数的病例病情可迅速进展为呼吸衰竭[3].影像学检查可有多种肺炎类型表现,包括隐源性机化性肺炎、非特异性间质 性肺炎、急性间质性肺炎及过敏性肺炎等[74].ICI诱导性肺炎的诊断重点在于其他病因(感染、肿瘤进展)的排除,可通过鼻拭子、痰培养、支气管镜和肺泡灌洗等予以鉴别.
对怀疑有免疫相关性肺炎的患者,应暂停ICI治疗,通过病史、临床表现、体格检查、病原学检查、胸部CT等进行严重程度评估(见表6).对于有症状或肺部病灶超过肺实质25%的患者(≥2级),应使用糖皮质激素(甲泼尼龙或泼尼松)治疗,若感染无法排除,需经验性地添用抗生素.通常,经治疗后症状会在3 d内改善,无效者应加用英夫利昔单抗、MMF以及环磷酰胺等其他免疫抑制剂[11,68],并永久停止免疫治疗.
7 结论
本文综述了常见irAEs的临床表现及管理,罕见irAEs,包括心脏毒性、神经系统毒性、肾毒性和血液毒性等,同样需要引起临床医生的重视.临床毒性管理重点在于早期发现和诊断,患者应在多学科相互协作下积极接受治疗.关于毒性管理的分级依据,各指南略有不同,需要临床医生根据自己的经验积累,对患者做出准确的评估.此外,对于需长期接受激素治疗的严重irAEs患者(3-4级),临床医生应考虑激素带来的不良反应,如机会性感染、骨质疏松及消化道出血等.当前,irAEs相关领域仍存在许多问题有待解决,如发生机制尚不清晰,评估体系尚不完善、激素使用剂量存在争议等,且irAEs的相关研究多来自于国外报道,国产ICI的相关研究多是小样本、回顾性的,并不能完全反应中国人群的毒性特征.未来,随着ICI治疗的广泛应用及相关试验的开展,人们对irAEs将会有更充分的认识,管理措施也将会更加成熟.
