外泌体及其成分在胰腺癌转移中的作用
2020-09-08刘南斌施宝民
刘南斌,许 艳,施宝民
刘南斌,许艳,施宝民, 同济大学附属同济医院普通外科 上海市 154000
0 引言
2018年全球癌症统计显示,在185个国家中胰腺癌(pancreatic cancer,PC)是导致死亡的第七大恶性肿瘤[1].PC多起源于胰腺导管上皮细胞和腺泡细胞.患者早期无特异性症状,就诊时多已发生转移,手术切除率低,预后极差.5年生存率低,约5%-10%[2].虽然研究众多,却收效甚微.
近期的许多研究表明[3],外泌体参与和调控了PC细胞的转移和侵袭性,可能成为预防PC转移的新靶点.本文将对目前的研究进展做一综述.
1 外泌体研究背景
外泌体起源于溶酶体微粒内陷形成的多囊泡体,可通过胞吐作用分泌至细胞间隙.早在1979年,Trams等[4]就首次使用“exosomes”描述源自正常细胞和肿瘤细胞质膜的微囊泡.1983年,Johnstone等[5]在探索网织红细胞向成熟红细胞转变的过程中发现了外泌体,但没有给予正式命名,直到1987年,他们在实验中分离出外泌体并给予了正式命名.
外泌体含有大量的蛋白质、核酸、脂质等生物活性物质.外泌体中的蛋白质按照功能可以分为两类:一类具体参与外泌体的形成,另一类能表达细胞类型特异.外泌体中的核酸包括多种类型的RNA,如微小RNA(microRNA,miRNA)、环状RNA、长链非编码RNA等,以及少量DNA.外泌体中的脂质大多集中在膜表面,其类型丰富包括胆固醇、神经鞘磷脂、神经酰胺,磷脂酰丝氨酸等(图1)
外泌体广泛参与到了各类肿瘤的转移当中,例如Le等[6]报道乳腺癌中乳腺癌细胞源性外泌体中miR-200可改变癌细胞的基因表达;Chen等[7]报道肝细胞癌中MHCC97H细胞分泌的外泌体可介导上皮间质细胞的转化;Umezu等[8]报道黑色素瘤细胞系的外泌体miR-135b可促进内皮血管形成等.不同来源的外泌体在PC转移过程中更是发挥了重要作用.
2 外泌体在PC转移中作用的研究进展
2.1 破坏肿瘤细胞的紧密连接,促进转移 紧密连接是相邻细胞的细胞膜共同构成的一种细胞连接复合物,紧密连接的存在有利于将两个细胞连接在一起防止大分子穿过间隙.Panc02和Panc02-H7是两株等基因但转移潜能不同的胰腺导管细胞腺癌(pancreatic ductal cell adenocarcinoma,PDAC)细胞,后者的转移潜能明显高于前者.Yu等[9]将PKH 67标记的Panc02-H7源性外泌体与Panc02细胞共培养.发现Panc02细胞可吸收该外泌体,随后他们利用细胞粘附实验证明吸收该外泌体的Panc02细胞系粘附性明显降低,说明Panc02-H7源性外泌体可破坏细胞之间的紧密连接,增加迁移.在胆管癌中也存在相似机制,郦铮铮等[10]研究表明,胆管癌细胞源性外泌体可以通过内质网应激而使得内皮细胞紧密连接蛋白ZO-1及CLDN5明显下调,导致血管内皮细胞屏障破坏,促进胆管癌细胞发生转移(表1).上述研究表明,外泌体能破坏肿瘤细胞的紧密连接,促进转移.但PC细胞源性外泌体(pancreatic cancer cell-derived exosomes,PC-EXOS)破坏肿瘤细胞间的紧密连接的机制尚不清楚,深入探索关键分子,有利于明确其转移机制,为抑制转移带来可能.
2.2 增强PC细胞的侵袭力 外泌体可以在细胞之间介导信息传递,细胞间信息传递可以促使受体细胞的侵袭能力增强,有助于肿瘤的转移.
Wang等[11]报道低氧条件下,外泌体miR-301a可以通过PTEN/PI3Kg通路介导巨噬细胞向M2型极化,促进PC细胞转移能力的提高.Masamune等[12]报道PC-EXOS能在胰腺星状细胞(pancreatic stellate cells,PSC)中激活PI3K/Akt和MAP信号通路促进肿瘤的发展和侵袭力的增强.Li等[13]对PC患者血浆中外泌体提取、分离后发现,PC-EXOS分泌的miR-222可直接调节p27,促进细胞的侵袭和增殖,还可通过抑制PPP2R2A的表达而激活AKT,从而诱导p27磷酸化和胞质p27的表达,促进细胞的生存和转移.Pessolano等[14]对体外PC模型中外泌体进行研究发现,外泌体蛋白Annexin A1可以促进PC侵袭、迁移和新生血管形成.Zhang等[15]通过体外小鼠实验证明,PC-EXOS可分泌蛋白Ling28B,并将其转移到其他PC细胞,激活Ling28B/Let-7/HMGA2/PDGFB途径将循环中的PSC聚集,最终导致远处转移能力的提高(表2).
在第一个话题的语料中,恋爱架构出现的次数非常引人注意,包含了“国家是个人”“国际关系是人际关系”“亲密的国际关系是亲密的人际关系”三个层次的隐喻。例如文中出现的约会(date)、订婚(engagement)等表达。该架构出现频率之高反应了报道对美俄关系的重视。此外与之相反的战争架构也出现了三次;对弈架构出现了两次,反应了英国媒体视角下美俄两国亲密中又包含对立的关系,也透露将美国视为重要盟国的英国的微妙心态。
关于外泌体增强PC细胞侵袭力的研究已有很多,不同细胞源性外泌体增强肿瘤细胞侵袭力的方式不尽相同,具有复杂性.可以肯定外泌体能增强PC细胞的侵袭力,但外泌体内部不同成分间是否会相互作用,从而影响外泌体对PC细胞的作用仍不清楚,需要进一步研究.

表1 破坏肿瘤细胞的紧密连接,促进转移
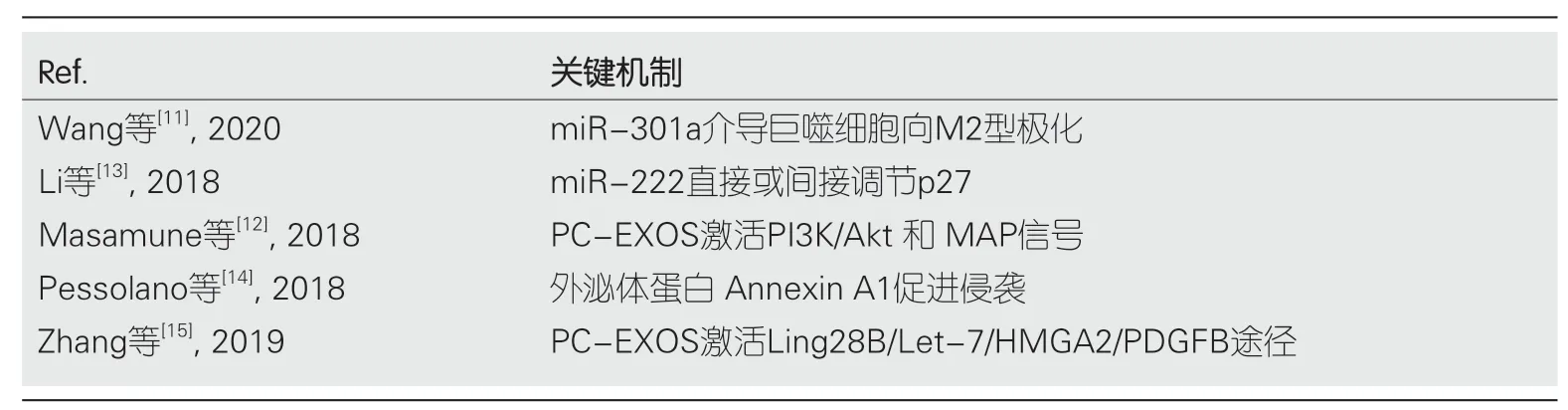
表2 增强胰腺癌细胞的侵袭力
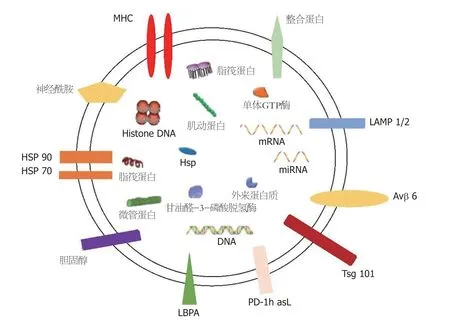
图1 外泌体的结构与成分.
2.3 促进肿瘤细胞上皮-间充质转化 上皮-间充质转化(epithelial mesenchymal transition,EMT)是指上皮细胞经历多种生化反应,转化为具有间充质表型细胞的过程.与上皮细胞相比,间充质表型的细胞的运动能力更强,具有更强的细胞迁移力、侵袭力、对抗凋亡的抵抗力[16].
Kikuta等[17]将PC细胞与PC患者的胰腺组织中分离出的PSC在体外共培养后,发现经过PSC的诱导,PC细胞逐渐具有成纤维细胞样外观和疏松的细胞连接,说明PSC可促进PC细胞的EMT.Charrier等[18]利用小鼠模型实验也证实该观点,他们发现激活后的PSC可释放富含miR-21的外泌体,作用于PC细胞,促进EMT.此外PCEXOS中包含了很多参与调控上皮间质转化的调控因子,如 Annexin A2等.Wu等[19]研究在PDAC中,旁分泌IL-6信号的Stat3/Nrf2途径能促进PSC介导EMT相关基因表达,增强上皮间充质转化(表3).外泌体促进肿瘤细胞发生上皮间充质转化,促进其发生转移的机制较为明确.但是否所有细胞的来源的外泌体均可以促进PC细胞发生上皮间充质转化,仍然需要进一步研究.
2.4 促进转移前生态位的形成 “转移前生态位”一词是用来描述在肿瘤细胞发生转移前,在预转移器官形成的有利于肿瘤细胞转移的微环境.PSC、成纤维细胞、肌成纤维细胞、免疫细胞、血管内皮细胞和细胞外间质都在转移前生态位的构成中发挥作用[20].

表3 促进肿瘤细胞上皮-间充质转化
PC-EXOS可对拟转移器官微环境中的间质细胞进行改造并刺激血管再生,促进适宜肿瘤细胞远处定植的转移前生态位的形成.Nazarenko等[21]将富含Tspan8蛋白的PC-EXOS注入PC小鼠模型,分析小鼠PC细胞增殖、转移行为后发现,Tspan8蛋白可通过参与内皮细胞活化通路,刺激原发部位的血管生成,进而促进原发部位肿瘤细胞的转移.Costa-Silva等[22]将PC细胞注射入实验鼠脾内,通过观察其肝脏的变化,证明肝库普弗细胞可选择性吸收PC细胞分泌的外泌体,诱导自身释放转化生长因子β,该因子促进肝星状细胞产生纤维连接蛋白,有助于产生适合PC转移的生态位.Rana等[23]研究指出,PCEXOS中miRNA和四天半胱氨酸也对转移前生态位的形成有调节作用.
此外,其他肿瘤细胞来源的外泌体在转移前生态位的形成中也有类似作用.Chowdhury等[24]将前列腺癌细胞来源的外泌体与间充质干细胞共培养后发现,后者可分化为α-SMA阳性的肌成纤维细胞,该细胞既可促进血管生成又可增强肿瘤细胞侵袭能力,有助于转移前生态位的形成(表4).
上述研究表明,外泌体可发挥信使作用,在远隔器官形成适合肿瘤生长的“生态位”,促进其发生转移.但其机制仍然不是很明确,不同细胞来源的外泌体是否都促进转移前“生态位”的形成,仍然需要深度挖掘以明确.
2.5 影响肿瘤细胞的能量代谢 肿瘤细胞在许多方面不同于正常细胞,细胞代谢改变是肿瘤的特征之一.Zhao等[25]检测PC组织中癌症相关成纤维细胞源性外泌体(cancer-associated fibroblast-derived exosomes,CAFEXOS)内容物后发现,其含有氨基酸、脂类和三羧酸循环中间体在内的完整的代谢物.通过13C标记实验证实CAF-EXOS为缺乏营养的PC细胞提供能量的多种机制,包括破坏正常细胞的线粒体氧化代谢通路,为PC细胞提供现有代谢物质等.Sousa等[26]发现,PDAC在缺乏能量物质时,可刺激肿瘤微环境中PSC发生自噬效应并分泌丙氨酸,维持肿瘤代谢水平.
此外,单个肿瘤细胞产生的外泌体可给其他肿瘤细胞供能.Yan等[27]利用细胞实验证明乳腺癌细胞胞外囊泡的miR-105,能在肿瘤微环境中传递至肿瘤相关成纤维细胞(tumor-associated fibroblast,CAF),诱导 CAF 根据代谢水平的不同而表现出不同的代谢状态.Fong等[28]利用乳腺癌小鼠模型研究发现,乳腺癌细胞所分泌的富含miR-122的外泌体可通过下调丙酮酸激酶活性而抑制非乳腺癌细胞对葡萄糖的摄取(表5).
外泌体影响肿瘤细胞的能量代谢研究成果较少,现有的研究对其具体作用途径不甚明了.正常细胞发生癌变以后,其能量代谢本身也会发生变化,外泌体及其成分如何参与到这一过程,发挥了什么样的作用,仍然需要进一步阐明.
2.6 抑制宿主免疫反应导致免疫逃逸 Zhou等[29]研究发现,PC-EXOS可释放miR-203下调树突状细胞中TLR4受体的表达,并抑制TNF-a、IL-12等因子的分泌,从而干扰正常的免疫应答.Javeed等[30]将PC-EXOS导入CD14单核细胞后发现,PC-EXOS可通过调节STAT3信号通路,将正常单核细胞转化为具有免疫抑制作用的单核细胞.Whiteside等[31]研究发现,包括PC在内的大多数肿瘤源性外泌体都可以通过调控T细胞和NK细胞的活性,活化TCR信号通路而抑制免疫反应.巨噬细胞有M1和M2两种亚型,M1型促进炎症反应,M2型抑制炎症反应;Hu等[32]研究发现,在PC组织侵袭边界巨噬细胞多为M2型,有利于减弱免疫系统对肿瘤细胞的吞噬作用(表6).
外泌体对免疫功能的调控具有复杂性.根据外泌体来源、内部成分、靶向细胞的不同,可发挥完全相反的作用.外泌体内部成分之间、外泌体与PC细胞之间均存在复杂的相互作用,需要深入研究,以明确其机制.
外泌体及其某些结构或者成分,可能通过以下通路对PC的转移和侵袭能力进行调控.据推测,不同通路之间会有所交叉,不会孤立性发挥作用,各种通路之间是不是是联合或者序贯发挥作用,有待于进一步研究证实(图2).
3 结论
外泌体自发现以来备受关注,已证实在PC转移等方面
发挥重要作用.但还有很多问题亟待解决:(1)对不同细胞外泌体分泌机制及其调控因素尚不甚明了;(2)外泌体内部发挥调控作用的具体结构或者成分亦有待于进一步研究;(3)多种机制或者途径中间,到底是联合、还是序贯发挥作用,仍需要进一步证实;(4)目前研究仅局限于细胞或动物模型中,距离临床应用研究还有待时日.另外,从技术角度看,尽管已经趋向成熟,但外泌体制备和提纯等相关实验技术还不能满足更广泛、更深入的研究.相信不久的将来,外泌体及结构成分可能会对PC的治疗研究揭开新的篇章.

表4 促进转移前生态位的形成

表6 抑制宿主免疫反应导致免疫逃逸
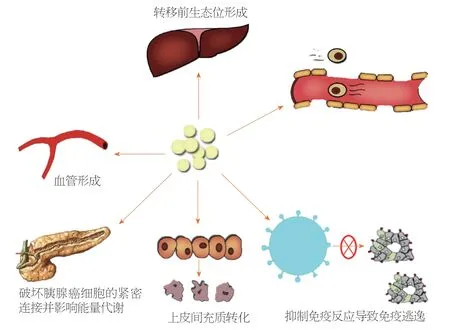
图2 外泌体在胰腺癌转移中作用途径示意图.
