羽扇豆醇联合miR-145-5p对前列腺癌细胞增殖与凋亡的影响*
2020-09-07张小鹰何金花郭明星梁春燕
张小鹰,何金花,王 浩,郭明星,梁春燕
(广州市番禺区中心医院 1病理科,2检验科,广东广州511400)
前列腺癌是男性泌尿生殖系统最常见的恶性肿瘤。羽扇豆醇(lupeol)作为一类三萜化合物,广泛存在于许多中草药及食源性植物中,具有许多生物活性,包括抗炎、抗肿瘤、抗病毒等作用,在多种细胞株及体内实验中均显示较强的抗肿瘤活性。微小RNA(microRNA,miRNA,miR)是一类长度约18~24个核苷酸的内源性非编码单链RNA 分子,与Argonaute(Ago)蛋白家族的成员直接相互作用后形成效应复合物,介导靶向目标的信使RNA(message RNA,mRNA)降解或翻译抑制[1]。研究表明,miR-145-5p在胰腺癌、喉鳞癌、宫颈癌、前列腺癌等肿瘤中发挥抑癌作用。本实验旨在观察羽扇豆醇联合miR-145-5p 对前列腺癌细胞增殖和迁移的影响,并探讨其分子机制。
材料和方法
1 细胞与试剂
人前列腺癌细胞株LNCaP 由暨南大学医学院中心实验室惠赠。DMEM 培养基、胎牛血清和0.25%胰蛋白酶(trypsin)-EDTA(Invitrogen);RPMI-1640培养基(HyClone);青霉素、链霉素和TUNEL 染色液(上海碧云天生物技术有限公司);Lipofectamine 2000(Thermo Fisher Scientific);PBS、MTT 溶液和结晶紫染色液(Solarbio);DAPI 染色液(HARVEY);annexin V-FITC 细胞凋亡检测试剂盒和细胞周期检测试剂盒(江苏凯基生物技术股份有限公司);Tran‑swell细胞培养板和Matrigel(BD);专用爬片玻片(上海卧宏生物科技有限公司);多聚甲醛(甘肃皓天化学科技有限公司)。
2 方法
2.1 细胞培养和转染 LNCaP 细胞用含10%小牛血清、青霉素(1×105U/L)和链霉素(100 mg/L)的RPMI-1640 培养基进行培养,放置于37℃、5%CO2恒温饱和湿度培养箱中,待细胞密度>70%时,倾去培养液,用PBS 洗涤细胞。加入0.25%胰蛋白酶进行消化,37℃放置1~2 min 后再加入2 mL 含15%胎牛血清的RPMI-1640 培养液,吹打使细胞形成单细胞悬液。按每孔5×105细胞的浓度接种6 孔板,混匀后正常静置培养 24 h。将 4 µg 的 miRNA 加至 250 µL的 OPTI-MEM 培 基 中 ,混 匀 。 将 10 µL 的 Lipo‑fectamine 2000 加至另外 250 µL 的 OPTI-MEM 中,混匀,室温静置5 min。将miRNA 悬液和Lipofectamine 2000 悬液混合,总体积 500 µL,混匀,室温静置 20 min,将miRNA 和Lipofectamine 2000混合液加至6孔板的孔内,混匀,置于培养箱中培养。转染6 h后,细胞换液,每孔2 mL 培基。转染24、48和72 h后,收集细胞检测表达。实验分为7 组:(1)空白对照(cell)组:除培养基之外不加任何试剂;(2)阴性对照(negative control,NC)组 :非 特 异 性 miRNA+Lipo‑fectamine 2000 +转染液;(3)溶剂(solvent)组:加入DMSO;(4)hsa-miR-145-5p 组;(5)lupeol 组:10µmol/L lupeol 处理;(6)hsa-miR-145-5p+lupeol 组;(7)NC+lupeol组。
2.2 MTT 法检测细胞活力 调节LNCaP 细胞密度至 1×107/L,接种于 96 孔培养板,每组设 5 个复孔。分别每组加药后,放置于37℃、5%CO2恒温饱和湿度培养箱中,分别培养 24、48 和 72 h 后,每孔加 MTT 溶液,继续孵育4 h,使用酶联免疫检测仪在490 nm 波长处测每孔的吸光度(A)。计算各组活力抑制率(%)=(1-A实验组/A空白对照组)×100%。
2.3 流式细胞术检测细胞周期分布 调节LNCaP细胞密度至2×109/L,接种于12孔培养板,每孔1 mL,每组设3 个复孔。分别每组加药后,48 h 后,消化收集细胞,加入70%的乙醇固定,4℃孵育2 h,PBS 洗涤细胞1 次,加入1 mL PI 染色液,4℃避光30 min。300 目尼龙网过滤后上流式细胞仪分析细胞DNA 含量,每个样本随机分析12 000个细胞,得各组细胞亚二倍体率和细胞生长周期比例,FACSort CellQuest软件(BD)分析处理结果。
2.4 流式细胞术检测细胞凋亡 LNCaP 细胞,调节密度至2×106/L,接种于12孔培养板,每孔1 mL,每组设3 个复孔。分别每组加药后,48 h 后,消化收集细胞,PBS 洗涤 3 次,吸尽上清,加入 200 µL 试剂盒提供的结合缓冲液,重悬细胞后,分别加入10 µL an‑nexin V-FITC 和 5 µL PI,混匀,4℃避光 30 min,再加入 300 µL 结合缓冲液,上机检测 annexin V-FITC 阳性和PI 阴性的细胞群(即LR 细胞群)为早期凋亡细胞群。
2.5 TUNEL 实验 将专用爬片置于浓硫酸中浸泡过夜,用三蒸水冲洗,高压灭菌放入6孔板中,48 h后取出玻片,4%多聚甲醛固定10 min,PBS 漂洗5 遍,加入含0.1% Triton X-100 的PBS,冰浴孵育2 min。加入 50 µL TUNEL 检测液,37℃避光孵育 60 min。在荧光显微镜下观察荧光强度。
2.6 细胞迁移实验 收集处理组细胞,计数1×105个细胞,用100µL无血清培养基重悬,加入Transwell细胞培养板的小室上室,在下室加入600µL 完全培养基。在37℃、5% CO2孵育24 h 后,取出小室,用棉签擦去上室的细胞,4%多聚甲醛固定20 min,PBS洗涤1次,结晶紫染色10 min,PBS洗涤1次。用结晶紫染色的上室下表面细胞,可用33%醋酸洗脱,细胞拍照计数统计。
2.7 细胞侵袭实验 4℃溶解Matrigel 过夜,用预冷的无血清培养基以1∶3 的体积比稀释Matrigel,取40µL 加入预冷的 Transwell 小室中,37℃孵育 2 h 使Matrigel 凝固。吸走小室中多余的液体,并在上室、下室分别加入100µL 和600µL 无血清培养基,37℃平衡过夜。处理过的细胞计数1×105个细胞,用100µL 无血清 DMEM 培养基重悬,加入 Transwell 小室上室,在下室加入600 µL 完全培养基。在37℃、5%CO2孵育24 和48 h 后,取出小室,用棉签擦去上室的细胞,4%多聚甲醛固定15 min,PBS 洗涤1 次,结晶紫染色10 min,PBS洗涤1次,细胞拍照计数统计。
2.8 细胞划痕愈合实验 在孔中加入约5×105个细胞,24 h 后用枪头垂直于6 孔板长面划痕,用PBS 洗去划下的细胞,加入无血清培养基,放入37℃、5%CO2培养箱,培养48 h拍照。
2.9 集落形成实验 消化收集各组的细胞,用培养基重悬细胞,吹打成单细胞悬液,细胞计数,每孔接种密度是每孔500 个。接种完毕,各孔补加培养基至300 µL。水平位左右前后晃动培养板,尽使孔内细胞分布均匀。培养7 d 后,吸去各孔培养基,PBS漂洗2 次,各孔加200 µL 结晶紫染色液应充分覆盖孔底,20 min 后将孔板置于自来水下冲洗,晾干计数。
3 统计学处理
采用SPSS 17.0 统计软件进行统计分析。实验重复3次,数据均用均数±标准差(mean±SD)表示,采用完全随机设计的单因素方差分析(one-way ANO‑VA)分析组间差异的显著性,SNK 法进行事后多重比较,以P<0.05为差异有统计学意义。
结 果
1 细胞活力抑制率检测
细胞成功转染后,用MTT 法检测各组细胞24、48 和 72 h 的细胞活力,结果显示,solvent 组与 NC 组相比差异无统计学显著性(P>0.05),hsa-miR-145-5p 组、lupeol、hsa-miR-145-5p+lupeol 和 NC+lupeol 组出现了明显的活力抑制作用,与NC 组相比差异均有统计学意义(P<0.05),联合用药(hsa-miR-145-5p+lupeol)组与单独用药(hsa-miR-145-5p、lupeol 和NC+lupeol)组相比差异有统计学意义(P<0.05),提示联合用药比单独用药出现更有效的活力抑制作用,见图1。

Figure 1.The viability-inhibitory effect of hsa-miR-145-5p and lupeol on LNCaP cells for 24,48 and 72 h.The cell viability was measured by CCK-8 assay.Mean±SD. n=3.*P<0.05 vs NC group;#P<0.05 vs hsa-miR-145-5p+lupeol group.图1 hsa-miR-145-5p和lupeol作用于LNCaP细胞24、48和72 h后细胞活力抑制率的变化
2 PI单染流式细胞术检测细胞周期的分布
NC组和solvent组的细胞周期比例与cell组细胞相似,而实验组(hsa-miR-145-5p、lupeol、hsa-miR-145-5p+lupeol 和 NC+lupeol 组)的 G0/G1期比例明显上升,出现明显G0/G1期阻滞,S 期和G2/M 期细胞减少,提示hsa-miR-145-5p 和lupeol 可能延缓了LNCaP细胞由G1期向S期的过渡,见图2。
3 Annexin V/PI 双染流式细胞术检测早期凋亡细胞
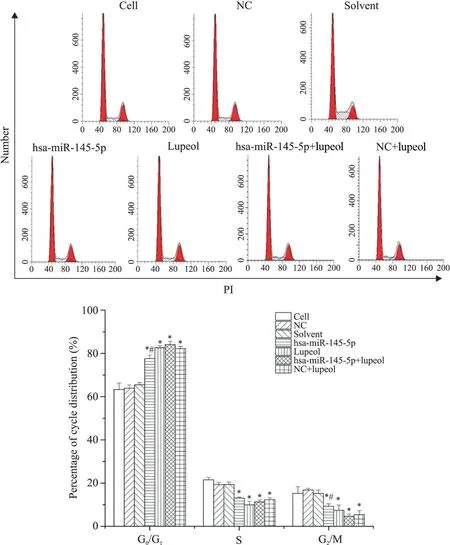
Figure 2.The cell cycle distribution of LNCaP cells treated with hsa-miR-145-5p and lupeol for 48 h was determined with propidiuio‑dide(PI)staining,and the percentage of hypodiploid cells was detected by flow cytometry.Mean±SD. n=3.*P<0.05 vs cell group;#P<0.05 vs hsa-miR-145-5p+lupeol group.图2 hsa-miR-145-5p和lupeol对LNCaP细胞周期分布的影响
NC 组和solvent 组早期凋亡率分别为4.1%和4.3%,与cell组相比差异无统计学显著性(P>0.05);lupeol、hsa-miR-145-5p+lupeol 和 NC+lupeol 组出现了明显的早期凋亡细胞群,与cell组相比差异有统计学意义(P<0.05),联合用药与单独用药相比,联合用药优于单独用药,见图3。这一结果提示lupeol 可抑制LNCaP 细胞活力,促进其凋亡,联合使用hsa-miR-145-5p和lupeol能更有效地抑制细胞活力。
4 TUNEL实验检测凋亡细胞
LNCaP 细胞核呈蓝色荧光,凋亡细胞核呈绿色荧光,两者重叠后正常细胞核呈蓝色荧光,凋亡细胞核呈深绿色荧光。与cell 组比较,lupeol、hsa-miR-145-5p+lupeol 和NC+lupeol 组出现明显的凋亡细胞群,见图4。
5 Transwell细胞迁移和侵袭实验的结果
与cell组比较,实验组细胞的迁移和侵袭数目明显降低(P<0.05),可见hsa-miR-145-5p 和lupeol 可抑制LNCaP 细胞的迁移和侵袭能力;与单独用药相比,联合用药可显著降低LNCaP 细胞的迁移和侵袭能力(P<0.05),见图5。

Figure 3.Early apoptosis of LNCaP cells treated with hsa-miR-145-5p and lupeol was detected by flow cytometry with annexin VFITC and PI double staining.Mean±SD. n=3.*P<0.05 vs cell group;#P<0.05 vs hsa-miR-145-5p+lupeol group.图3 hsa-miR-145-5p和lupeol对LNCaP早期细胞凋亡的影响
6 划痕愈合实验检测细胞的迁移能力
实验组和细胞对照组划线后在镜下视野中可见一条细长等宽的无细胞划痕区,48 h 后cell组、NC 组和solvent组细胞运动迁移基本上覆盖了大部分划痕区,而实验组的划痕区依然明显存在;NC 组和sol‑vent 组的细胞迁移率与cell 组相比较差异无统计学显著性(P>0.05),实验组的细胞迁移率与cell 组相比差异有统计学意义(P<0.05),联合用药(hsa-miR-145-5p+lupeol)组 与 单 独 用 药(hsa-miR-145-5p、lupeol 和NC+lupeol)组相比差异有统计学意义(P<0.05),见图 6。这表明 hsa-miR-145-5p 和 lupeol 能明显抑制LNCaP 细胞的迁移,联合用药能更好得抑制细胞的迁移。
7 细胞集落形成实验结果
与cell 组相比较,NC 组和solvent 组未见明显差异,而实验组的集落数量明显减少(P<0.05),联合使用 hsa-miR-145-5p 和 lupeol 对 LNCaP 细胞产生明显的集落形成抑制作用,抑制率高达79.77%,见图7。

Figure 4.Apoptosis-inducing effect of hsa-miR-145-5p and lupeol on LNCaP cells detected by TUNEL experiment(×100).Normal cell nuclei show blue fluorescence,apoptotic cell nuclei show green fluorescence.图4 通过TUNEL实验观察hsa-miR-145-5p和lupeol对LNCaP细胞凋亡的影响
讨 论
前列腺癌已成为男性最常见的肿瘤,占全球肿瘤发病第5 位。中国是前列腺癌发病及死亡较低的国家之一,但在我国随着老龄化人口的增多,前列腺癌的发病率在近年来呈现持续快速增长趋势。研究发现miRNA 与前列腺的发生和发展有潜在的联系。有学者[2]发现 hsa-miR-145-5p 在前列腺组织中呈低表达,而在正常前列腺组织中呈高表达。因此,通过过表达hsa-miR-145-5p 在LNCaP 细胞中选择性改变其表达水平。本实验通过MTT法检测LNCaP细胞的活力,流式细胞术检测细胞早期凋亡,并通过Tran‑swell 法检测LNCaP 细胞的迁移和侵袭能力,实验结果显示,细胞对照组、非特异性对照组和溶剂组未出现有效的细胞活力抑制、迁移抑制和侵袭抑制,而hsa-miR-145-5p组出现显著抑制肿瘤细胞活力、迁移和侵袭,并诱导体外早期凋亡,提示hsa-miR-145-5p对LNCaP 细胞抑制作用具有特异性。流式细胞术分析细胞周期发现,hsa-miR-145-5p 转染LNCaP 细胞后,G1期细胞数明显增多,S期细胞数减少,G2期细胞明显减少,提示hsa-miR-145-5p 可能延缓了前列腺癌LNCaP 细胞由G1期向S 期的过渡。有研究采用TargetScan、miRanda、PicTar[3]软件预测 hsa-miR-145-5p 的靶基因,发现了6 个潜在调控基因IRS1、OCT4、SOX2、KLF4、MYC和RTKN[4]。KEGG pathway 分析显示靶基因显著富集于p53 信号通路,ErbB 信号通路和MAPK 信号通路,慢性骨髓白血病,膀胱癌,胶质瘤,前列腺癌和胰腺癌等,进一步证实了hsa-miR-145-5p 与肿瘤的相关性,推测其可能通过调节多种肿瘤相关基因,参与肿瘤的发生发展。hsa-miR-145-5p[5]的靶基因包括一些重要的肿瘤相关基因,主要有EGFR、TP53、SMAD4、KIT、JAK3、FBXW、GNAQ、ATM等,这些基因在诸多研究中证实与肿瘤的发生有密切关系,比如EGFR[6]是一种重要的跨膜受体,具有酪氨酸激酶活性,被激活后参与细胞增殖、迁移、凋亡,它与肿瘤的形成和恶化密切相关,尤其参与了非小细胞肺癌的形成。TP53[7]基因是重要的抑癌基因,TP53基因的突变导致很多肿瘤的发生,比如卵巢高级别浆液性癌、乳腺癌、尿路上皮癌等。高伟[8]通过 RT-qPCR 检测 miR-145-5p 在喉鳞癌的表达水平,发现miR-145-5p在喉鳞癌中显著下调,扮演抑癌基因角色,而其靶基因FSCN1扮演癌基因角色。明确了miR-145-5p及靶基因FSCN1调控紊乱是喉癌中的重要分子事件。徐驰[9]提示miRNA-145 可以通过调控Klf4 和Oct4 来抑制A549 肺腺癌细胞的增殖、侵袭、转移等能力。针对miRNA-145 调节靶基因Klf4和Oct4的信号通路,设计阻断该通路信号传导的肺癌基因治疗和药物治疗策略,有可能为肺癌靶向治疗提供新靶点。

Figure 5.The effects of hsa-miR-145-5p and lupeol on the migration(A)and invasion(B)abilities of LNCaP cells(crystal violet staining,×100).Mean±SD. n=3.*P<0.05 vs cell group;#P<0.05 vs hsa-miR-145-5p+lupeol group.图5 hsa-miR-145-5p和lupeol对LNCaP细胞迁移与侵袭的影响
狼毒大戟[10]作为中药已广泛应用于临床,其中有效成分lupeol 具有很好的抗肿瘤活性。既往研究表明lupeol 已被证实能够抑制包括皮肤癌和胰腺癌细胞的增殖及侵袭转移,其作用机制主要包括诱导肿瘤细胞凋亡、抑制血管生成及负调控促癌信号通路,如Wnt和PI3K/AKT 等信号通路,并指出lupeol抑制蛋白激酶与色氨酸蛋白酶的作用,抑制拓扑异构酶Ⅱ活性,诱导肿瘤细胞凋亡,但其对前列腺癌的作用未见报道。因此本研究通过细胞增殖、迁移等方法观察lupeol 对人前列腺癌LNCaP 细胞侵袭转移能力的影响,实验结果表明,lupeol 对前列腺癌LNCaP细胞有明显抑制增殖和诱导早期凋亡的作用。
近年来,中药的活性成分对肿瘤相关miRNA 的调节研究取得一定的进展[11]。比如羽扇豆醇[12]对人乳腺癌MCF-7 细胞的增殖具有明显的抑制作用,其机制可能与促进MAPKs 信号通路相关调控蛋白的磷酸化有关。姜黄素[13]通过上调miR-22 来抑制miRNA-22 靶向基因SP1和ESR1的表达。藤黄酸[14]通过增强胃癌中miR-590-5p表达水平进而抑制胃癌侵袭、转移,miR-590-5p 通过调控 TGF-β2 以及 Akt/mTOR 信号通过从而抑制胃癌细胞上皮-间质转移过程。黄芩素[15]可有效抑制胃癌MGC-803细胞的增殖和迁移,其机制与黄芩素调控p12-LOX、VEGF、p-ez‑rin 及上皮-间充质转化相关蛋白的表达变化有关。而本实验中lupeol 对前列腺癌LNCaP 细胞相关的miRNA 的表达,以及相关miRNA 调节的靶向基因需要进一步探索。

Figure 6.The effect of hsa-miR-145-5p and lupeol on the migration ability of LNCaP cells(wound healing assay,×50).Mean±SD.n=3.*P<0.05 vs cell group;#P<0.05 vs hsa-miR-145-5p+lupeol group.图6 hsa-miR-145-5p和lupeol对LNCaP细胞迁移能力的影响
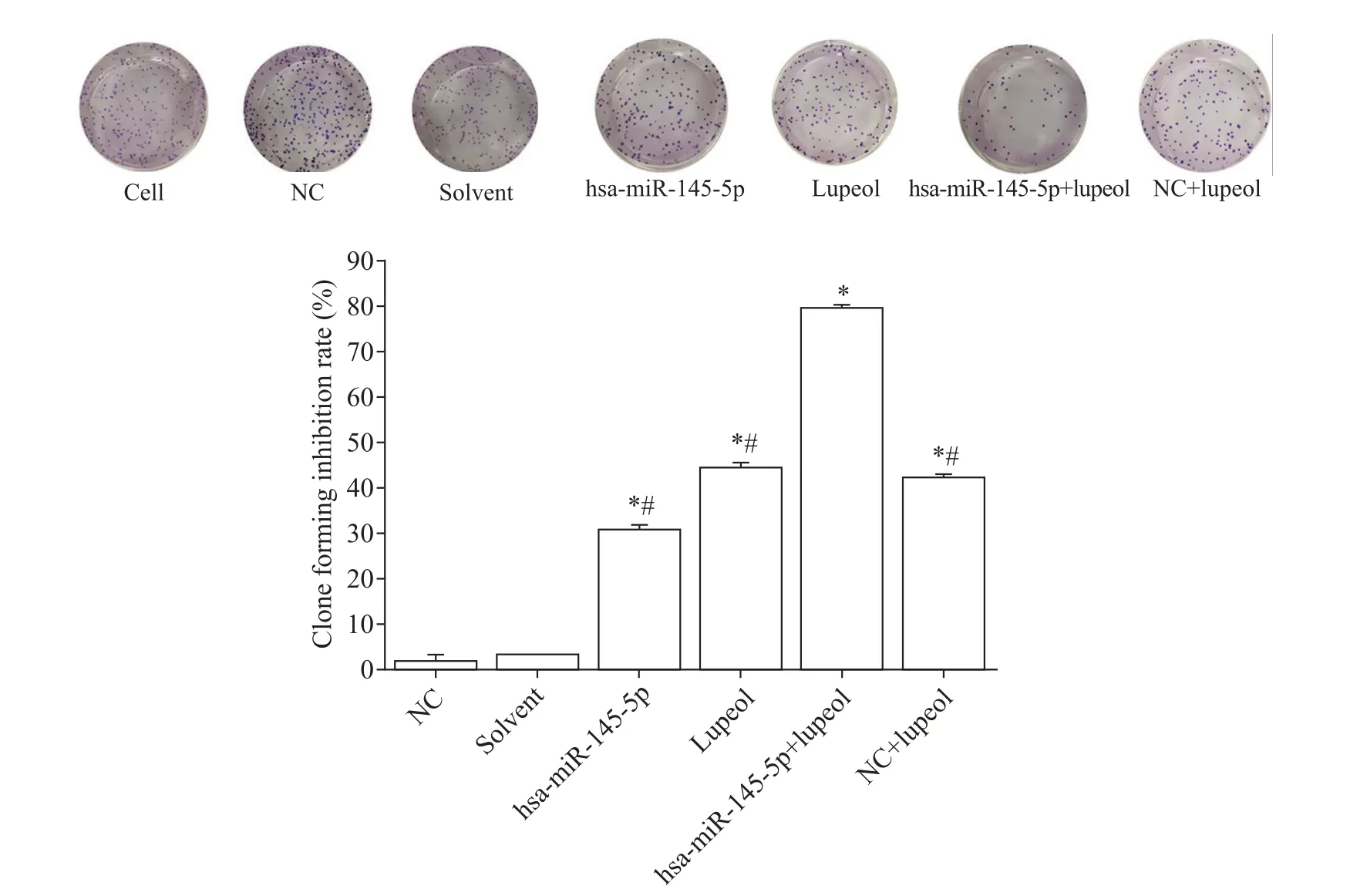
Figure 7.The effect of hsa-miR-145-5p and lupeol on the colony formation of LNCaP cells. n=3.*P<0.05 vs cell group;#P<0.05 vs hsa-miR-145-5p+lupeol group.图7 hsa-miR-145-5p和lupeol对LNCaP细胞集落形成的影响
前期的体外实验结果显示,中药联合非编码RNA 运用于抗肿瘤治疗取得了一定的效果。He等[16]将 miR-203 联合砒霜转染至白血病 K562 细胞,K562细胞出现了明显的增殖抑制,提高了K562细胞对砒霜的敏感性,为白血病治疗提供了新的依据。孙文洪等[17]将hsa-miR-204 联合中药苦参碱能有效抑制MOLT-4 细胞的增殖,并诱导细胞凋亡,苦参碱能增强MOLT-4 对hsa-miR-204 的敏感性。实验研究表明,中药联合非编码RNA 可抑制肿瘤细胞的增殖,促进凋亡,增强肿瘤细胞对非编码RNA 的敏感性。本实验联合使用lupeol 和hsa-miR-145-5p 作用于LNCaP 细胞,证实联合使用lupeol 和hsa-miR-145-5p 能更有效地抑制LNCaP 细胞增殖,且lupeol 可增强hsa-miR-145-5p 对LNCaP 细胞的抑增殖和促凋亡作用。而lupeol 和hsa-miR-145-5p 是否存在共同的信号通路或靶向基因需待进一步研究。
