NKT细胞通过下调PDGFRβ抑制Ang II诱导的小鼠血管平滑肌细胞表型转换*
2020-09-07侯翠柳王筱筱陈立瑞王红霞
肖 雪,侯翠柳,王筱筱,陈立瑞,杨 慧,田 翠,王红霞△
(首都医科大学基础医学院 1生理与病理生理学系,2病理学系,北京100069)
高血压是心血管疾病重要的危险因素之一,其患病率逐年升高[1]。高血压病的显著病理特征之一为血管重塑,其中血管平滑肌细胞(vascular smooth muscle cells,VSMCs)的表型转换在血管重塑中起着重要的作用[2]。已有动物实验证实,VSMCs 在血管紧张素II(angiotensin II,Ang II)等因素的作用下可发生表型转换,表现为收缩型VSMCs 标志蛋白[如α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)]表达减少,而分泌型VSMCs 标志蛋白[如骨桥蛋白(osteopontin,OPN)、细胞外基质和炎症因子]表达增加,进而引起血管重塑[3-4],但引起表型转换的机制尚不完全清楚。有研究显示,血小板源性生长因子(platelet-derived growth factor,PDGF)可抑制VSMCs收缩型标志物的表达,使其由收缩型转换为分泌型[5],在血管重塑的发生中具有重要的调节作用。
CD1d 依赖的自然杀伤T 细胞(natural killer T cells,NKT 细胞)是一种新型的T 细胞亚群。不同于传统的T 细胞,NKT 细胞只识别由细胞膜蛋白CD1d提呈的糖脂类抗原,CD1d基因的敲除则导致NKT 细胞无法激活[6]。α-半乳糖神经酰胺(α-galactosylce‑ramide,α-GC)为NKT 细胞最经典及活性最强的外源性配基,它可与CD1d 结合而形成稳定的CD1d-糖脂共价结合物,从而激活 NKT 细胞[7]。NKT 细胞被激活后可分泌大量促炎细胞因子[如干扰素γ(inter‑feron-γ,IFN-γ)、白细胞介素2(interleukin-2,IL-2)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等]及抗炎细胞因子(如IL-4、IL-5、IL-10 等)来调节其它免疫细胞(如树突状细胞、T 细胞及B 细胞)的激活,因此NKT 细胞被认为是联系先天和获得性免疫的“桥梁”[6]。有研究证实,NKT 细胞参与多种心血管疾病的发生,如其激活可减轻心肌缺血/再灌注损伤[8]、梗死后心肌重塑及心衰等[9]。我们前期研究的结果显示,NKT 细胞失活可加重高血压引起的心脏损伤及心肌重塑[10],还可加重Ang II 灌注引起的血压升高及血管损伤,但其是否影响VSMCs表型转换,目前尚不清楚。
本研究在CD1d基因敲除(CD1dgene knockout,CD1d-KO)小鼠及给予 α-GC 的野生型(wild-type,WT)小鼠上,给予Ang II 灌注,观察NKT 细胞失活及激活对血压、血管重塑及主动脉组织平滑肌细胞表型转换的影响,并检测PDGFβ 表达的变化,探讨其在血管重塑中的作用及机制。
材料和方法
1 实验动物
选取 6~8 周 SPF 级 C57BL/6J 雄性 WT 小鼠,体重20~25 g,购买于北京维通利华公司。CD1d-KO 小鼠购自Jackson Laboratory。所有实验动物均于首都医科大学SPF 级实验动物房饲养和繁殖。所有研究工作均遵守美国国立卫生研究院(National Institutes of Health,NIH)制定的《实验动物管理及使用指南》,并经首都医科大学实验动物管理委员会批准。
2 主要试剂
Ang II(A9525)和三溴乙醇(T48402)均购于Sig‑ma;RIPA 裂解液(R0010)购于索莱宝公司;α-GC(KRN7000)购于Funakoshi;PVDF 膜(ISEQ00010)购自 Immobilon;抗 α-SMA 抗体(sc-53142)购于 Santa Cruz 生物公司;抗 OPN 抗体(22952-1-IP)购于 Pro‑teintech;抗PDGFRβ 抗体(ET1605-20)购于杭州华安生物技术有限公司;鼠源(7076P2)及兔源(7074P2)II抗购于Cell Signaling Technology。
3 主要方法
3.1 实验分组 (1)NKT 细胞失活实验:将WT 小鼠及CD1d-KO小鼠随机分为4组(每组5~8只),分别为对照组(WT+saline 组和CD1d-KO+saline 组)及实验组(WT+Ang II 组和CD1d-KO+Ang II 组)。对照组小鼠给予生理盐水,实验组给予490 ng·kg-1·min-1剂量的Ang II,缓释泵持续灌注 14 d。(2)NKT 细胞激活实验:将WT小鼠随机分为4组(每组5~8只),分别为对照组(WT+saline 组和WT+α-GC 组)及实验组(WT+Ang II组和WT+Ang II+α-GC组)。
3.2 模型制备 本实验对C57BL/6J 小鼠灌注Ang II(490 ng·kg-1·min-1)引发高血压反应,从而制备小鼠高血压模型[11],使用Alzet缓释泵灌注14 d,间断监测血压,血压≥140 mmHg 即为模型制备成功。小鼠称重,计算所需Ang II 剂量,泵速0.25 µg/h,每只泵体积100 µL,于超净台下灌泵,37℃孵育4~6 h 或过夜。小鼠用3%的三溴乙醇溶液腹腔麻醉,常规消毒实验组小鼠耳后皮肤,剪开约1 cm长的切口,将泵埋入浅筋膜下层,泵开口朝向小鼠尾部。缝合皮肤,待小鼠生命体征平稳后送回鼠房饲养14 d,间断尾套法监测小鼠血压。从埋泵前一天开始,以100µg/kg的剂量隔天腹腔注射α-GC。
3.3 血管取材 将小鼠麻醉并固定于操作板上,打开胸腔后用肝素生理盐水灌注心血管循环系统,剪取分离小鼠主动脉。用于提取总蛋白的组织用液氮冷冻后保存于-80℃冰箱;用于病理检查的组织固定于4%甲醛中,之后用石蜡包埋切片,脱蜡后进行HE和Masson染色。
3.4 Western blot 实验 将小鼠主动脉组织在RIPA裂解液(PMSF∶RIPA=1∶100)中剪碎,匀浆,用超声波细胞破碎仪低温裂解细胞,4℃、16 000×g离心15 min,取上清,BCA 法测定蛋白浓度。每组动物组织取50µg总蛋白经SDS-PAGE 分离,电转至PVDF 膜。用5%脱脂奶粉室温封闭1 h,I抗4℃孵育过夜,次日洗涤 I 抗 3 次,孵育 II 抗 1 h,洗涤 II 抗 4 次,化学发光法显影。
4 统计学处理
采用SPSS 软件进行统计分析。数据以均数±标准误(mean±SEM)表示。多组间均数比较采用单因素方差分析(one-way ANOVA),两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
结 果
1 CD1d敲除加重Ang II灌注引起的血压升高
与对照组(WT+saline 组)相比,灌注Ang II 后小鼠血压显著升高(P<0.05),而CD1d敲除(NKT 细胞失活)则加重Ang II 灌注引起的血压升高(P<0.05),见图1。
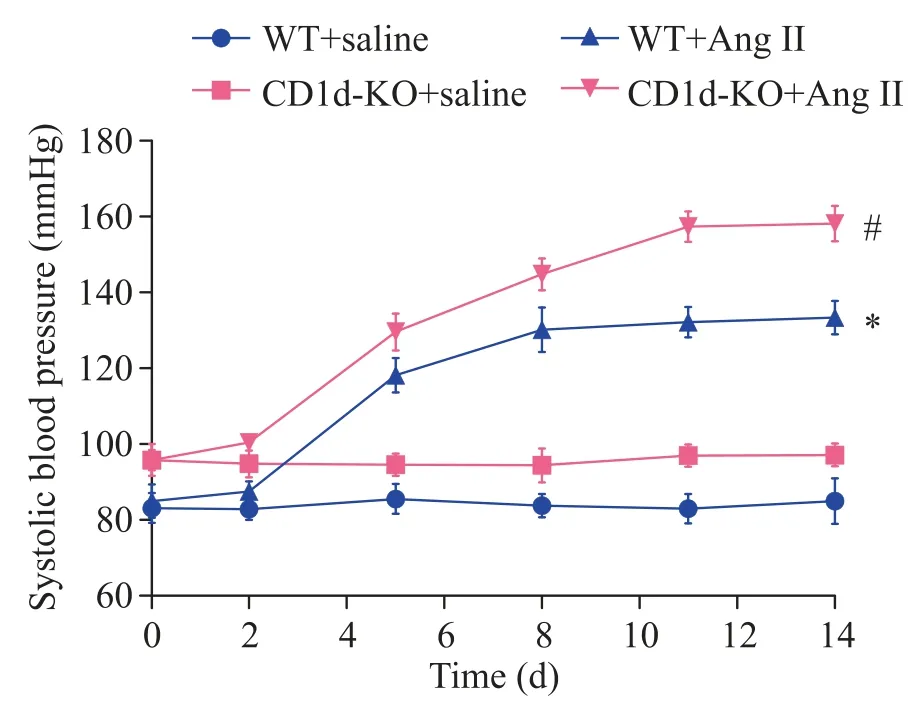
Figure 1.Effect of Ang II infusion for 14 d on blood pressure of WT and CD1d-KO mice.Mean±SEM. n=8.*P<0.05 vs WT+saline group;#P<0.05 vs WT+Ang II group.图1 无创尾套法检测Ang II 灌注14 d 后WT 及CD1d-KO小鼠的血压变化
2 CD1d 敲除加重Ang II 灌注引起的血管重塑,而NKT细胞激活则减轻上述改变
与WT+saline 组相比,Ang II 灌注引起小鼠血管壁增厚,胶原沉积增多,纤维化明显,CD1d敲除加重了Ang II灌注引起的上述变化(P<0.05),见图2A;而给予NKT 细胞特异性激活剂α-GC 则减轻了上述改变(P<0.05),见图2B。
3 CD1d 敲除加重Ang II 灌注引起的VSMCs 表型转换
与WT+saline 组相比,Western blot 结果显示Ang II灌注显著减少小鼠VSMCs 收缩型标志蛋白α-SMA的表达(P<0.05),增加小鼠VSMCs 分泌型蛋白OPN的表达(P<0.05);CD1d敲除后上述改变进一步加重(P<0.05),见图3。
4 NKT 细胞激活减轻Ang II 灌注引起的VSMCs表型转换
与 Ang II 组相比,灌注 Ang II 同时给予 α-GC 可显著增加α-SMA 的表达(P<0.05),减少OPN 的表达(P<0.05),见图4。
5 NKT 细胞通过影响PDGFRβ 的表达而参与Ang II灌注引起的VSMCs表型转换
与WT+saline 组相比,灌注Ang II 后小鼠主动脉组织中PDGFRβ表达显著增加,CD1d敲除进一步增加 PDGFRβ 的表达水平(P<0.05),而 α-GC 则降低PDGFRβ的表达(P<0.05),见图5。
讨 论
在本研究中,我们证实了NKT 细胞失活可进一步加重Ang II 灌注引起的小鼠VSMCs 表型转换,进而加重血管重塑,且进一步上调小鼠动脉组织中PDGFRβ 的表达水平,而NKT 细胞特异性激动剂α-GC 可以显著减轻以上改变,从而提示NKT 细胞可能通过影响PDGFRβ表达参与VSCMs的表型转换。
既往研究证实,VSMCs表型转换是高血压、动脉粥样硬化、血管再狭窄等血管重塑性疾病的细胞病理学基础[12]。当血管受到刺激之后,收缩型VSMCs去分化转换为具有较强分泌能力及增殖能力的分泌型VSMCs 来适应环境变化,可分泌细胞外基质蛋白引起血管壁增厚,进而引起血管重塑[3]。Guzik 等[13]的研究显示,缺乏T 细胞和B 细胞的RAG-1-/-小鼠具有迟钝的高血压反应,过继转移T细胞而不是B细胞恢复了小鼠对高血压刺激因素的正常反应,并且在给予小鼠Ang II 后检测到血管中的T 细胞表面标志物CD3及T细胞受体显著增加,证明T细胞在高血压的病理生理进程中具有重要作用。有研究显示,自发性高血压大鼠血管组织中收缩蛋白α-SMA 下调,而合成蛋白OPN 上调,表明在高血压发生与发展的过程中发生了VSMCs的表型转换[14]。我们之前的结果也显示,Ang II显著增加小鼠动脉组织炎症细胞的浸润,而作为先天与获得性免疫的“桥梁”的NKT 细胞失活后进一步增加炎症细胞在小鼠动脉组织的聚集,这些结果提示NKT细胞参与了高血压的发生,其激活后可拮抗高血压的发展[15],但NKT 细胞是否参与高血压引起的VSMCs表型转换尚不清楚。本研究结果显示,NKT 细胞失活可进一步下调Ang II 灌注引起的收缩型蛋白α-SMA 的表达,上调分泌型蛋白OPN的表达,而NKT细胞激活则减轻上述变化,提示NKT 细胞作为一种新型的T 细胞亚群,也参与了高血压小鼠的VSMCs表型转换及血管重塑。
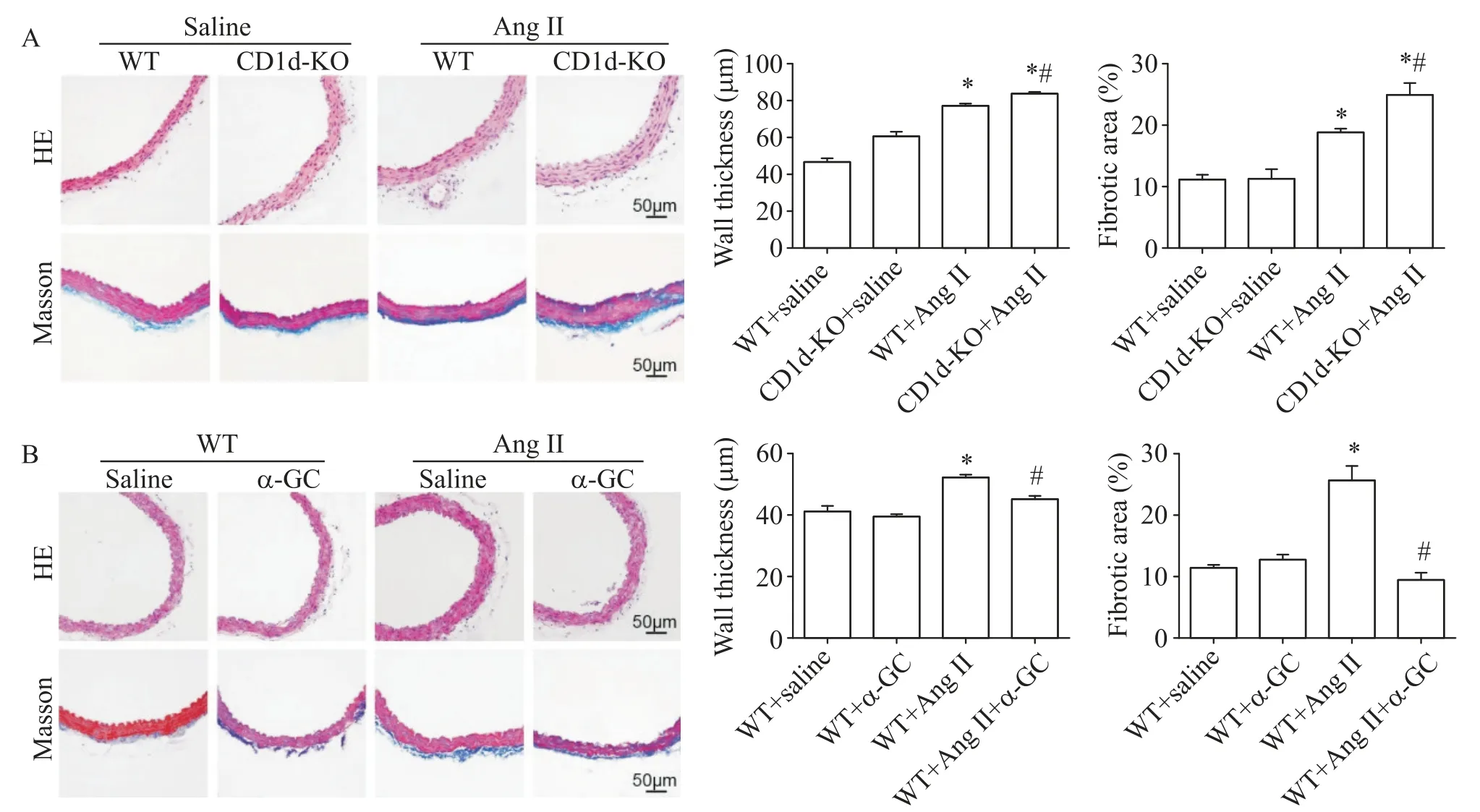
Figure 2.Effects of NKT cell inactivation(CD1d-KO;A)and activation(α-GC treatment;B)on Ang II-induced remodeling of aor‑tic tissues.The vascular wall thickness was measured by HE staining,while collagen deposition was observed by Masson staining.Scale bar=50 µm.Mean±SEM. n=5. *P<0.05 vs WT+saline group;#P<0.05 vs WT+Ang II group.图2 HE和Masson染色检测CD1d敲除及NKT细胞激活对Ang II灌注引起的血管重塑的影响
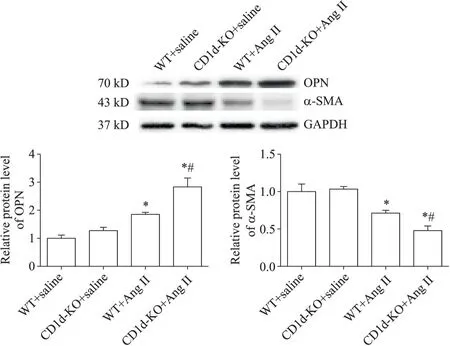
Figure 3.Effects of CD1d-KO(NKT cell inactivation)on OPN and α-SMA protein expression in aortic tissues after Ang II infusion.Mean±SEM. n=5. *P<0.05 vs WT+saline group;#P<0.05 vs WT+Ang II group.图3 CD1d敲除对灌注Ang II后主动脉组织中OPN和α-SMA表达的影响
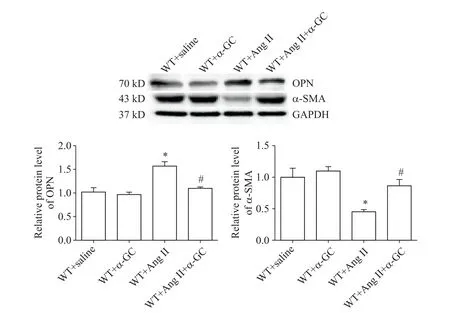
Figure 4.Effects of α-GC(NKT cell activation)on OPN and α-SMA protein expression in aortic tissues after Ang II infusion.Mean±SEM. n=5.*P<0.05 vs WT+saline group;#P<0.05 vs WT+Ang II group.图4 NKT细胞激活对灌注Ang II后主动脉组织中OPN和α-SMA表达的影响

Figure 5.Effects of CD1d-KO(NKT cell inactivation)and α-GC(NKT cell activation)on PDGFRβ protein expression in aortic tissues after Ang II infusion.Mean±SEM. n=5. *P<0.05 vs WT+saline group;#P<0.05 vs WT+Ang II group.图5 CD1d敲除及NKT细胞激活对灌注Ang II后主动脉组织中PDGFRβ表达的影响
有研究显示,PDGF 可抑制VSMCs 收缩型标志物的表达,表明PDGF 调节VSMCs 去分化且促进了其由收缩型向分泌型转换[5,12]。PDGF 是脉管系统迁移和增殖的发育过程中所必需的一种重要的促有丝分裂因子,可形成二聚体结构如PDGF-AA 和PDGFBB,与细胞膜上的相应受体PDGFRα 和PDGFRβ 结合后具有刺激特定细胞群分裂、增殖的能力[16]。蒋健等[17]的研究发现,血管紧张素转换酶抑制剂通过下调PDGF 的表达抑制VSMCs 表型转换,进一步验证了PDGF 在VSMCs 表型转换中的重要作用。本研究显示,CD1d敲除进一步促进Ang II 灌注引起的PDGFRβ 表达上调,而给予 α-GC 减轻 Ang II 灌注引起的上述变化,提示NKT 细胞可能是通过调节小鼠主动脉组织中PDGFRβ的表达来调节VSMCs的表型转换,从而参与血管重塑的发生。
综上所述,NKT 细胞失活可加重Ang II 灌注引起的血压升高、血管重塑及VSMCs表型转换,上调血管组织中PDGFRβ 的表达,而NKT 细胞激活则减轻上述变化。以上结果提示NKT 细胞可能通过影响PDGFRβ 的表达,从而调节VSMCs 表型转换,参与血管重塑。
