低氧预处理脐带间充质干细胞来源的外泌体对内皮细胞功能的影响*
2020-09-07叶锦豪顾杰蕾刘建卫刘世明
叶锦豪,陈 静,季 杨,顾杰蕾,刘建卫,刘世明,钟 赟
(广州医科大学附属第二医院广州心血管疾病研究所,广州呼吸健康研究院呼吸疾病国家重点实验室,广东省血管疾病重点实验室,广东广州510260)
冠心病在全世界的发病率都很高,且是死亡的主要原因。到2030 年,预计因心血管疾病死亡的人数将增至2330 万[1]。目前,缺血性心脏病的治疗方法主要有药物、经皮冠脉介入及冠脉搭桥术,虽然这些方法已经大大提高患者的生存率,但是无法抑制心肌梗死后纤维瘢痕组织的形成和心室组织的重构。研究发现,促血管新生可以减少心肌缺血后缺血区心肌细胞的坏死,减缓心肌梗死的进展,改善心脏功能[2]。
间充质干细胞(mesenchymal stem cells,MSCs)移植被认为是一种很有前途的修复心肌梗死后心肌组织的治疗方法,然而,心肌梗死后损伤局部缺氧和炎症微环境限制了移植的干细胞的存活和疗效[3]。近年来发现,移植后的干细胞可通过旁分泌起作用,其所分泌的外泌体(exosome)可能起到重要保护效应。外泌体是一种由细胞分泌的纳米级膜性小囊泡,携带大量功能性蛋白质和RNA 等,可在细胞间转移这些活性分子,从而调节受体细胞的生命活动[4]。
有研究报道,低氧预处理可以增强骨髓间充质干细胞的旁分泌作用,其分泌的外泌体在体外促进内皮细胞功能,并在心梗动物模型中增加梗死区域的血管密度,减少心肌细胞凋亡和心梗后的不良重构,改善心功能[5]。人脐带间充质干细胞(human um‑bilical cord mesenchymal stem cells,hUCMSCs)是典型的成体干细胞之一,与骨髓来源的干细胞相比,具有免疫原性低、无创伤获取、易于体外扩增等优点[6]。基于以上研究现状,本研究选用hUCMSCs,在体外探讨hUCMSCs 经低氧预处理后,其分泌的外泌体对人脐静脉内皮细胞(human umbilical vein endo‑thelial cells,HUVECs)增殖、迁移和小管形成能力的影响及可能机制。
材料和方法
1 主要试剂
DMEM/F12和EBM-2培养基、胎牛血清(fetal bo‑vine serum,FBS)、Ⅱ型胶原及诱导分化液购自Gib‑co;Cell Counting Kit-8(CCK-8)购自Dojindo;EdU试剂盒购自广州市锐博生物科技有限公司;基质胶购自Corning;抗CD63抗体、抗CD9抗体、抗Alix抗体和抗钙连蛋白(calnexin)抗体购自 Proteintech;抗GAPDH抗体购自Cell Signaling Technology。
2 主要方法
2.1 HUVECs 的分离、培养与鉴定 无菌状态下取健康新生儿脐带,在超净工作台内,找到脐静脉口,D-Hanks 液冲净脐静脉内血液。止血钳夹住脐静脉一端,用注射器灌注1 g/L Ⅱ型胶原酶,待静脉完全充盈后夹闭另一端。将脐带放入含PBS 的烧杯中消化20 min。取出脐带并收集消化液到离心管中,用含5% FBS 的EBM-2 培养基冲洗脐静脉,收集冲洗液到离心管中,1 500 r/min 离心5 min,弃上清液,加入含5% FBS 的EBM-2 培养基重悬细胞于培养瓶中,放入37℃培养箱内培养。待细胞生长融合至80%以上时传代,第3 代以后细胞用于后续实验。采用流式细胞术检测第3 代HUVECs 表面标志物CD31和CD45的阳性表达百分比。
2.2 hUCMSCs 的分离、培养与鉴定 参考文献方法[7],采用组织块法从脐带分离hUCMSCs,细胞培养至第3 代以后用于后续实验。采用流式细胞术检测第 3 代 hUCMSCs 表面标志物 CD29、CD44、CD90、CD105、CD31、CD34、CD45 和HLA-DR 的阳性表达百分比。
2.3 多向分化检测 取第5 代hUCMSCs 接种于12孔板中,待细胞生长融合达到80%时,弃去培养基,分别更换为成脂、成骨和成软骨诱导分化液,每3 d换分化液1 次。诱导4 周后,4%多聚甲醛室温固定30 min,再分别用油红O 染液、茜素红S 染液和甲苯胺蓝染液染色30 min,显微镜下观察拍照。
2.4 低氧预处理 FBS 在4℃、12 0000×g超速离心12 h,收集上清,用0.22µm滤器过滤,即可得到无菌的无外泌体血清,用于后续实验。hUCMSCs 分为低氧(hypoxia,Hypo)组(1%O2)和常氧(normoxia,Nor)组(21%O2)。接种hUCMSCs 到96 孔板,待细胞生长融合达到80% 时,更换含5% 无外泌体血清的DMEM/F12 培养基,放入低氧或常氧培养箱中培养12、24、36和48 h。每孔加入10 µL CCK-8溶液,置于37℃培养箱内孵育3h,酶标仪检测450 nm处吸光度。
2.5 外泌体分离、鉴定与共培养 接种hUCMSCs到100 mm 培养皿,待细胞生长融合达到80%时,更换含5%无外泌体血清的DMEM/F12 培养基,放入低氧或常氧培养箱中培养36 h。收集培养基上清液,超速离心法提取外泌体。采用透射电镜观察外泌体的形态;采用纳米颗粒跟踪分析技术(nanoparticle tracking analysis,NTA)检测外泌体的粒径及浓度;采用Western blot 检测外泌体表面标志性蛋白Alix、CD63 和CD9,以及细胞内质网标志性蛋白calnexin的表达。PKH26 标记外泌体后与HUVECs 共培养,荧光显微镜下观察外泌体与HUVECs的融合情况。
2.6 EdU实验检测细胞增殖能力 HUVECs分为对照(control,Con)组、常氧外泌体(normoxic exosome,ExoNor)组和低氧外泌体(hypoxic exosome,ExoHypo)组。配制含2×1012particles/L 常氧或低氧外泌体和5%无外泌体血清的EBM-2 培养基。接种HUVECs 至96孔板,待细胞生长融合达到80%时,更换配制好的含外泌体培养基孵育12 h。配制含50 µmol/L EdU 的培养基,继续孵育2 h。用4%多聚甲醛固定细胞和0.5%Triton X-100通透细胞后,加入Apollo染色液避光室温孵育。最后用DAPI 工作液对细胞核进行染色。荧光显微镜下观察拍照。
2.7 细胞划痕实验 接种HUVECs 到6 孔板,待细胞生长融合达到90%时,更换配制好的含外泌体培养基孵育细胞12 h。用200µL无菌枪头在细胞表面垂直划“十”字,PBS 洗涤脱落的细胞,更换为无血清EBM-2 培养基继续培养24 h,显微镜下观察拍照,使用ImageJ软件对细胞迁移距离进行统计分析。
2.8 Transwell小室迁移实验 接种HUVECs 到6孔板,待细胞融合度达到80%时,更换配制好的含外泌体培养基孵育细胞12 h。消化各孔细胞,离心后弃上清,用无血清EBM-2培养基重悬细胞,配制成细胞密度为4×108/L 的细胞悬液。将Transwell 小室放入24 孔板内,上室加入100µL 细胞悬液,下室加入700µL含5%FBS的EBM-2培养基,放入37℃培养箱内继续培养12 h。弃上室和下室培养基,4%多聚甲醛固定细胞后用1%结晶紫染液染色30 min。弃去染液,用PBS清洗小室3遍后置于倒置显微镜下观察拍照,使用ImageJ软件对迁移细胞数量进行分析统计。
2.9 小管形成实验 将96 孔板放置在冰上,每孔加入40µL基质胶,置于37℃培养箱内1 h,待基质胶凝固备用。接种HUVECs到6孔板,待细胞生长融合达到80%时,更换配制好的含外泌体培养基孵育细胞12 h。消化各组细胞,离心后弃上清,用无血清EBM-2 培养基重悬细胞,配制成细胞密度为4×108/L的细胞悬液。向铺有基质胶的96 孔板中加入100µL细胞悬液,置于37℃培养箱内孵育8 h。倒置显微镜下观察拍照,使用ImageJ 软件对小管长度进行分析统计。
4 统计学处理
采用GraphPad Prism 7.0 统计软件进行分析,数据均采用均数±标准差(mean±SD)表示。两组间比较采用独立样本t检验。多组间比较采用单因素方差分析(one-way AVOVA),组间两两比较采用Bon‑ferroni 校正的t检验。以P<0.05 为差异有统计学意义。
结 果
1 HUVECs与hUCMSCs的鉴定
采用酶消化法获得HUVECs,组织块法得到hUCMSCs,倒置显微镜下观察,第 3 代 HUVECs 呈铺路石样,第3 代hUCMSCs 呈长梭形,见图1A。流式细胞术检测细胞表面标志物,第3代HUVECs高表达CD31,阳性率均90%以上,而低表达CD45,见图1B;第 3 代 hUCMSCs 高 表 达 CD29、CD44、CD90 和CD105,阳性率均90%以上,而低表达CD31、CD34、CD45 和HLA-DR,见图1C,均与文献报道的内皮细胞和间充质干细胞标准相一致。多向分化结果显示,第5代hUCMSCs具有成脂、成骨及成软骨分化能力,见图1D,符合间充质干细胞的分化特性[8]。
2 低氧预处理增强hUCMSCs的细胞活力
hUCMSCs 在低氧(1% O2)和常氧(21% O2)培养箱中培养 12、24、36 和 48 h 后,采用 CCK-8 法检测细胞活力,结果显示,低氧组hUCMSCs 的活力明显高于常氧组,且在36 h时细胞活力最好,见图2。
3 低氧预处理促进hUCMSCs的外泌体释放
超速离心法提取hUCMSCs 释放的外泌体,利用NTA 检测外泌体的粒径和浓度,见图3A。利用透射电镜观察外泌体的形态,见图3B。利用Western blot检测外泌体表面标志性蛋白Alix、CD9、CD63 以及细胞内质网标志性蛋白calnexin 的表达[9],见图3C。结果发现低氧预处理hUCMSCs 后其外泌体释放明显增加(P<0.05)。
4 hUCMSCs来源外泌体能够被HUVECs内化
外泌体与HUVECs 融合实验经荧光显微镜观察显示,PKH26 标记的外泌体颗粒可与HUVECs 相融合并进入HUVECs内,聚集在核周,见图4。
5 hUCMSCs外泌体对HUVECs增殖的影响
利用EdU 实验检测经外泌体处理后HUVECs 的增殖能力,结果显示,Con 组、ExoNor组和 ExoHypo组EdU 阳性细胞率分别为(29.15±3.13)%、(32.12±3.17)%和(36.82±3.49)%;与 Con 组相比,ExoNor和ExoHypo组HUVECs的增殖能力明显增强(P<0.05);与ExoNor组相比,ExoHypo组HUVEC 的增殖能力进一步增强(P<0.05),见图5。
6 hUCMSCs外泌体对HUVECs迁移的影响
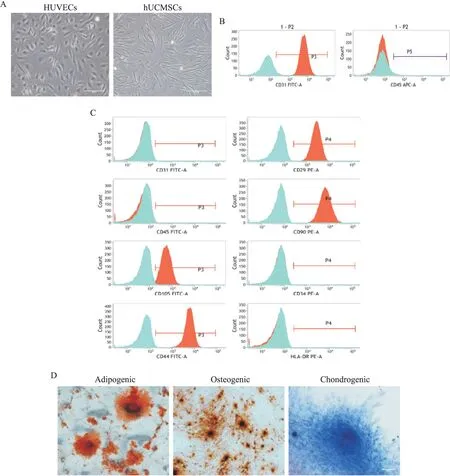
Figure 1.Characterization of HUVECs and hUCMSCs.A:the morphologyical changes of P3 HUVECs and P3 hUCMSCs(scale bar=100µm);B:the surface marker determination of HUVECs;C:the surface marker determination of hUCMSCs;D:the dif‑ferentiation potential of hUCMSCs(scale bar=100µm).图1 HUVECs和hUCMSCs的鉴定
利用细胞划痕和Transwell实验检测经外泌体处理后HUVECs 的迁移能力。划痕24 h 后,Con 组、ExoNor组和ExoHypo组划痕区迁移面积分别为(37.91±4.62)%、(51.67±4.17)%和(70.92±5.20)%;ExoNor和ExoHypo组HUVECs的迁移距离明显大于Con组(P<0.05);与 ExoNor组相比,ExoHypo组 HUVECs 的迁移距离明显增加(P<0.05),见图6A。小室迁移12 h 后,Con 组 、ExoNor组 和 ExoHypo组 迁 移细 胞 数分 别 为178.80±8.01、203.20±5.59 和 225.80±8.61;与 Con组相比,ExoNor和ExoHypo组迁移到下室的细胞数明显增多(P<0.05);ExoHypo组迁移细胞增多比ExoNor组更明显(P<0.05),见图6B。
7 hUCMSCs外泌体对HUVECs小管形成的影响
孵育 8 h 后,Con 组、ExoNor组和 ExoHypo组成管总长 度 分 别 为(7 214.57±642.89)px、(8 746.29±488.41)px 和(9 826.00±548.21)px;与 Con 组 相比,ExoNor和ExoHypo组外泌体都促进HUVECs 的成管(P<0.05);ExoHypo组成管明显多于ExoNor组(P<0.05),见图7。

Figure 2.The effect of hypoxia(Hypo)pretreatment on the viability of hUCMSCs.The cell viability was determined by CCK-8 as‑say.Mean±SD. n=3.*P<0.05 vs normoxia(Nor)group.图2 低氧预处理增强hUCMSCs的活力
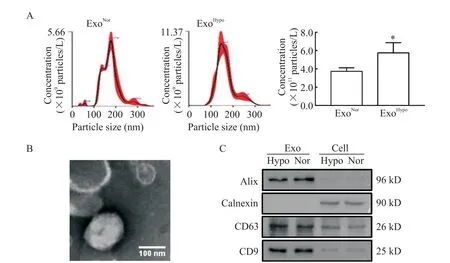
Figure 3.Characterization of exosomes derived from hUCMSCs under normoxic and hypoxic conditions.A:the exosomes released from hUCMSCs were quantified by nanoparticle tracking analysis;B:the morphological change of exosomes was assessed by transmission electron microscopy;C:the protein expression of Alix,CD63,CD9 and calnexin were determined by Western blot.Mean±SD. n=3.*P<0.05 vs normoxic exosome(ExoNor)group.图3 低氧预处理促进hUCMSCs的外泌体释放
讨 论
缺血性心脏病的病理特点是血管狭窄和堵塞,促血管新生对缺血性心脏病的预后和心功能的改善有重要作用。因此,寻找一种通过促进血管新生修复损伤心肌,从而改善心功能的方法成为冠心病治疗新的研究方向[10]。本研究选取HUVECs 作为研究对象,采用酶消化法从脐带获取HUVECs,经流式细胞术鉴定为内皮细胞后,分别通过EdU、细胞划痕、Transwell 和小管形成实验检测内皮细胞功能的变化,从而在体外开展促血管新生的研究。结果表明:(1)与常氧组相比,低氧预处理增强hUCMSCs 细胞活力,促进其外泌体释放;(2)与常氧外泌体组相比,低氧预处理hUCMSCs释放的外泌体增强HUVECs的增殖、迁移和小管形成能力。
越来越多研究证实了MSCs 治疗缺血性心脏病的潜力。MSCs 最先从骨髓中被鉴定和分离出来,并成为了组织工程和再生治疗的有力工具。虽然骨髓是MSCs最常见和最具特征的来源,但是从骨髓中分离MSCs的过程复杂且具有创伤性。长期以来,脐带一直被认为是一种医疗废物,但近年来脐带却成为MSCs 的重要来源。相比骨髓间充质干细胞,脐带间充质干细胞具有许多优点,包括无创伤获取、低免疫原性和易于体外扩增。但是目前脐带间充质干细胞对心肌缺血后血管新生的作用尚不清楚[11-12]。因此,本研究通过组织块法从脐带中分离得到hUCMSCs,通过细胞表面特异性抗原和分化潜能检测,鉴定所获取细胞为间充质干细胞,传代纯化后用于后续间充质干细胞对血管新生作用的研究。
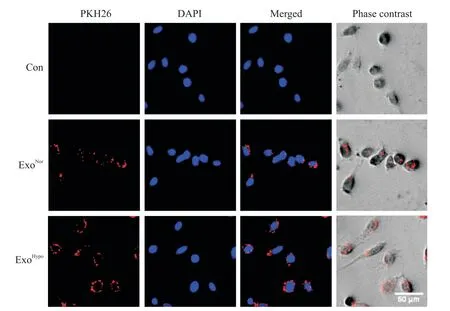
Figure 4.Uptake of hUCMSCs-derived exosomes by HUVECs.The PKH26-labeled hUCMSCs-derived exosomes were internalized by HUVECs.图4 hUCMSCs来源外泌体被HUVECs内化

Figure 5.The proliferation of HUVECs after treatment with exosomes released from hUCMSCs was determined by EdU assay.The scale bar=50 µm.Mean±SD. n=3.*P<0.05 vs control(Con)group;#P<0.05 vs ExoNor group.图5 hUCMSCs外泌体对HUVECs增殖的影响
间充质干细胞是一类具有多向分化潜能的干细胞,当被移植到缺血心脏时,能够分化为血管内皮细胞、平滑肌细胞,甚至心肌样细胞,有益于心脏组织的修复和再生。然而,干细胞移植治疗缺血性心脏病存在移植细胞存活率低和栓塞的风险[13]。据报道,干细胞除了通过分化潜能发挥治疗作用外,还可通过旁分泌作用,释放包括外泌体在内的多种旁分泌因子。作为生物分子的天然载体,外泌体可通过携带功能性蛋白质和RNA 等重要活性分子并将其转运至靶细胞,在细胞间信号的传输和交换发挥着重要作用。抑制细胞外泌体释放,会导致细胞的内外环境紊乱,进而影响细胞的生理功能[14]。我们之前的研究证实,脂多糖预刺激骨髓间充质干细胞释放的外泌体可以减轻炎症和心肌损伤[15]。Ma 等[16]在小鼠心肌缺血模型与体外研究中发现,骨髓间充质干细胞释放的外泌体可通过传递miR-132 促进心肌梗死后梗死周围区的血管形成,改善心功能。该研究表明了干细胞来源的外泌体具有与干细胞相似生物学效应,对缺血性疾病具有治疗效果。此外,外泌体提取方法完善,易于储存,生物学功能稳定,是干细胞治疗的理想替代品。因此,干细胞来源外泌体为缺血性疾病的治疗提供了新的方向[17]。本研究通过超速离心法分离出hUCMSCs 外泌体,并在透射电镜下观察其形态,NTA 检测其粒径和浓度,West‑ern blot检测其表面特异性的标志蛋白。结果均与外泌体的生物学特性相符。

Figure 6.The migration ability of HUVECs after treatment with exosomes released from hUCMSCs.A:the results of scratch wound assay(scale bar=50µm);B:the results of Transwell migration assay(crystal violet staining,scale bar=100 µm).Mean±SD. n=3.*P<0.05 vs Con group;#P<0.05 vs ExoNor group.图6 hUCMSCs外泌体对HUVECs迁移的影响

Figure 7.The tube formation of HUVECs after treatment with exosomes released from hUCMSCs.The Matrigel tube formation analy‑sis of HUVECs was performed.The scale bar=100 µm.Mean±SD. n=3.*P<0.05 vs Con group;#P<0.05 vs ExoNorgroup.图7 hUCMSCs外泌体对HUVEC小管形成的影响
最近一项研究表明,间充质干细胞在模拟外周动脉疾病的缺氧微环境(0% FBS 和1% O2)中培养后,其分泌的外泌体含有一系列促血管生成的因子,对心肌梗死后心脏功能的恢复有益[18]。该研究证明,细胞随着所处微环境的不同,其分泌外泌体的数量和携带的内容物会随之发生改变,从而表现出不同的生物学效应。为了探讨低氧环境下,脐带间充质干细胞来源的外泌体对内皮细胞功能的影响,我们 分 别 采 用 常 氧(21% O2)和 低 氧(1% O2)对hUCMSCs 进行预处理,比较其来源外泌体对HUVECs 增殖、迁移和小管形成的影响。结果显示,hUCMSCs 经过低氧预处理后其细胞活力明显增强;与常氧组相比,经过低氧预处理的hUCMSCs 其释放的外泌体对HUVECs 增殖、迁移和小管形成的促进作用更为明显。
综上所述,本研究揭示了经过低氧预处理的hUCMSCs 来源的外泌体,可能成为一种促血管新生从而治疗心肌梗死等缺血性疾病的新策略。下一步我们将对包括miRNA 在内的外泌体内容物及相关保护机制作进一步的研究,以期为干细胞外泌体治疗缺血性心脏病提供新的理论依据。
