3株猪源多动物链球菌的分离与鉴定
2020-09-03王丽扬王铉皓许倩倩王鹏勇王彦红
王丽扬,王铉皓,许倩倩,高 尚,王鹏勇,王彦红
(1. 扬州大学兽医学院,江苏 扬州 225009 ; 2. 江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
多动物链球菌(Streptococcuspluranimalium,SP)最早由Devriese(1999年)从患有隐性乳房炎的奶牛,及奶牛的生殖道、扁桃体, 金丝雀的嗉囊、呼吸道,以及绵羊和猫的扁桃体中分离[1],经过分离鉴定确认其为链球菌中的新种。这种新的链球菌还被发现与小牛脑膜炎相关,可能是败血症的后遗症[2]。也有相关研究指出,多动物链球菌可以引起肉鸡的心内膜炎和败血症[3]。众多临床病例表明,这种新的链球菌主要感染动物为牛和家禽,尚未出现有关猪感染该链球菌的报道,2018年不同时间,从扬州大学动物医院就诊的病例中分离出3株细菌,因此,对猪源多动物链球菌的生化、生物学特性进行相关研究,为进一步对其流行病学、免疫与防治的深入研究奠定基础。
1 材料与方法
1.1 病例背景 2018年3月,江苏省扬州仪征某猪场共饲养了200头60日龄的猪,出现几头死亡,送检1头病死猪来剖检,该猪生前出现呼吸道症状,10多天后即死亡,死前皮肤发紫,口中流有鼻涕。剖检可见肺脏实变,有结节,鼻腔、气管内含有大量浓稠分泌物。
2018年5月,扬州江都某猪场送检仔猪1头,该猪场共饲养了600头母猪,所产仔猪为3~5日龄,几乎每窝均有发病,病猪主要表现为水样腹泻、消瘦、脱水死亡,病程3~5 d。剖检可见肾脏呈点状出血。
2018年9月,淮安洪泽送检病死仔猪1头,该猪场共饲养了80头母猪,产仔前后母猪仔猪均表现正常,断奶后至3月龄之间出现死亡,7~9月份陆续死亡200头。剖检可见心肌外膜有较多纤维素附着,肝脏稍肿、肾出血与贫血相交替,脾小端梗死,肠系膜淋巴结水肿,肺淤血、水肿。
1.2 培养基 琼脂粉与氯化钠,购自国药集团化学试剂有限公司;绵羊血,购自杭州微生物试剂有限公司。绵羊血平板按照通用组方自行配制。
1.3 主要试剂 本试验所用生化鉴定管和药敏试纸片,均购自杭州微生物试剂有限公司。16S rDNA Bacterial Identification PCR Kit试剂盒,购自宝生物工程(大连)有限公司。
1.4 实验动物 清洁级6周龄BALB/c小鼠8只,雌雄各半,健康状态良好,购自扬州大学兽医学院比较医学中心。
1.5 主要仪器 超净工作台(型号为SW-CJ-IL),购自杭州微生物试剂有限公司;恒温培养箱(型号为GNP9080),购自上海精宏实验设备有限公司;DNA扩增仪(型号为4484073),购自北京智杰方远科技有限公司;奥林巴斯CX系列生物显微镜(型号为CX21FS1C),购自奥林巴斯(广州)工业有限公司;凝胶电泳仪(型号为DYCP-31DN),购自北京六一生物科技有限公司。
1.6 细菌分离 分别取3例病猪的肝脏、肺脏、脾脏、肾脏、皮下水肿液无菌接种于血琼脂平板(含5%绵羊血),于37 ℃条件下培养24 h,观察结果。24 h后无菌挑取血琼脂平板上的单个菌落进行纯培养,再挑取单个菌落进行革兰染色镜检。
1.7 生化试验 无菌挑取分离菌的纯培养物分别接种于乳糖、蔗糖、麦芽糖、甘露醇等一系列生化反应管中并置于37 ℃条件下培养48 h,观察结果。
1.8 16S rDNA鉴定 通过煮沸裂解法制备3株分离菌的DNA模版,按照宝生物工程(大连)有限公司16S rDNA Bacterial Identification PCR Kit方法进行PCR扩增,取5 μL扩增产物进行1%的琼脂糖凝胶电泳,将剩余的PCR扩增产物送至金斯瑞生物科技公司测序。
1.9 小鼠攻毒试验 将8只小鼠分为2组,每组4只,雌雄各半,第1组用于攻毒,第2组作为对照。取1株细菌摇菌过夜,菌液浓度约为7×108CFU/mL,小鼠腹腔注射0.4 mL。对照组每只腹腔注射0.4 mL生理盐水。置于温暖舒适的室内,给予相同鼠粮及饮水,观察小鼠状态。
1.10 药敏试验 采用常规药敏纸片扩散法,无菌操作将3株分离菌的纯培养物均匀涂抹于血平板上并置于37 ℃培养箱中培养24 h。药敏纸片有:美洛西林(75 μg/片)、复方新诺明(23.75 μg/片)、氟苯尼考(30 μg/片)、环丙沙星(5 μg/片)、庆大霉素(10 μg/片)、丁胺卡那霉素(30 μg/片)、诺氟沙星(10 μg/片)、阿莫西林(20 μg/片)、多西环素(30 μg/片)、头孢曲松(30 μg/片)、多黏菌素B(300 U/片)、头孢哌酮/舒巴坦普生(75/75 μg/片)、左氧氟沙星(5 μg/片)、头孢噻肟(30 μg/片)、新霉素(30 μg/片)、妥布霉素(10 μg/片)、链霉素(10 μg/片)、卡那霉素(30 μg/片)。
2 结果
2.1 细菌分离 3例病死猪的肝脏、肺脏、脾脏、肾脏及皮下水肿液无菌接种于血琼脂平板,24 h后从第1例病死猪肺脏中分离出细菌,第2例从肾脏中分离到细菌,第3例从皮下水肿液中分离到细菌,均长出边缘整齐、湿润、不透明、乳白色的完全溶血小菌落(见中插彩版图1)。将分离到的3株细菌分别编号为SP1、SP2、SP3。对纯化后的菌落进行革兰染色后,在油境下观察,分离菌株为革兰阳性球菌,呈链状或团块状排列(见中插彩版图2)。
2.2 生化试验 分离菌株能够发酵蔗糖、乳糖、麦芽糖、甘露醇、七叶苷、纤维二糖,不能发酵阿拉伯糖、山梨醇、蜜二糖(表1),与多动物链球菌的生化特性基本一致。
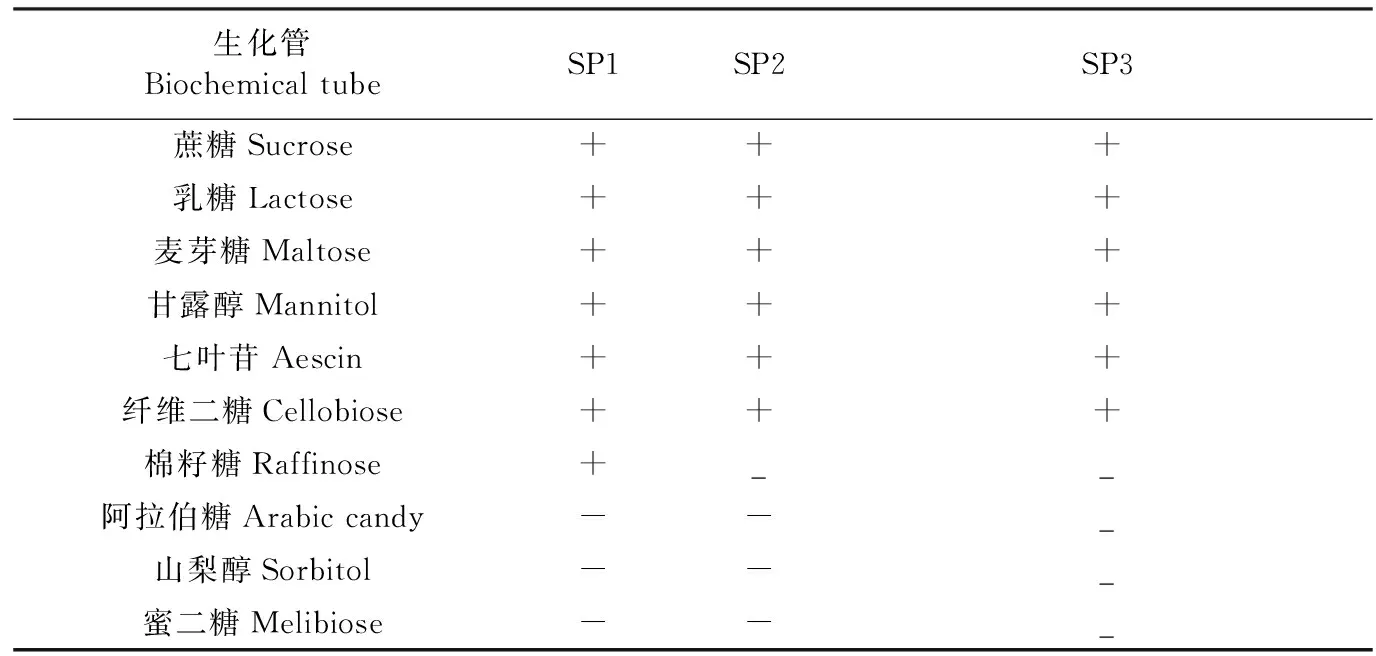
表1 3株分离菌株的生化试验结果Table 1 The results of 3 isolates biochemical test
2.3 16S rDNA鉴定结果 将3株分离菌的DNA模版进行PCR扩增后,均得到500 bp左右的目的条带,扩增产物送至金斯瑞生物科技公司进行测序,测序结果与NCBI数据库中的多动物链球菌CP022601.1具有99%的同源性,可确定分离菌株为多动物链球菌。
2.4 小鼠攻毒试验 攻毒24 h后试验组中4只小鼠死亡,对照组正常。对死亡小鼠进行剖检可发现炎症反应明显,肝脏、脾脏、肾脏肿大,腹腔器官粘连,胸腔有渗出液(见中插彩版图3)。采集肝脏制作触片并进行美蓝染色,于显微镜下观察可见大量链状或团块状的球菌,与分离菌镜检形态一致(见中插彩版图4)。
2.5 药敏试验 结果(见表2)显示,该分离株对头孢噻肟、链霉素、卡那霉素、妥布霉素、庆大霉素、复方新诺明、诺氟沙星、多西环素8种药物具有较强的耐药性,对美洛西林、阿莫西林、头孢曲松钠3种药物敏感。
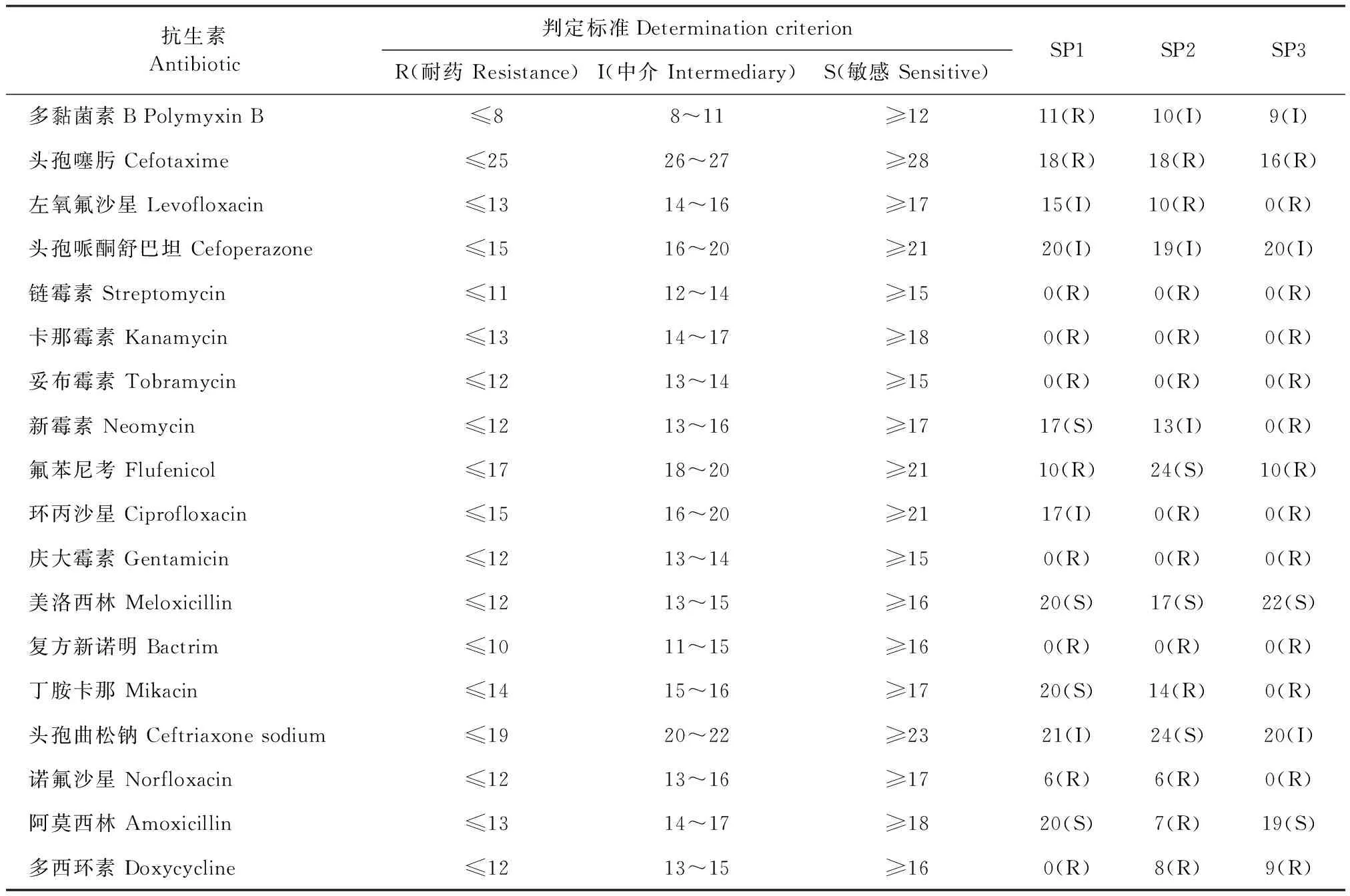
表2 3株分离菌药敏结果Table 2 The results of 3 isolates drug susceptibility (mm)
3 讨论
分别从送检猪的肺、肾、皮下水肿液分离到了3株细菌,通过生化试验、16S rDNA鉴定得出3株分离菌为多动物链球菌(SP)。多动物链球菌作为一种新型致病菌,可以感染牛、绵羊、羊驼和野鸡等多种动物[4]。自首次发现以来,世界多地均有分离到该菌的报道,国内也有从山羊鼻腔分泌物中分离到该菌报道[5]。而从猪的体内分离到尚属首次,从病例背景分析,这种细菌感染多见于幼龄猪。根据分离到菌株的部位也能发现这是一种能够全身多脏器感染的致病菌。此外,多动物链球菌也被发现与人类疾病相关,曾从人类硬膜下脓肿液中分离到该细菌[6]。类似链球菌感染人的报道屡见不鲜,由此可以看出,多动物链球菌具有潜在的跨物种传播能力。目前有关多动物链球菌的研究并不充分,也缺乏相应的快速诊断技术[7]。因此,有必要进一步研究多动物链球菌的发病机理将有助于开发预防和治疗该细菌感染的策略。

经过一系列药敏试验分析,3株细菌均对链霉素、妥布霉素、卡那霉素、庆大霉素耐药,这与氨基糖苷类抗生素自身特点有关,对革兰阳性菌的作用较弱相关,此外,也可能临床大量使用此类药物有关。另外发现该菌株对其他抗生素具有耐药性,这就导致临床上很多药物治疗无效,为了减少药物的滥用以及避免耐药性的产生,用药时应在药敏试验的科学指导下正确的应用,以免造成不必要的损失,对于本病的治疗可根据药敏结果作为参考,使用美洛西林、阿莫西林、头孢曲松钠等药物。
