受体相互作用蛋白激酶-3参与甲型H1N1流感病毒感染小鼠记忆性CD8+ T细胞的应答
2020-09-03秦波音王超刘洋任晓楠方钟李顺周晓辉
秦波音,王超,刘洋,任晓楠,方钟,李顺,周晓辉
复旦大学附属公共卫生临床中心,上海 201508
甲型H1N1流感病毒传染性强、流行范围广,可引起高发病率和病死率的急性呼吸道传染[1-2]。历次流感大流行给全球公共卫生、经济等诸多方面带来重大影响,严重威胁人类健康[3-5]。
受体相互作用蛋白激酶-3(receptor-interacting protein kinase 3, RIPK3)是RIPK家族中的重要一员,作为坏死复合体(necrosome)的关键成分之一介导细胞程序性坏死(necroptosis)的发生[6-7]。研究发现,RIPK3在宿主抗病毒、细菌等感染进程及无菌性炎症性疾病发生、发展中具有重要作用[8],但目前RIPK3对病毒特异性T细胞功能的影响尚不清楚。
CD8+T细胞在抗病毒感染中发挥关键性作用。根据表面分子CD44、CD62L可以将特异性CD8+T细胞分为下列亚群:CD44lowCD62Lhigh〔Naive T 细胞(TN)〕、CD44highCD62Lhigh〔中枢记忆性T细胞(central memory T cells, TCM)〕和CD44highCD62Llow〔效应记忆性T 细胞(effective memory T cells, TEM)或效应性T 细胞(effective T cells, TEff)〕。记忆静息阶段的TEM在遭遇再次感染后多数活化为TEff[9]。本课题组前期研究发现,流感抗原特异的效应性CD8+T 细胞的生成、细胞因子的分泌和颗粒酶水平的表达都一定程度依赖于RIPK3分子,提示RIPK3在甲型 H1N1流感病毒株A/Puerto Rico/8/34 (简称PR8) 感染肺部的炎症病理及诱导病毒特异的效应性CD8+T细胞过程中发挥重要作用[10]。
然而,RIPK3分子在流感抗原特异的记忆性CD8+T细胞形成及记忆性应答功能中的作用尚不明确。本研究利用RIPK3敲除小鼠的流感病毒感染模型,对RIPK3分子在记忆形成阶段的特异性CD8+T细胞数量、功能及再次感染应答中的作用进行了探讨。
1 材料和方法
1.1 病毒
流感病毒PR8由上海市兽医研究所的李泽君教授惠赠。在上海市公共卫生临床中心小动物感染实验室(BSL-2)内开展并完成动物感染实验(上海市病原微生物实验室备案凭证:金字第022015002号)。
1.2 实验动物
SPF级2~4月龄C57BL/6野生型(WT)和RIPK3敲除(RIP3-/-)雌性小鼠各10只,动物体重为22~24 g。C57BL/6野生型小鼠购于上海西普尔-必凯实验动物有限公司〔SCXK(沪)2018-0006〕,RIPK3-/-小鼠由北京生命科学研究所王晓东教授惠赠。动物在上海市公共卫生临床中心实验动物中心SPF级动物设施内进行饲养和繁育〔SYXK(沪)2015-0008〕,自由饮水和摄食,设施环境温度为20~25 ℃,湿度40%~70%,照明为12 h明暗交替。严格按照上海市公共卫生临床中心动物伦理委员会要求进行动物实验操作(本实验动物伦理审批号:IACUC2018-A044-02)。
1.3 实验试剂
DMEM培养液(美国Gibco公司)、PBS(以色列Biological Industries公司)、RPMI 1640培养基(美国Gibco公司)、BI胎牛血清(以色列Biological Industries公司)、1%青霉素和链霉素混合液(以色列Biological Industries公司)、红细胞裂解液(美国BioLegend公司)、流式抗体(美国BioLegend公司)。异氟烷麻醉剂(上海雅培制药有限公司)、BD Cytofix/Cytoperm Plus固定破膜试剂盒(美国BD公司)、高尔基复合体阻断剂(美国BD公司)、针对主要组织相容性复合物(major histocompatibility complex,MHC)Ⅰ类分子四聚体Flu.NP366〔ASNENMETM, H-2D(b)〕(广州好芝生物科技有限公司)以及肽段NP366-374(ASNENMETM)和PA224-233(SSLENFRAYV)(苏州强耀生物科技有限公司)。
1.4 实验方法
1.4.1 实验分组及小鼠攻毒将20只实验小鼠从SPF饲养区转入小动物感染实验室内预饲养1周,随机分为4组,每组5只:WT感染组和WT未感染组、RIPK3-/-感染组和RIPK3-/-未感染组。小鼠使用异氟烷麻醉后,通过滴鼻方式进行病毒感染,置于负压独立通风笼具(individually ventilate cagesdul,IVC)内饲养。感染组每只小鼠用40 μL含0.7×103TCID50(0.5倍LD50)的PR8/DMEM感染,未感染组采用等量生理盐水代替。初次感染后第38天进行再感染,感染组小鼠每只先用40 μL含4.2×103TCID50(3倍LD50)的PR8/DMEM病毒液滴鼻感染,再用100 μL含9.8×103TCID50(7倍LD50)的PR8/DMEM病毒液尾静脉注射感染。未感染组采用等量生理盐水代替。
1.4.2 样本采集及处理病毒初次感染后第37天和第41天(即再次感染前1 d和感染后第3天),各组小鼠经眼眶后眦静脉丛采集抗凝血,加入10倍体积红细胞裂解液,室温避光放置15 min后,4 ℃ 、500 g离心5 min,弃上清液,用预冷PBS清洗1次,用1 mL R10(RPMI 1640培养基+10%灭活血清+1%青霉素和链霉素)重悬,细胞计数。
1.4.3 流感病毒特异性CD8+T细胞比例的检测将外周血淋巴细胞与CD8-PB、CD44-APC、CD62L-PE-Cy7抗体和MHCⅠ类分子四聚体(Kb/NP366-PE),4 ℃ 孵育45 min,加入150 μL的染色缓冲液,4 ℃、 300 g离心5 min,弃上清液, 200 μL染色缓冲液重悬细胞,滤膜过滤后上机检测。所有数据用Flowjo(V10)软件进行分析。
1.4.4 流感病毒特异性CD8+T细胞内因子的检测将外周血淋巴细胞与流感肽段NP366-374和PA224-233(浓度均为 2.5 μg/mL)混合后,加入高尔基复合体阻断剂(浓度为 1 μg/mL),37 ℃恒温孵育5 h。混合液使用CD8-FITC和CD44-APC抗体进行细胞表面染色,用BD Cytofix/Cytoperm Plus固定破膜试剂破膜,然后用IFN-γ-PE和TNF-α-PE-Cy7抗体进行细胞因子内染色。每孔加入200 μL 预冷的PBS清洗1次,4 ℃ 、500 g离心5 min,弃上清液,涡旋振荡器振荡将细胞悬起。200 μL染色缓冲液重悬细胞,滤膜过滤后上机检测,所有数据用Flowjo(V10)软件进行分析。
1.5 统计学分析
所有数据用统计学软件GraphPad Prism 7.0进行统计学分析,数据以平均值±标准差(Mean±SD)表示,组间比较采用非配对t检验方法,P<0.05为差异有统计学意义。
2 结果
2.1 RIPK3敲除可导致小鼠流感病毒特异的记忆性CD8+ T细胞形成数量减少及其再次应答阶段的增殖数量降低
初次感染的小鼠在第38天进行再次感染,在再次感染前1 d和后3 d分别检测外周血流感病毒特异性CD8+T细胞(图1)。再次感染前即初次感染37 d后,WT和RIP3-/-小鼠流感病毒特异性CD8+T细胞均较未感染组增加,WT小鼠显著高于RIPK3-/-小鼠。WT感染组:(1.51±0.17)%,RIPK3-/-感染组:(0.43±0.04)%,P<0.01(图1A)。再次感染后的WT和RIPK3-/-小鼠流感病毒特异性CD8+T细胞均较对照组的增加,且WT小鼠仍显著高于RIPK3-/-小鼠。WT感染组:(2.07±0.72)%,RIPK3-/-感染组:(0.85±0.08)%,P<0.05(图1B)。以上数据提示,感染流感病毒PR8后,小鼠的RIPK3可能参与了记忆性CD8+T细胞的形成,因此,再次感染使得流感病毒特异性CD8+T细胞应答水平更高。
2.2 RIPK3敲除可导致小鼠流感病毒特异的记忆性CD8+ T细胞在记忆静息阶段和再次应答阶段分泌IFN-γ等细胞因子能力减弱
再次感染前1 d和感染后3 d,分别取小鼠外周血分离淋巴细胞与流感NP和PA的CD8表位肽段体外孵育8 h,检测流感病毒特异的CD8+T细胞中分泌IFN-γ和TNF-α的细胞比例(图2)。在再次感染前,WT小鼠流感病毒特异性CD8+T细胞中分泌IFN-γ的细胞比例显著高于RIPK3-/-小鼠〔分别为(0.67±0.05)%和( 0.21±0.17)%,P<0.01〕(图2A);WT小鼠分泌TNF-α的细胞比例也显著高于RIPK3-/-小鼠〔分别为(0.32±0.03)%和(0.12±0.01)%,P<0.01〕(图2B)。再次感染后,WT小鼠流感病毒特异性CD8+T细胞中分泌IFN-γ的细胞比例高于RIPK3-/-小鼠〔分别为(0.67±0.11)%和(0.31±0.03)%,P<0.05〕(图2C);而WT小鼠分泌 TNF-α 的细胞比例与RIPK3-/-小鼠无差异〔分别为 (0.17±0.04)%和(0.17±0.02)%,P>0.05〕(图2D)。结果提示,RIPK3对流感病毒特异的记忆性CD8+T细胞分泌IFN-γ和TNF-α能力均有影响。而在再感染后的记忆性应答中,RIPK3的缺失导致了流感病毒特异性CD8+T细胞分泌IFN-γ细胞因子的能力降低,但对其TNF-α的分泌影响不明显。

A: PR8 antigen specific CD8+ T cells in peripheral blood mononuclear cells (PBMC) isolated from mouse: 1 day before re-challenge, WT group compared to RIPK3-/- group. **: P<0.01. B: PR8 antigen specific CD8+ T cells in PBMC isolated from mouse:3 day after re-challenge, WT group compared to RIPK3-/- group. *: P<0.05.
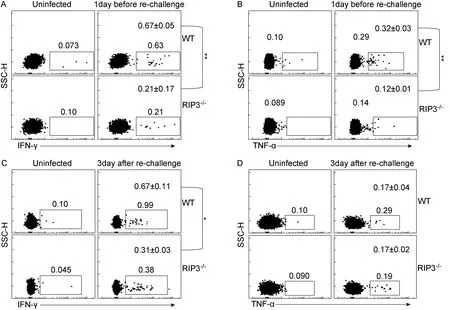
A: IFN-γ of PR8-specific CD8+ T cells: 1 day before re-challenge, WT group compared to RIPK3-/- group. **: P<0.01. B: TNF-α of PR8-specific CD8+ T cells: 1 day before re-challenge, WT group compared to RIPK3-/- group. **: P<0.01. C: IFN-γ of PR8-specific CD8+ T cells: 3 days after re-challenge, WT group compared to RIPK3-/- group. *: P<0.05. D: TNF-α of PR8-specific CD8+ T cells: 3 days after re-challenge, WT group compared to RIPK3-/- group, P>0.05.
2.3 RIPK3敲除可导致小鼠流感病毒特异CD8+ T细胞再次应答过程中 TCM 转化成 TEff 或 TEM 能力减弱
为观察小鼠再次感染后外周血CD8+T细胞的记忆/效应表型,根据表面分子CD44、CD62L将特异性CD8+T细胞亚群进行区分(图3A)。在再次感染后第3天检测活化的 CD8+T 细胞记忆性细胞表型后发现,WT小鼠TEM的比例显著高于RIPK3-/-小鼠〔分别为(15.90±4.25)%和(7.74±1.51)%,P<0.05〕(图3B);而WT小鼠外周血淋巴细胞中记忆性CD8+T 细胞亚群TCM比例显著低于RIPK3-/-小鼠〔分别为6.90±0.65)%和14.55±0.78%,P<0.01〕(图3B);WT小鼠和RIPK3-/-小鼠的TN无统计学差异〔分别为(54.93±5.22)%和(63.02±2.65)%,P>0.05〕(图3B)。该结果提示小鼠在再次感染流感病毒PR8后, RIPK3分子的缺失可能使TCM转化成TEff/TEM的能力下降。

A: Analyses of mouse memory CD8+ T cell subsets by FACS. B: The third day after re-challenge, WT group compared to RIPK3-/- group. TEM*: P<0.05, TCM **: P<0.01.
3 讨论
免疫记忆是一种极为重要的生命现象,是获得性免疫的重要组成部分,也是疫苗能否有效的关键。人体在感染流感病毒后,免疫系统会通过树突细胞或巨噬细胞等抗原呈递细胞来激活流感病毒抗原特异性CD8+T细胞,后者可杀伤被病毒感染的呼吸道上皮细胞和肺实质细胞,最终清除病毒[11-13]。而在病毒清除后,有5%~10%的效应细胞可以作为记忆性CD8+T细胞长期存活。当发生继发性流感病毒感染时,这些细胞能够快速活化发挥高效特异的抗病毒作用[14-15]。但抗原特异性CD8+T细胞免疫记忆形成和维持的分子机制至今尚未完全阐明。
RIPK3是细胞程序性死亡的关键分子,但在CD8+T细胞活化和记忆中的作用缺乏研究。本课题组前期工作表明,在感染流感病毒PR8后,流感抗原特异的效应性CD8+T细胞的生成和功能都一定程度依赖于RIPK3分子[10]。本研究继续探索了RIPK3分子在流感抗原特异的记忆性CD8+T细胞形成及再次遭遇抗原记忆应答中发挥的作用。结果发现,C57BL/6小鼠在初次感染流感病毒5周后,小鼠体内仍存在一定数量的NP抗原特异性CD8+T细胞,表明感染流感后小鼠CD8+T细胞能形成记忆效应(图1A)。但在RIPK3敲除小鼠体内抗原特异性CD8+T细胞数量显著低于野生型小鼠(图1)。通过这些T细胞对流感NP 和PA肽段刺激的应答,发现记忆阶段的野生型小鼠中CD8+T细胞分泌细胞因子IFN-γ和TNF-α的能力显著高于RIPK3敲除鼠(图2A、2B)。这一结果说明RIPK3在抗原特异的记忆性CD8+T细胞形成中发挥重要作用。
本文进一步研究了C57BL/6小鼠特异性CD8+T细胞对流感病毒再次感染的记忆应答情况。C57BL/6小鼠在再次感染流感病毒后第3天均检测到较初次感染更多的NP抗原特异性CD8+T细胞及更高比例的IFN-γ表达细胞(图2C);但RIPK3敲除小鼠体内抗原特异的记忆性CD8+T细胞数量及其记忆性应答表达IFN-γ的能力仍然显著低于野生型小鼠(图2C)。说明RIPK3在抗原特异的记忆性CD8+T细胞的再次应答功能中依旧发挥重要作用。
当流感病毒感染宿主后,天然CD8+T 细胞(TN)可诱生出抗原特异的效应性CD8+T细胞,并进而可分化为记忆性CD8+T细胞,后者可分为TCM和TEM亚群[9]。当再次被感染时,TEM可快速活化成TEff,迁徙至外周感染部位,发挥抗病毒记忆应答作用,起到快速执行效应功能的作用;而TCM则归巢至次级淋巴器官的T细胞区,几乎不发挥效应性功能,但能稳定增殖[9]。与天然T细胞相比,TCM对抗原刺激更加敏感,在抗原刺激增殖后可分化为效应细胞TEff,产生大量IFN-γ等效应细胞因子[9],还可以在一定程度上分化成TEM[16],而两者的差异则显示出免疫记忆的高度复杂性。对流感抗原特异的记忆性CD8+T细胞TCM和TEM亚群分析发现,病毒再次攻击时RIPK3敲除小鼠体内TEM比例显著低于对照,而TCM比例显著高于对照(图3B)。TCM主要分布在淋巴结和扁桃体等次级淋巴器官,而TEM主要在肺、肝和肠等外周组织,在外周血中TCM和TEM的相对比例是变化的。有研究报道TN、TCM和TEM之间可以存在一定的转化关系[17],TCM可以在一定程度上分化为TEM或TEff,而TEM则只能分化成TEff[11]。本研究并未发现RIPK3敲除对TN有影响,而TCM和TEM则出现一升一降的改变(图3)。推测可能是病毒再次感染小鼠时,缺失RIPK3分子可能使得TCM转化成为TEff/TEM的能力下降,从而TCM相对更高,而TEff/TEM比例降低。
综上所述,本研究初步探讨了RIPK3参与调节流感抗原特异的记忆性CD8+T细胞生成数量及分泌IFN-γ细胞因子的能力,发现RIPK3能够调节流感病毒再次感染后TCM和TEM/TEff的比例。但该结果基于在基因敲除小鼠中观察到的RIPK3参与调控记忆性CD8+T细胞的现象,尚无法甄别是由于CD8+T细胞本身缺失RIPK3分子导致的还是由于其他辅助细胞如抗原呈递细胞中RIPK3的缺失导致的。拟在条件性敲除小鼠及过继性转移等实验中做进一步的深入探索。
