类鼻疽伯克霍尔德菌感染与免疫逃逸机制的研究进展
2020-09-03李倩毛旭虎
李倩,毛旭虎
陆军军医大学药学与检验医学系临床微生物与免疫学教研室, 重庆 400038
类鼻疽是由类鼻疽伯克霍尔德菌(Burkholderiapseudomallei,B.pseudomallei)(简称类鼻疽菌)感染引起的一种热带医学疾病。该病在东南亚和澳洲北部流行分布,我国海南、广东、香港、台湾等地为主要疫源地。其临床表现复杂多样,严重感染时可快速发展为败血症,病死率高达40%,每年有超过 9万人死于该病,且越来越多的证据,它是一种正在扩散的人兽共患传染病[1-2]。近年来,随着国际交流和合作日趋频繁,我国面临的类鼻疽危害日趋严峻,特别是“一带一路”的建设、海南国际旅游岛的开发以及南海海洋利益维护和主权安全保障已上升至国家战略,迫切需要寻找针对该病的有效临床诊疗和防控策略[3],这有赖于了解类鼻疽菌的致病机制。然而当前对类鼻疽菌分子致病机制的认识尚不透彻,尤其是类鼻疽菌如何逃逸宿主免疫清除的。为有助于人们更好认识类鼻疽菌,本文就近年来类鼻疽菌感染免疫相关研究的主要成果做一概述。
1 类鼻疽菌的重要毒力因子
类鼻疽菌作为一种土壤腐生革兰阴性短杆菌,是一种机会性、兼性胞内寄生菌。虽然目前其具体致病机制尚未明确,但近年来研究显示,该菌具有显著的内在毒力因子和广泛的抗生素耐药性,这一特性使其适应能力增强,能根据受感染组织产生各种临床表现,并在受感染的宿主和环境中持续存在。因此,关于类鼻疽菌重要毒力因子的致病机制研究是目前人们关注的热点[4]。
类鼻疽菌在感染过程中需将毒力蛋白注入宿主细胞内,干扰细胞生理进程而逃避宿主免疫应答,为此细菌进化出多种复杂而精细的分泌系统以适应这种需求。类鼻疽菌的毒力主要体现在能入侵宿主天然免疫细胞,逃离吞噬体囊泡并在胞内存活和增殖,最终导致细胞融合而造成细菌播散[5-6]。类鼻疽菌侵入宿主细胞后,通过表达一系列的毒力相关因子,完成逃离囊泡和诱导细胞融合过程。有研究认为,Ⅲ型分泌系统(type Ⅲ secretion system, T3SS)和Ⅵ型分泌系统(type Ⅵ secretion system, T6SS)是类鼻疽菌胞内生存过程中最关键的2个毒力相关因子[4-5]。
1.1 T3SS对类鼻疽菌逃离囊泡至关重要
T3SS是许多革兰阴性菌的重要毒力因子,又称 “注射器装置”,即由多种蛋白分子复合体所构成的跨膜蛋白输出装置,可将细菌胞内的分泌蛋白直接注入宿主细胞内,发挥调控宿主多种信号通路的作用,如诱导细胞骨架重排、干扰宿主免疫应答、抑制细胞凋亡和干扰囊泡运输,最终改变宿主环境而有利于细菌生存和增殖。类鼻疽菌共有3套T3SS,分别是T3SS-1(BPSS1390-1408)、T3SS-2(BPSS1613-1629)和T3SS-3(BPSS1520-1554),只有T3SS-3对细菌在真核宿主胞内生存和毒力发挥起重要作用[7]。类鼻疽菌T3SS-3由35个开放读码框构成,根据所编码的蛋白功能可分为5类:装置蛋白(apparatus proteins)、转位蛋白(translocon proteins)、效应分子(effector proteins)、分子伴侣(chaperones)和调控蛋白(regulator proteins)。近年来研究显示,缺失T3SS-3蛋白BopA[8]、BsaQ[9]、BopE[10]和BipD[11]的类鼻疽菌逃逸囊泡的能力减弱,但这些效应分子介导囊泡逃逸的分子机制仍不清楚。T3SS-3中是否还存在其他未被发现的效应分子而在逃逸过程中发挥作用仍需深入研究。
1.2 T6SS促进类鼻疽菌在细胞间的播散
特别指出的是,在感染后期类鼻疽菌能诱导感染细胞与周围细胞相互融合,形成一种称之为多核巨细胞(multi-nucleated giant cells,MNGC)典型的细胞病理改变[12]。其特征表现为由多个单核细胞融合,体积较大,细胞核多,数目可达10~50个,核的排列缺乏规律。类鼻疽菌诱导的MNGC可帮助细菌播散,使其在胞内获得更大的生存空间和更多的营养物质,同时还能逃避胞外宿主的免疫清除及抗生素杀伤,最终导致宿主致病,因此MNGC与类鼻疽菌的致病性密切相关。类鼻疽菌T6SS共有6套,分别是:T6SS-1(BPSS1490-BPSS1514)、T6SS-2(BPSS0515-BPSS0533)、T6SS-3(BPSS2090-BPSS2109)、T6SS-4(BPSS0166-BPSS0185)、T6SS-5(BPSS0091-BPSS0117)和T6SS-6(BPSL3096-BPSL3111)[13]。目前研究发现T6SS-1和T6SS-5具有诱导细胞融合的功能,同时在动物感染模型中发挥重要的毒力作用。T6SS分泌方式可比作细菌的弓箭,由膜-底座复合体和外鞘组成弓,将由溶血素共调节蛋白(haemolysin co-regulated protein, Hcp)组成的箭体和缬氨酸甘氨酸重复蛋白G(valine glycine repeat G, VgrG)组成的箭头在几毫秒内射入宿主细胞。研究发现,类鼻疽菌缺失Hcp和VgrG后,丧失了诱导细胞融合的能力,胞内生存受限,并在小鼠动物模型中毒力明显减弱,但其具体的分子机制仍有待进一步的研究[14-15]。
2 类鼻疽菌的感染与免疫逃逸
病原菌与宿主的相互作用是决定其感染和发病的前提。类鼻疽菌作为一种胞内感染病原,为实现在宿主细胞内生存、达到感染和致病目的,有效逃逸宿主细胞免疫清除成为双方斗争的焦点(图1)。同时,类鼻疽菌作为一种典型的胞内模式菌,其具体致病机制的阐明将对其他胞内菌的研究具有重要借鉴意义。
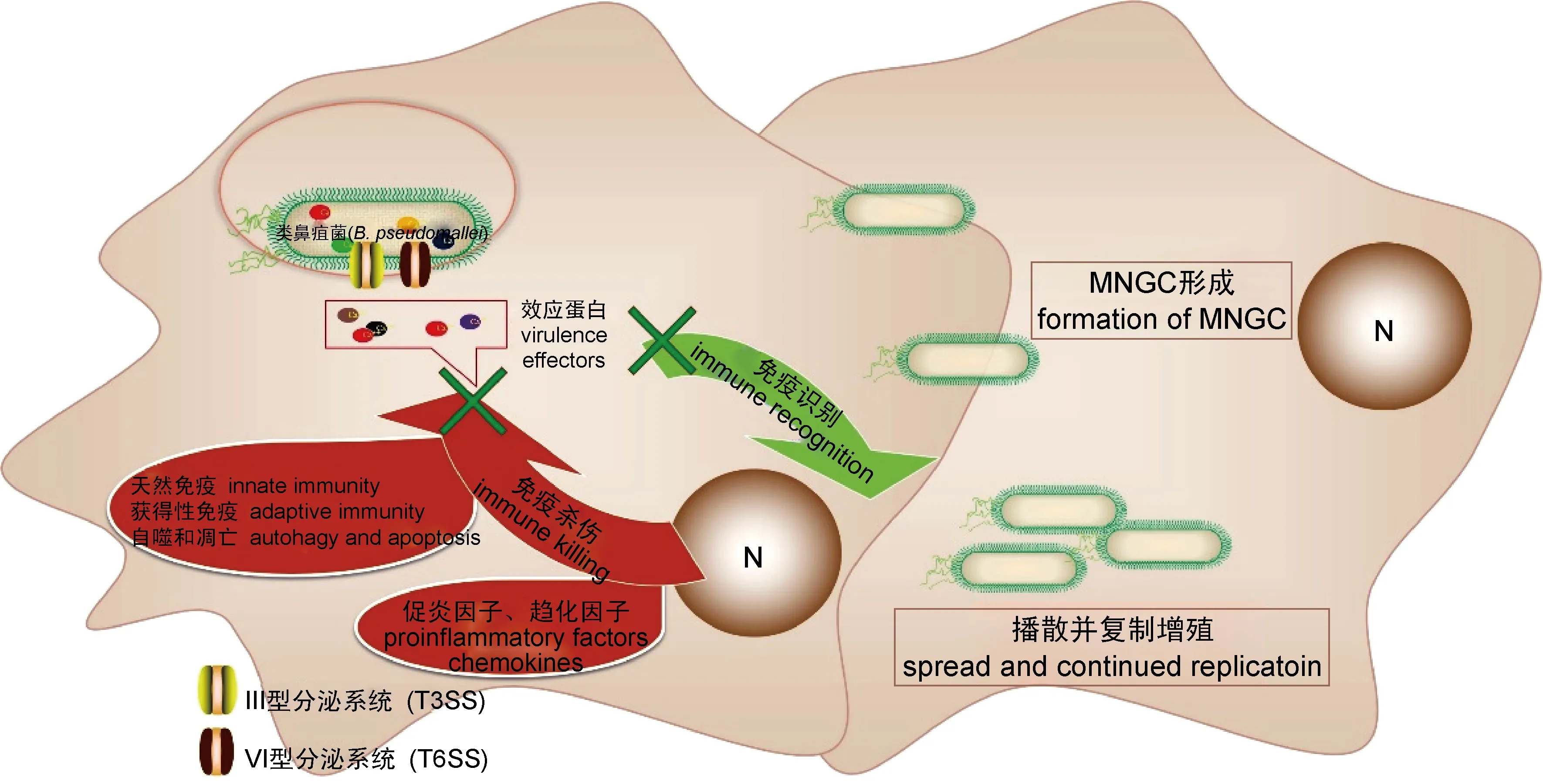
图1 类鼻疽菌逃避宿主免疫的机制示意图
2.1 增加对宿主细胞的黏附和入侵
类鼻疽菌有效入侵宿主细胞是建立感染的第1步,研究显示,类鼻疽菌可以主动或被动的方式侵入多种吞噬细胞(如多形核细胞、巨噬细胞等)或非吞噬细胞(如HeLa细胞、A549细胞、中国仓鼠卵巢细胞等),而在这一过程中类鼻疽菌的多种结构或毒力因子参与调控[1,6]。 Essex-Lopresti等研究发现Ⅳ型菌毛结构蛋白PilA在类鼻疽菌有效黏附上皮细胞中起作用[16]。除此之外,细菌的分泌系统也发挥重要调控功能。Balder等发现,在大肠埃希菌中重组表达类鼻疽菌黏附蛋白BoaA和BoaB能明显增加大肠埃希菌对肺上皮A549细胞的黏附作用,而敲除BoaA或BoaB后类鼻疽菌对小鼠巨噬细胞J774A.1的黏附能力大大下降[17];T3SS效应蛋白BopE通过对宿主细胞的Rho GTP酶进行鸟苷酸交换因子(guanine nucleotide exchange factors, GEFs)催化作用,诱导宿主细胞肌动蛋白重排,从而帮助细菌入侵[10]。
2.2 逃避宿主细胞天然免疫的清除作用
天然免疫作为人体抵御病原微生物侵袭的第1道防线,在抗感染中发挥至关重要的作用。自噬(autophgay)作为天然免疫中重要的组成部分,同时也作为机体自我保护的生理学行为,在抗病原微生物感染及其导致的炎症中发挥关键作用。在非吞噬细胞模型中, Li等研究发现,类鼻疽菌感染肺上皮A549细胞后,通过表观遗传修饰诱导多个miRNA协同干扰宿主细胞自噬相关蛋白ATG10的表达,从而介导其逃避宿主的自噬清除[18-19]。唐梦灵的研究发现,类鼻疽菌通过劫持宿主脂质代谢抑制脂噬,逃逸宿主免疫清除[20]。在天然免疫系统重要成员的巨噬细胞模型中,类鼻疽菌逃逸宿主胞内免疫清除的具体机制得到了多方面的揭示。Toll样受体(toll like receptors,TLR)作为巨噬细胞表面的经典模式识别受体,能识别保守的病原体相关分子模式(pathogen-associated molecular patterns, PAMP),并通过各种信号转导分子介导炎症免疫应答。而TLR(尤其是TLR4和TLR5)的遗传多态性,与类鼻疽患者的疾病严重程度密切相关[21-22]。有研究显示,类鼻疽菌可通过对自身脂多糖(lipopolysaccharide,LPS)结构进行4-氨基-4-脱氧阿拉伯糖(4-amino-4-deoxy-arabinose, Ara4N)修饰,抑制TLR信号通路的激活,从而干扰宿主细胞的免疫应答[23]。为防止细菌入侵,巨噬细胞通过吞噬作用摄取细菌,形成包裹细菌的吞噬囊泡,随后吞噬囊泡逐渐成熟酸化,并转运至溶酶体形成吞噬溶酶体,从而杀灭细菌。Hu等研究发现在类鼻疽菌感染小鼠巨噬细胞RAW264.7模型中,类鼻疽菌通过上调miR-30b/c的表达干扰宿主细胞的Rab32分子向吞噬囊泡的招募,抑制吞噬囊泡与溶酶体融合[24]。同样,Cullinane等研究也发现,类鼻疽菌通过T3SS-3效应蛋白BopA抑制自噬相关蛋白LC3的招募,帮助其逃逸吞噬囊泡,从而干扰宿主细胞的清除能力,但具体调控机制尚未阐明[25]。另外,类鼻疽菌T3SS-3效应蛋白BsaZ、BsaQ、BsaU也参与了囊泡的逃逸[9,26]。类鼻疽菌利用多种手段逃避溶酶体的杀伤,但活化的宿主巨噬细胞可形成呼吸爆发,生成大量代谢性自由基,借助强氧化和细胞毒作用对类鼻疽菌进行清除[27]。还有研究发现,类鼻疽菌可抑制诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、活性氧(reactive oxygen species,ROS)、O2-等抗菌活化物的毒性作用。Utaisincharoen等报道,类鼻疽菌诱导负向调节因子SOCS3(suppressor of cytokine signalling 3)和CIS(cytokine-inducible SH2-containing protein)的表达,抑制宿主细胞诱导型一氧化氮(induced nitric oxide,iNO)的产生,从而逃逸免疫杀伤作用[28-29]。而近年来T6SS-5在类鼻疽菌逃逸至胞质后诱导MNGC形成中的作用机制逐渐得到了揭示[30]。研究发现,该菌依赖T6SS-5分泌的效应蛋白VgrG-5、BPSS1504,参与MNGC的形成,对感染后期细菌在宿主细胞间的播散起到重要调控作用[14,31]。
2.3 干扰宿主细胞获得性免疫的激活
目前,宿主获得性免疫在清除类鼻疽菌中的作用鲜见相关研究。据报道,在泰国类鼻疽患者中,人类白细胞抗原(human leukocyte antigen,HLA)与疾病严重程度密切相关[32-33]。临床病例研究显示,CD4+和CD8+T细胞在类鼻疽患者急性感染期间出现强烈反应;若患者合并糖尿病,则会影响CD4+和CD8+T细胞的反应,而较低的反应与较高的病死率相关,提示T细胞免疫在抗类鼻疽菌感染中具有重要作用[34-36]。See等发现,类鼻疽菌可上调T细胞对程序性死亡受体-1(programmed death receptor-1,PD-1)的表达,从而逃避宿主的免疫清除[37]。
3 类鼻疽菌的疫苗研究
由于类鼻疽菌属于胞内感染病原菌,且该菌逃逸宿主免疫清除的机制还尚未阐明,因此疫苗研究仍处于探索阶段[1,38]。直至目前,类鼻疽菌多种形式的疫苗(如全菌体灭活疫苗、减毒活疫苗、亚单位疫苗、多糖结合疫苗等)以及疫苗佐剂已有研究报道,然而相关报道均停留在临床前阶段,且大多数疫苗候选抗原无法诱导完全的保护性免疫应答 (只能在短时间内提高受试动物的生存率),也无法彻底清除在体内定植的类鼻疽菌[39-40]。因此,类鼻疽菌疫苗的研制还有待其致病机制研究的不断深入和疫苗技术的不断发展,期待将来能研发出预防类鼻疽菌感染的有效疫苗。
4 展望
本文阐述了近年来类鼻疽菌的重要毒力因子及其在免疫逃逸中作用机制的研究进展。在类鼻疽菌感染过程中,宿主免疫系统与类鼻疽菌的相互作用十分复杂,类鼻疽菌特殊的分泌系统及胞内免疫逃逸机制在其致病过程中发挥至关重要作用,而目前对于该菌感染及其免疫逃逸机制的研究尚处于不明确阶段。因此,阐明类鼻疽菌重要毒力因子的致病机制,将有助于理解类鼻疽菌在面对免疫系统的监视和清除中长期存活的机制,并将有望对类鼻疽的预防和治疗措施的改善产生更大的推动作用,为开发出有效的疫苗和药物提供理论指导,为解决类鼻疽这个棘手的临床疾病带来新的希望。
