一个镉配位聚合物对Fe3+的识别
2020-09-01任创伟丁瑞龙刘保彤彭艳芬
任创伟,丁瑞龙,刘保彤,彭艳芬
(池州学院 材料与环境工程学院 微纳粉体与先进能源材料安徽普通高校重点实验室,安徽 池州 247000)
多年来,如何快速有效地识别和检测出影响食品安全的物质如三聚氰胺、罗丹明B等,以及一些重金属离子Hg2+,Pb2+等成为亟待解决的问题。以有机化合物作为荧光探针识别金属离子或无机阴离子的研究由来已久[1]。例如,三嗪类大环可以与一些阴离子(F-)或金属离子(Cu2+)络合从而对其进行选择性识别,还可以对一些有机小分子进行识别。Volker课题组[2]合成了一类大环化合物,并通过核磁滴定的方法证明了此类化合物对F-离子有很好的识别作用。2008年Koide等人[3]设计合成了一种Hg2+荧光传感器,研究发现在水中,该受体分子对Hg2+有着荧光识别效果。
近二十年来,配位聚合物(coordination polymers,CPs)或者金属有机框架化合物(metal organic frameworks,MOFs)的设计、合成和性质性能的研究一直是广大化学工作者的一个重要研究领域,这是因为配位聚合物不仅具奇秒的拓扑结构,更是因为它具有独特的性质性能,如:磁性、荧光、离子交换和催化[4]等。由于离子在环境和生物系统中的广泛存在,定向合成具有离子识别功能的MOFs材料也成为配位化学研究者关注焦点[5],而且CPs或MOFs在分子或离子的识别与检测方面也展现出其独特的魅力。例如,2013年,吉林大学的施展课题组[6]合成了一系列镧系金属有机框架,其中金属铕配合物对Zn2+有明显的荧光增强现象,而对Fe3+有明显的荧光猝灭现象。同年,福建物构所的曹荣课题组[7]合成了一个新的多孔MOF薄膜。该薄膜能把甲醇和吡啶从其他溶剂中快速的识别出来。2015年Amitava Das课题组[8]合成铼配合物fac-[Re(CO)3Cl(L)] (L = 4-([2,2-二吡啶]-4-yl)苯),该配合物能识别出F-。
综上所述,本文以一个镉配位聚合物作为荧光探针,对14种常见的金属离子进行检测,结果发现,该镉配位聚合物能选择性识别Fe3+。
1 实验部分
1.1 试剂与仪器
Fe(NO3)3、KNO3、Al(NO3)3、Co(NO3)2、Ni(NO3)2、Pb(NO3)2、Mg(NO3)2、Ba(NO3)2、Cd(NO3)2、Ca(NO3)2、Cu(NO3)2、Ni(NO3)2、Zn(NO3)2、Mg(NO3)2、甲醇、乙醇、丙酮、N,N-二甲基甲酰胺(DMF)均为分析纯,使用前没有进一步纯化。配合物{[Cd(L1)(1,3-bdc)(H2O)2][Cd(1,3-bdc)(H2O)3]·2H2O} (1)。
KH-100DB型超声仪、D/MAX-3C型粉末衍射仪、RF-5301PC型荧光光谱仪。
1.2 配合物1的合成和纯度分析
参照文献[9]合成配合物1,取少量配合物1在室温下测其粉末衍射,并与配合物1的模拟的粉末衍射谱图进行比对。
1.3 荧光光谱的测定
准确称取5份3.0 mg 配合物1分别置于5 mL干洁试的剂瓶中,分别向其中加入3.00 mL的蒸馏水、甲醇、乙醇、丙酮和DMF。超声1 h后静置24 h,测其荧光光谱。
准确称取50 mg配合物1置于50 mL容量瓶中,用DMF定容至刻度。超声1 h后静置,作为荧光探针。配合物1的DMF溶液的浓度为1 mg/mL。各种金属盐分别用蒸馏水配成0.02 mol/L。取200 uL的配合物1的DMF溶液于荧光样品池中,用DMF稀释至2 mL,再分别加入不同的金属离子溶液,摇匀,测定其荧光发射光谱。
测试条件:室温,样品池为1 cm×1 cm×4.5 cm石英比色皿,激发狭缝宽度5 nm,发射狭缝宽度3 nm,最大激发波长为294 nm。
2 结果与讨论
2.1 配合物1的粉末衍射图和荧光分析
由图1所示,配合物1的粉末衍射的实验图谱和模拟图谱吻合很好,这表明参照文献方法合成的1纯度很高。

图1 配合物1的粉末衍射图
配合物1在五种溶剂(蒸馏水、丙酮、甲醇、乙醇和DMF)中的荧光光谱图(图2)显示,在DMF溶剂中具有最强的荧光发射,λem,max= 358 nm,可能是因为配合物1在DMF中的溶解度最大,因此本实验选择以DMF作为荧光探针的稀释剂。
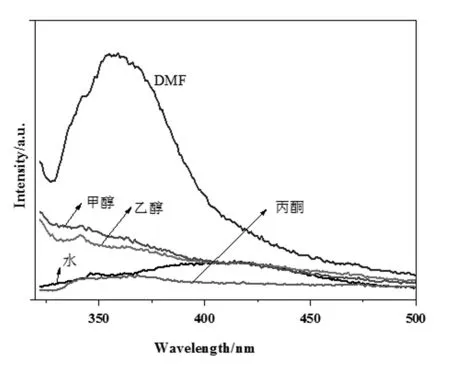
图2 配合物1在不同溶剂中的荧光光谱图
2.2 对14种金属离子的识别
对14种金属离子进行识别,图3是所有金属离子的加入量为均为0.18 μmol时(即[Mn+]=9.0×10-5mol/L)的配合物1的荧光光谱图,其中加入Ag+、Zn2+、Pb2+、Ni2+、K+、Hg2+后配合物1的荧光基本没有变化,加入Mg2+、Co2+、Cd2+、Ca2+、Ba2+和Al3+这六种金属离子后配合物1的荧光强度降低不明显。只有等量的Fe3+使配合物1的荧光强度明显降低。
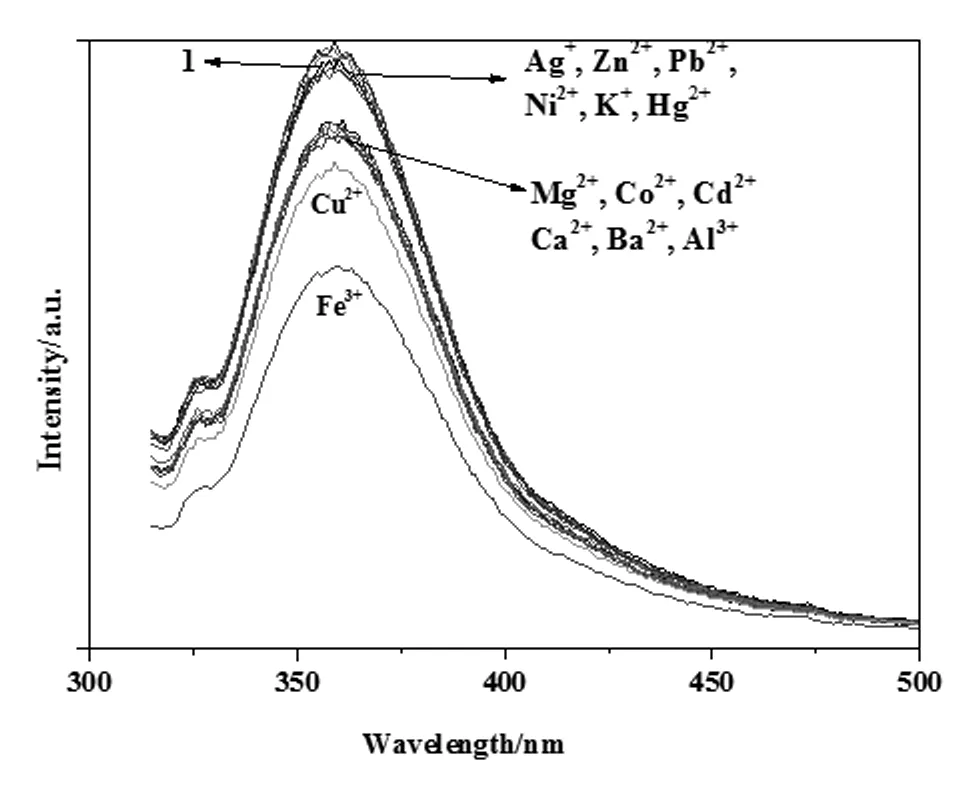
图3 配合物1对不同金属离子的选择性
2.3 其他13种金属离子对Fe3+的干扰检测
如图4所示,蓝色柱表示Fe3+加入量为0.1 μmol时配合物1的荧光强度,绿色柱表示再加入1.0 μmol其他金属离子后配合物1的荧光强度。其结果表明当其他金属离子的浓度10倍于Fe3+时,只有Cu2+对其干扰最大,其他金属离子的干扰不大。从图1也可以看出除了Fe3+外,Cu2+对配合物1的荧光强度影响最大。

图4 其他金属离子和Fe3+共存时配合物1的荧光强度变化
2.4 配合物1的荧光强度与Fe3+浓度的线性关系
如图5所示,随着Fe3+的加入,配合物1在358 nm处的荧光强度在不断下降,当Fe3+的加入量达到0.4 μmol时,配合物1的荧光几乎猝灭了。当Fe3+的浓度在1.0×10-5~10×10-5mol/L范围时,配合物1荧光强度与Fe3+浓度有较好的线性关系(图6)。其线性方程为I = 523.37-30.80 c(Fe3+),R2= 0.9938。
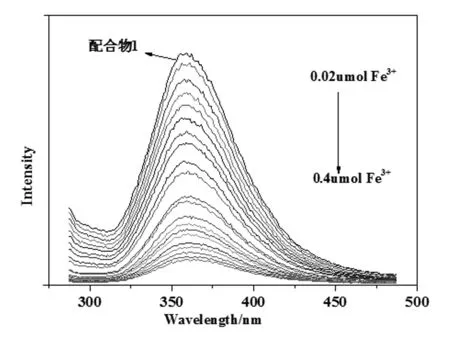
图5 随着Fe3+浓度增大,配合物1的荧光强度变化图

图6 配合物1的荧光强度随Fe3+浓度的线性关系
3 结论
以一个镉配位聚合物1作为荧光探针,对14种金属离子进行识别检测,结果表明,Fe3+能显著降低配合物1的荧光强度。配合物1的荧光强度与浓度在1.0×10-5~10.0×10-5mol/L范围Fe3+有较好的线性关系,R2=0.9938。
