基于UPLC指纹图谱的厚朴药材去粗皮质量评价研究
2020-08-27李燕珍鲁云陈丹燕
李燕珍 鲁云 陈丹燕
[摘要] 目的 研究厚朴药材、去粗皮厚朴与厚朴粗皮主成分的含量和指纹图谱差异,为厚朴药材去粗皮入药提供依据。 方法 采用Waters Acquity UPLC BEH-C18色谱柱(50 mm×2.1 mm,1.7 μm),以乙腈-0.2%磷酸溶液为流动相,梯度洗脱,流速0.4 mL/min,柱温35℃,检测波长230 nm。对不同产地厚朴药材、去粗皮厚朴与厚朴粗皮进行厚朴酚、和厚朴酚的含量测定,对比其共有峰的峰面积,并进行相似度分析。 结果 厚朴酚、和厚朴酚的总含量均为去粗皮厚朴>厚朴药材>厚朴粗皮;去粗皮厚朴6个共有峰的峰面积均比厚朴药材、厚朴粗皮的峰面积高。结论 厚朴去粗皮可提高厚朴饮片的质量,为厚朴去粗皮提供实验参考依据。
[关键词] 厚朴药材;去粗皮厚朴;厚朴粗皮;指纹图谱;相似度
[中图分类号] R282 [文献标识码] A [文章编号] 1673-7210(2020)07(a)-0027-04
[Abstract] Objective To study the content of main components and fingerprint differences of officinal magnolia bark, removing rough bark of officinal magnolia bark, rough bark of officinal magnolia bark, and provide evidence for the used as medicine of removing rough bark of officinal magnolia bark. Methods Waters Acquity UPLC BEH-C18 column (50 mm×2.1 mm, 1.7 μm) was used as the column. Acetonitrile-0.2% phosphoric acid solution was used as mobile phase for gradient elution. The flow rate was 0.4 mL/min, column temperature was 35℃, and the detection wavelength was 230 nm. The contents of magnolol and honokiol were determined for officinal magnolia bark from different areas, removing rough bark of officinal magnolia bark, rough bark of officinal magnolia bark. The peak area of the common peak was compared, and the similarity was analyzed. Results The total contents of magnolol and honokiol was removing rough bark of officinal magnolia bark>officinal magnolia bark>rough bark of officinal magnolia bark. The peak area of 6 common peaks of removing rough bark of officinal magnolia bark was higher than that of officinal magnolia bark and rough bark of officinal magnolia bark. Conclusion It can improve the quality of officinal magnolia bark pieces and provide experimental reference for removing rough bark of officinal magnolia bark.
[Key words] Officinal magnolia bark; Removing rough bark of officinal magnolia bark; Rough bark of officinal magnolia bark; Fingerprint; Similarity
厚樸始载于《神农本草经》[1],为木兰科植物厚朴Officinal magnolia bark或凹叶厚朴Magnolia officinalis Rehd. et Wils. var. biloba Rehd. et Wils.的干燥干皮、根皮及枝皮。厚朴具有燥湿消痰、下气除满的功效[2]。厚朴产于湖北、四川等地,习称“川朴”,凹叶厚朴主要分布在浙江、福建、湖南南部等地,商品习称“温朴”[3]。相关文献报道[4-5]厚朴的主要化学成分有木脂素类、苯乙醇苷类、生物碱类以及挥发油等。现代药理证明,厚朴具有抗菌、抗炎、抗肿瘤、抗氧化等多种药理作用[6-7]。传统加工炮制过程中,皮类饮片多需除去外表粗皮,历代古籍皆有记载,如《本草纲目》记载“凡入药去粗皮”[8]。宋代《太平惠民和剂局方》亦云“凡使,先刮去粗皮,令见赤心”[9],明代《医学入门》载“……如不去皮,耗人元气”[10]。《中华人民共和国药典》[11]2015年版一部厚朴饮片炮制项下也规定:厚朴需刮去粗皮。现代生产则简化工序,多不去皮。厚朴作为常用大宗药材,需求量很大,因此对厚朴饮片的质量控制尤为重要。目前,关于厚朴去粗皮化学成分的研究多集中在厚朴酚与和厚朴酚的含量变化上[12-14],未见对其他成分影响的报道。本研究通过测定厚朴药材、去粗皮厚朴及厚朴粗皮的厚朴酚、和厚朴酚的含量与指纹图谱,对厚朴去粗皮前后成分进行进一步研究,为保证药效及用药的安全性,保证厚朴药用的科学合理性提供参考依据。
1 仪器与材料
1.1 仪器
Waters H-class超高效液相色谱仪、TUV检测器、Empower工作站(沃特世公司);Milli-QDirect超纯水系统(默克股份有限公司);ME204E型万分之一天平(METTLER TOLEDO公司);KQ-500E超声波清洗器(昆山市超声仪器有限公司);ST16高速离心机(赛默飞世尔有限公司)。
1.2 材料
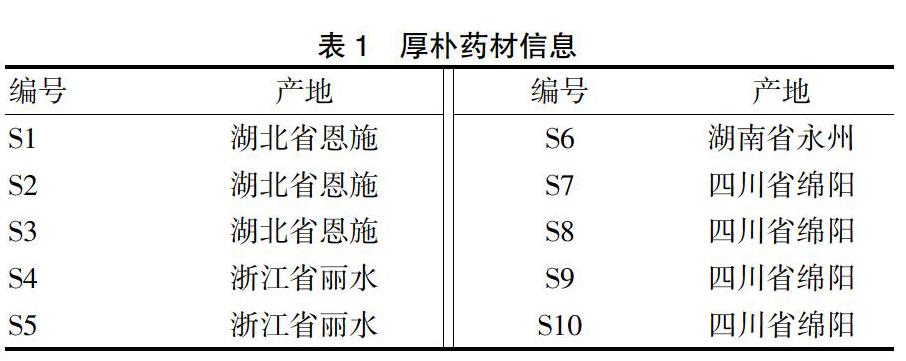
甲醇、乙腈(色谱纯,默克股份有限公司);水(超纯水,默克股份有限公司);厚朴酚对照品(批号:110729-201714,纯度:100%)、和厚朴酚对照品(批号:110730-201614,纯度:99.3%)均购自中国食品药品检定研究院。10批厚朴药材来源信息见表1,经过广东一方制药有限公司魏梅主任中药师鉴定为木兰科植物厚朴Cortex Magnoliae Officinalis。
表1 厚朴药材信息
2 方法与结果
2.1 UPLC指纹图谱研究
2.1.1 色谱条件 色谱柱:Waters Acquity UPLC BEH-C18色谱柱(50 mm×2.1 mm,1.7 μm);流动性:乙腈(A)-0.2%磷酸溶液(B),梯度洗脱(0~2 min,9%~11%A;2~5 min,11%~12%A;5~8 min,12%~15%A;8~10 min,15%~39%A;10~13 min,39%~60%A;13~18 min,60%~65%A;18~24 min,65%~96%A;24~25 min,96%~100%A。柱温:35℃;流速:0.4 mL/min;檢测波长:230 nm[15]。进样量:1 μL。
2.1.2 对照品溶液的制备 取厚朴酚、和厚朴酚对照品适量,精密称定,加甲醇制成每mL含厚朴酚33 μg、和厚朴酚45 μg的混合对照品溶液,即得。
2.1.3 供试品溶液的制备 取厚朴药材、去粗皮厚朴及厚朴粗皮粉末(三号筛)约0.3 g,精密称定,置具塞锥形瓶中,精密加入甲醇25 mL,摇匀,密塞,称定重量,冷浸24 h,称重,用甲醇补足减失的重量,摇匀,13 000 r/min(半径7 cm)离心10 min 后取上清液,经0.22 μm 微孔滤膜,滤过,即得。
2.1.4 专属性试验 取对照品溶液、空白甲醇溶剂及供试品溶液,按“2.1.1”项下色谱条件分别测定。结果显示,空白溶剂在对照品溶液色谱峰相应位置无吸收,空白溶剂无干扰,方法专属性良好。
2.1.5 线性关系考察 精密称取对照品适量,按“2.1.2”项下制成浓度为228.1 μg/mL的厚朴酚、浓度为221.6376 μg/mL的和厚朴酚对照品母液。精密量取对照品母液0.05、0.50、2.70、3.50 mL分别置于5 mL量瓶中,用甲醇稀释至刻度,分别将稀释后不同浓度的对照品溶液以及对照品母液按“2.1.1”项下色谱条件检测,以峰面积为纵坐标(Y),以进样浓度为横坐标(X)绘制标准曲线,并计算回归方程。厚朴酚Y1 = 2.0685X1+1.9423(r1 = 0.9999),浓度范围为2.3~228.1 μg/mL;和厚朴酚Y2 =1.1249X2+1.3829,(r2 = 0.9999),浓度范围为2.216 376~221.637 600 μg/mL。厚朴酚、和厚朴酚在以上浓度范围内进样浓度与峰面积线性关系良好。
2.1.6 加样回收率试验 取已知含量的厚朴药材粉末,精密称定,按对照品加入量与所取供试品中待测定成分量之比0.5∶1、1∶1、1.5∶1加入和厚朴酚与厚朴酚对照品,按“2.1.1”项下色谱条件测定,计算加样回收率,回收率均为94.21%~105.54%,回收率良好。
2.1.7 精密度试验 取厚朴药材粉末约0.3 g,精密称定,按“2.1.3”项下方法制备供试品溶液,按“2.1.1”项下色谱条件进行测定,重复进样6次,记录色谱图。计算各共有峰峰面积的RSD均<0.57%,提示仪器精密度良好。
2.1.8 重复性试验 取厚朴药材粉末约0.3 g,精密称定,平行6份,按“2.1.3”项下方法分别制备供试品溶液,按“2.1.1”项下色谱条件检测,记录色谱图。计算各共有峰峰面积的RSD均<2.48%,提示方法的重复性良好。
2.1.9 稳定性试验 取厚朴药材粉末约0.3 g,精密称定,按“2.1.3”项下方法制备供试品溶液,室温放置,按“2.1.1”项下色谱条件,分别于0、4、8、12、16、20、24 h 进样测定,记录色谱图。计算各共有峰峰面积的RSD均<3.16%,提示供试品溶液在24 h内稳定性良好。
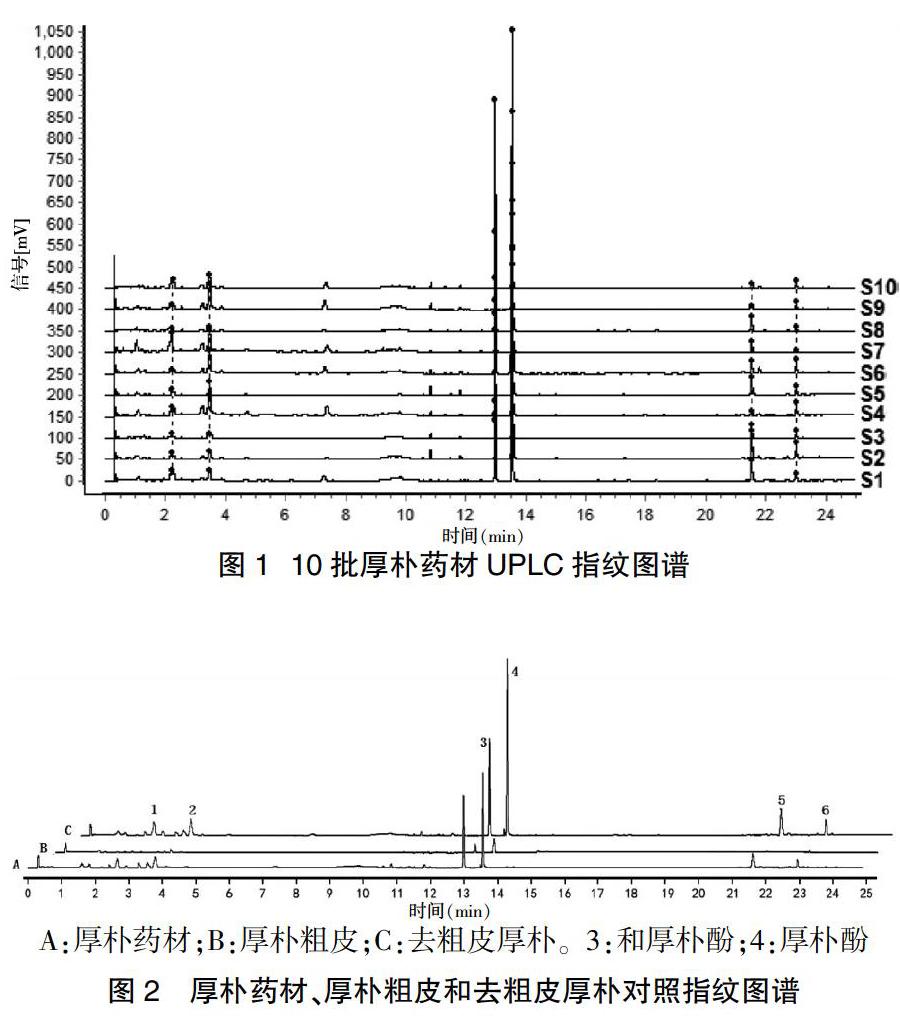
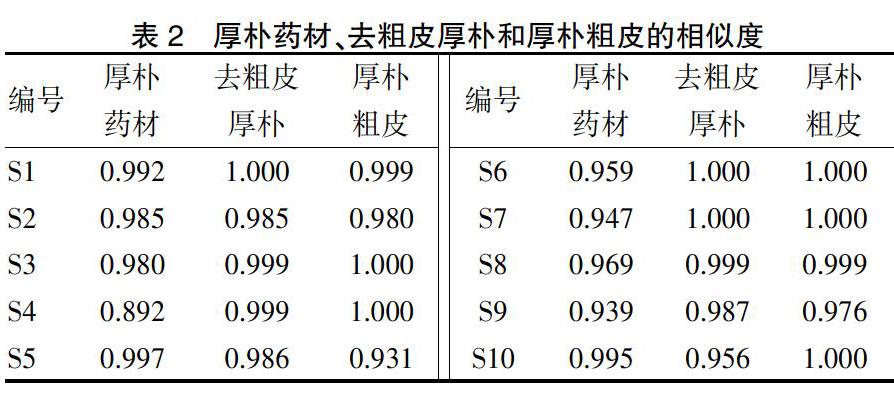
2.1.10 共有峰的确定 取“2.1.3”项下制备的供试品溶液,按“2.1.1”项下色谱条件检测,记录色谱图,分别将其导入国家药典委员会中国色谱指纹图谱相似度评价系统软件(2012版),以S1图谱作为参照,采用中位数法,经多点校正后,进行色谱峰的匹配,生成指纹图谱共有模式,标定共有峰6个。10批厚朴药材指纹图谱共有峰模式见图1,厚朴药材、厚朴粗皮和去粗皮厚朴的对照指纹图谱。见图2。
2.1.11 指纹图谱相似度分析 采用国家药典委员会中药色谱指纹图谱相似度评价系统(2012版),建立共有模式作为对照指纹图谱,将各批厚朴药材指纹图谱与对照指纹图谱比较,计算10批厚朴药材的相似度,其范围为0.849~0.969,提示不同产地的厚朴药材其化学成分受产地、环境等因素的影响存在一定差异。将同一批次厚朴药材、去粗皮厚朴与厚朴粗皮的指纹图谱,建立共有模式作为对照指纹图谱,进行相似度分析,见表2,相似度极高,提示三者间的化学成分在种类上无显著差别。
2.2 厚朴药材、去粗皮厚朴和厚朴粗皮样品中两种酚类成分的含量比较及粗皮比例
10批厚朴药材的粗皮所占比例为5%~10%[粗皮比例(%)=粗皮重量/药材重量×100]。厚朴药材、去粗皮厚朴与厚朴粗皮两种酚类成分分布规律均为去粗皮厚朴>厚朴药材>厚朴粗皮,与文献[12]报道结果一致。去粗皮厚朴两种酚总量的均值约为药材的1.7倍。去粗皮厚朴两种酚总量的均值约为粗皮的19倍。
2.3 指纹图谱共有峰的峰面积比较
比较同一批去粗皮厚朴与厚朴药材的共有峰峰面积,结果见表4。比较同一批去粗皮厚朴与厚朴粗皮的共有峰峰面积,结果见表5。(例:以干燥品计算,供试品中峰1的峰面积=峰1峰面积的实测值/取样量;S1峰1峰面积的比值=去粗皮厚朴峰1的峰面积/厚朴药材峰1的峰面积;峰1峰面积比值的均值=10批峰1峰面积的比值相加/10)。去粗皮厚朴与厚朴药材各共有峰峰面积比值的均值为2.25~5.72。去粗皮厚朴与粗皮各共有峰峰面积比值的均值为5.47~49.47。表4~5结果显示,去粗皮厚朴6个共有峰的峰面积均高于药材、粗皮。
3 讨论
中药包含的成分复杂多样,除了对其主要成分进行含量测定外,还要通过指纹图谱或特征图谱等进行多组分的研究分析,从而更能体现药材质量的整体性[16-20]。实验结果显示,厚朴药材、去粗皮厚朴与厚朴粗皮的化学成分无显著差别,但两种酚类成分含量均存在明显差异,去粗皮厚朴两种酚的含量较药材及粗皮高;特征图谱中,去粗皮厚朴6个共有峰峰面积的比值的均值均高于药材及粗皮。且厚朴外皮有粗糙的木栓层,随着生长年限的延长,厚朴粗皮更为明显[12],有时还附着较多不洁物,远达不到中药饮片的净度要求。厚朴去粗皮不仅可以提高饮片的洁净度,还能提高饮片的质量。提示厚朴去粗皮有一定的科学依据。
目前,關于厚朴去皮问题的现代研究尚缺乏系统性,大多研究仅着手于化学成分、药效学评价等内容[21]。鉴于中药在临床上的疗效是多种成分综合作用的结果,仅从化学成分的角度来确定厚朴是否去粗皮似有不足。尚需从本草考证、化学成分研究、药效学评价、安全性评价和采收加工炮制等方面综合考虑,为厚朴是否去粗皮提供更科学的依据。
[参考文献]
[1] 黄奭.神农本草经[M].北京:中医古籍出版社,1987:212.
[2] 国家药典委员会.中华人民共和国药典[S].一部.北京:中国医药科技出版社,2015:251.
[3] 赵慧.厚朴药材的品质评价研究[D].南京:南京中医药大学,2018:23.
[4] 荆文光,杜杰,王继永,等.厚朴化学成分研究进展[J].中国现代中药,2018,20(6):764-774.
[5] 张淑洁,钟凌云.厚朴化学成分及其现代药理研究进展[J].中药材,2013,36(5):838.
[6] Poivre M,Duez P. Biological Activity and Toxicity of the Chinese Herb Magnolia Officinalis Rehder&E.Wilson (Houpo) and Itsconstituents [J]. J Zhejiang Univ Sci B,2017,18(3):194.
[7] Maioli M,Basoli V,Carta P,et al. Synthesis of magnolol and honokiol derivatives and their effect against hepatocarcinoma cells [J]. PLoS One,2018,13(2):e0192178.
[8] 李时珍.本草纲目(第三册)[M].北京:人民卫生出版社,1979:1983.
[9] 刘景源.太平惠民和剂局方(卷上)[M].北京:人民卫生出版社,2017:371.
[10] 李梴.医学入门[M].北京:中国医药科技出版社,2011:147.
[11] 赖祯,黄国英,杨滨,等.厚朴不同部位本草考证及研究进展[J].亚太传统医药,2019,15(1):69-72.
[12] 袁金凤,朱林峰,彭诗涛,等.从生长年限和入药部位探讨厚朴净制的意义[J].世界科学技术——中医药现代化,2019,21(3):559-563.
[13] 杨红兵,詹亚华,陈科力,等.发汗与去皮对厚朴中酚类成分含量的影响[J].中药材,2007,30(1):22-23.
[14] 王智鹏,胡昌江,帅小翠,等.厚朴“去皮”的净制研究[J].时珍国医国药,2011,22(10):2573-2574.
[15] 荆文光,张权,邓哲,等.指纹图谱、多成分定量与化学计量学相结合的厚朴药材质量评价[J].中国中药杂志,2019,44(5):975-982.
[16] 李瑞雪,吴飞,张继全,等.含量测定结合HPLC指纹图谱用于香加皮质量评价[J].中国医药导报,2017,14(22):33-46.
[17] 陈亮元,程轩轩,唐晓敏,等.指纹图谱、模式识别结合一测多评法在广金钱草质量评价中的应用研究[J].中国中药杂志,2018,43(16):3323-3328.
[18] 肖琳婧,刘莹莹,赵禹,等.HPLC指纹图谱结合化学计量学的不同产地灯盏花药材和近缘种样品的质量评价[J].中草药,2019,50(14):3438-3443.
[19] 俞洁东,曾海松,吴革林,等.脉络通颗粒HPLC指纹图谱研究[J].中国医药导报,2019,16(4):39-42.
[20] 王珂.多维色谱指纹图谱用于海狗人参丸质量控制和非法添加物筛查研究[D].广州:广东药科大学,2018:4-8.
[21] 吴玟萱,刘勇,何元松,等.中国药典中有关中药去皮问题的现状[J].河南中医,2016,36(11):2043-2046.
(收稿日期:2019-11-21)
