多囊卵巢综合征大鼠卵巢中kisspeptin/kiss1r系统的表达及作用研究
2020-08-27刘冉冉骆倩倩孙晓娟
刘冉冉 骆倩倩 孙晓娟

[摘要] 目的 建立多囊卵巢综合征(PCOS)大鼠模型,探讨卵巢组织中kisspeptin/kiss1r系统表达及作用。 方法 孕10 d的Wistar大鼠20只,其雌性后代60只,根据随機数字表法分为PCOS组和正常组,每组30只。PCOS组给予来曲唑和羧甲基纤维素(CMC)连续灌胃21 d,正常组给予等体积的CMC灌胃。造模结束后检测两组大鼠体重参数和血清激素水平;HE染色检测卵巢组织形态学改变;免疫组织化学染色和qRT-PCR检测卵巢组织中kisspeptin和kiss1r的表达。 结果 与正常组比较,PCOS组大鼠的体重、腹膜后脂肪含量、卵巢重量均增加,血清黄体生成素、卵泡刺激素和睾酮水平均升高(P < 0.05或P < 0.01)。与正常组比较,PCOS组大鼠卵巢中kiss1-mRNA表达降低(P < 0.05);两组大鼠卵巢中kiss1r-mRNA表达比较,差异无统计学意义(P > 0.05)。PCOS组大鼠卵巢具有典型的多囊样改变。 结论 PCOS大鼠卵巢可见kisspeptin/kiss1r系统的低表达,可能在PCOS的发生、发展中起重要作用。
[关键词] 多囊卵巢综合征;Kisspeptin/kiss1r系统;卵巢;来曲唑
[中图分类号] R711.75 [文献标识码] A [文章编号] 1673-7210(2020)07(a)-0016-04
[Abstract] Objective To establish a rat model of polycystic ovary syndrome (PCOS) and investigate the expression and function of kisspeptin/kiss1r system in ovarian tissue. Methods Twenty Wistar rats at the 10th day of gestation were divided into PCOS group and normal group according to the random number table method, with 30 rats in each group. In PCOS group, Letrozole and carboxy methyl cellulose (CMC) were administered continuously for 21 days, while in normal group, CMC of equal volume was administered. Body weight parameters and serum hormone levels of two groups were measured after model establishment; the ovarian histomorphology was detected by HE staining; the expression of kisspeptin and kiss1r in the ovarian tissue was detected by immunohistochemistry and qRT-PCR. Results Compared with normal group, the weight, the content of retroperitoneal fat and the weight of ovary in PCOS group were increased, and the levels of serum luteinizing hormone, follicle stimulating hormone and testosterone were increased (P < 0.05 or P < 0.01). Compared with normal group, the expression of kiss1-mRNA in the ovaries of PCOS group was decreased (P < 0.05). There was no significant difference in kiss1r-mRNA expression between two groups (P > 0.05). PCOS group showed typical polycystic changes in ovaries. Conclusion Down-regulation of kisspeptin/kiss1r system in the ovaries of PCOS rats may play an important role in the occurrence and development of PCOS.
[Key words] Polycystic ovarian syndrome; Kisspeptin/kiss1r system; Ovary; Letrozole
多囊卵巢综合征(PCOS)是临床上最常见的内分泌紊乱性疾病,多伴有卵泡发育异常和雄激素增多[1],造成闭经、不育、多毛、肥胖等[2]。由于发病率高,治疗困难,增加肿瘤[3]的发生,PCOS成为重要的研究课题。目前对PCOS病因的研究较多,大多与下丘脑-垂体-性腺轴有关。kisspeptin/kiss1受体(kiss1r)系统是此轴最强有力的影响因素[4]。kisspeptin是由kiss1基因编码的神经肽前体,可以结合并激活其受体kiss1r,并发挥作用。食源性肥胖大鼠下丘脑中的kisspeptin表达减少[5],导致生殖障碍,营养不良、糖尿病等均会引起下丘脑kisspeptin/kiss1r系统的异常表达[6]。在PCOS大鼠中,下丘脑kiss1基因和kisspeptin表达均有显著改变[7-8]。本研究主要探究kisspeptin/kiss1r系统在多囊卵巢中的作用,以了解其发病机制。
1 材料与方法
1.1 材料
Wistar大鼠购自济南朋悦实验动物繁育有限公司,生产许可证号:SCXK(鲁)20190003,实验设计和开展情况符合滨州医学院烟台附屬医院医学伦理委员会的伦理要求。病理图像分析仪(莱卡);Rotor Gene-3000PCR仪(德国QIAGEN);酶联免疫吸附测定(ELISA)试剂盒[上海酶联生物,黄体生成素(LH):002860;卵泡刺激素(FSH):002872;睾酮(T):003368];免疫组织化学染色试剂盒(Bioworld,05100);PCR试剂盒(Roche,11636103001)。
1.2 分组及模型制备
孕10 d的Wistar大鼠20只,产后60只雌鼠按1~60编号,依据随机数字表法分为PCOS组和正常组。PCOS组30只大鼠每日用来曲唑(1 mg/kg)溶于1%的羧甲基纤维素(CMC)溶液连续灌胃21 d;正常组30只大鼠给予等体积的CMC溶液灌胃。造模结束后,大鼠的激素改变、卵巢的典型多囊样与临床PCOS患者一致,表明造模成功。
1.3 动物取材
造模结束后,称重,测身长(鼻尖至肛门的距离),麻醉,心尖部取血,得血清备用;剥离腹膜后脂肪称重;部分大鼠取新鲜卵巢组织;剩余大鼠用多聚甲醛心内灌流固定卵巢组织,备用。
1.4 ELISA检测血清激素水平
按ELISA试剂盒检测血清LH、FSH和T水平。
1.5 苏木精-伊红(HE)染色检测卵巢形态学改变
将多聚甲醛固定后的卵巢,按照步骤,经脱水、透明、包埋、切片、HE染色等一系列过程,观察卵巢的形态学改变。
1.6 免疫组织化学染色检测卵巢中kisspeptin和kiss1r的表达
将石蜡包埋的卵巢组织蜡块,经切片、脱蜡至水。一抗选用兔抗kisspeptin多克隆抗体,兔抗kiss1r多克隆抗体,二抗选用生物素化羊抗兔IgG(1∶200),DAB显色,经脱水、透明、封片、镜检。
1.7 qRT-PCR检测卵巢中kiss1-mRNA和kiss1r-mRNA的表达
新鲜卵巢液氮研磨提取总RNA,逆转录得cDNA。制备β-actin、kiss1和kiss1r引物序列。kiss1:上游5′-CACCTGTGGTGAACCCTGAA-3′,下游5′-GACGAAT-TTGCACATGAAGTCTCC-3′;kiss1r:上游5′-AGCAC-ATGCAGACCGTCACC-3′,下游5′-GACGAATTTGC-ACATGAAGTCTCC-3′。预变性95℃×30 s,1个循环;PCR反应:95℃×5 s,60℃×20 s,40个循环。以β-actin为内参,采用Rotor Gene-3000进行扩增定量,以相对定量法分析数据。
1.8 统计学方法
采用SPSS 17.0统计软件包进行统计学分析。计量资料用均数±标准差(x±s)表示,两组比较采用t检验。以P < 0.05为差异有统计学意义。
2 结果
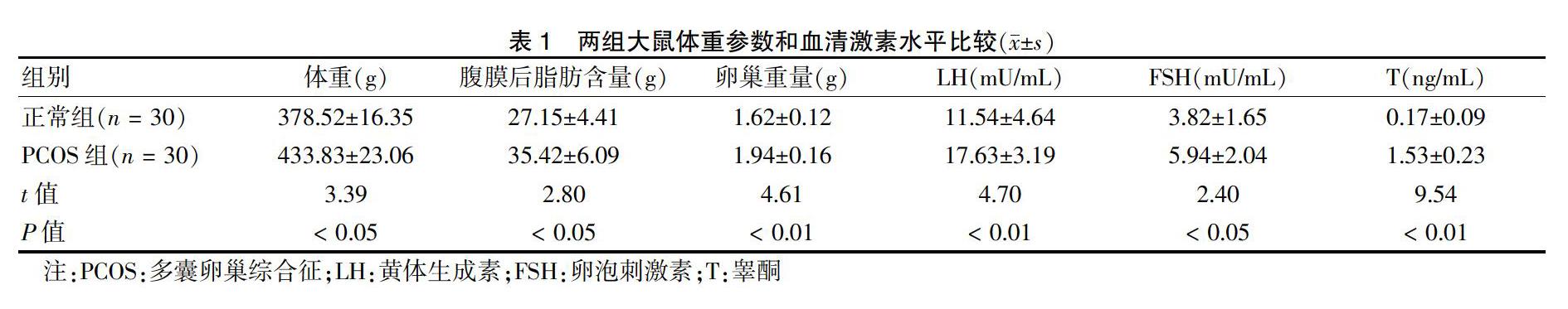
2.1 两组大鼠体重参数和血清激素水平比较
与正常组比较,PCOS组大鼠的体重、腹膜后脂肪含量、卵巢重量均增加(P < 0.05或P < 0.01),血清LH、FSH和T水平均升高(P < 0.05或P < 0.01)。见表1。
2.2 两组大鼠卵巢的形态学改变
正常组大鼠卵巢可见多个卵泡,卵母细胞、透明带和放射冠清晰可见,次级卵泡、成熟卵泡均正常;PCOS组大鼠卵巢可见数十个囊状扩张的卵泡,卵母细胞和放射冠减少或消失。见图1。
2.3 两组大鼠卵巢中kisspeptin/kiss1r系统的表达
卵巢中kisspeptin/kiss1r系统在胞质中呈棕黄色着色,边界清晰。kisspeptin主要表达于颗粒细胞和膜细胞,kiss1r的阳性信号多见于颗粒细胞。分析显示,与正常组比较,PCOS组大鼠卵巢组织kisspeptin和kiss1r阳性细胞数量减少,胞质着色淡,含量均减少。见图2(封四)。
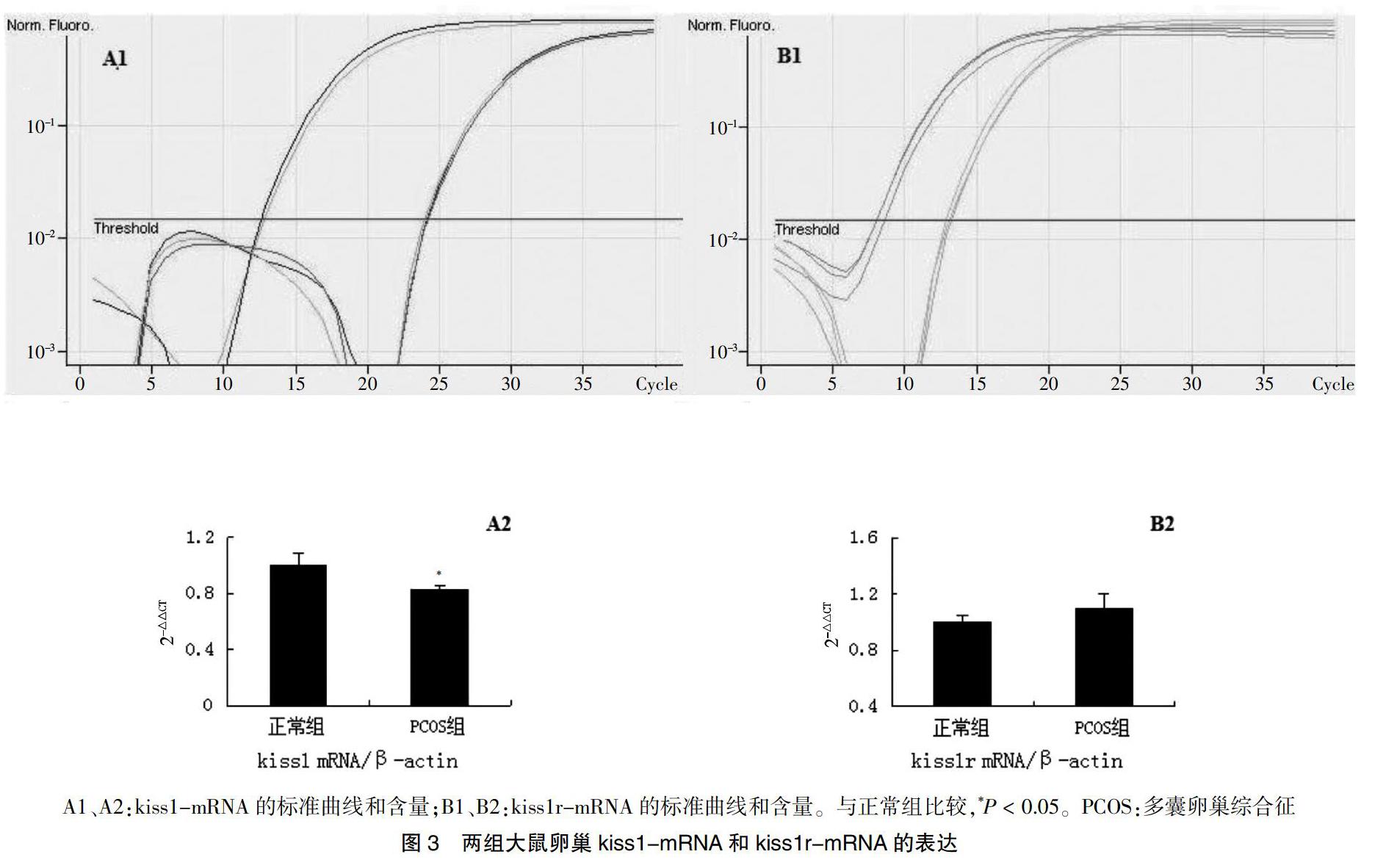
2.4 两组大鼠卵巢中kiss1-mRNA和kiss1r-mRNA的表达
与正常组比较,PCOS组大鼠卵巢中kiss1-mRNA表达降低(P < 0.05);两组大鼠卵巢中kiss1r-mRNA表达比较,差异无统计学意义(P > 0.05)。见图3。
3 讨论
PCOS是无排卵性不孕的最常见原因,发病率为25%~30%[9],多见闭经、多毛、肥胖、不孕和卵巢多囊样改变。本实验用来曲唑构建大鼠的PCOS模型,来曲唑可抑制芳香化酶的功能,减弱睾酮和雄烯二酮转变成雌二醇和雌酮[10]的能力,导致雄激素水平升高。卵巢中高雄激素使卵泡发育停滞,无优势卵泡出现和持续性不排卵,是本课题中建立PCOS模型的理论基础。
造模结束后,大鼠的体重、腹膜后脂肪和卵巢重量显著增加,血清LH、FSH和T水平升高,HE染色后可见卵巢结构紊乱,呈典型的多囊样,因此用来曲唑造模可以作为PCOS模型进行后续研究。
PCOS的致病机制尚不能确定,多与HPG轴的功能紊乱有关。kisspeptin是HPG轴最直接的启动点[11]。营养不良[12]、禁食[13]、糖尿病[14]等均会引起下丘脑kiss1-mRNA的表达减少。PCOS大鼠的下丘脑kisspeptin/kiss1r系统中蛋白和基因表达有明显改变,可能通过调节HPG轴的功能发挥作用。卵巢组织局部的kiss-peptin不仅在下丘脑发挥作用,而且还能调节卵巢的功能[15]。向体外培养卵巢黄体细胞加入外源性kissp-eptin,孕酮升高[16],同时激活Erkl/2信号途径[17],由此证明,kisspeptin可直接影响卵巢功能。PCOS组大鼠卵巢组织中kisspeptin和kiss1r的低表达,可能导致卵泡的生长发育存在明显缺陷[18]。kisspeptin处理黄素化的颗粒细胞后,促使颗粒细胞增殖分化,分泌雌激素和孕激素增加[19]。在PCOS大鼠卵巢中,颗粒细胞数量减少或功能减低,可能与低表达的kisspeptin/kiss1r系统有关。有研究将kisspeptin用于诱导排卵[20],发现其能减少促排卵过程中卵巢过度刺激综合征的发生。
综上所述,kisspeptin/kiss1r系统与PCOS的发生、发展存在潜在的联系,为深入研究PCOS的发病机制提供一定的理论基础,并为临床治疗提供有利线索。
[参考文献]
[1] Di Pietro M,Pascuali N,Parborell F,et al. Ovarian angiogenesis in polycystic ovary syndrome [J]. Reproduction,2018,155(5):R199-R209.
[2] 王秋毅,黄薇.重视多囊卵巢综合征代谢紊乱问题[J].实用妇产科杂志,2018,34(8):564-566.
[3] 毕红,李卫文,曹森杨,等.多囊卵巢综合征患者血清肿瘤坏死因子-α和抗苗勒管激素水平及其与疾病的相关性分析[J].妇女保健,2018,33(19):4363-4365.
[4] Skorupskaite K,George JT,Anderson RA. The kisspeptin-GnRH pathway in human reproductive health and disease [J]. Hum Reprod Update,2014,20(4):485-500.
[5] 刘冉冉,张洪芹.Kisspeptin/kiss1r系統在营养性肥胖雄性大鼠下丘脑弓状核的表达以及对下丘脑-垂体-睾丸轴的影响[J].中华男科学杂志,2014,20(9):792-797.
[6] Tng EL. Kisspeptin signalling and its roles in humans [J]. Singapore Med J,2015,56(12):649-656.
[7] Aliabadi E,Namavar MR,Mortezaee K. Kisspeptin expression features in the arcuate and anteroventral periventricular nuclei of hypothalamus of letrozole-induced polycystic ovarian syndrome in rats [J]. Arch Gynecol Obstet,2017,296(5):957-963.
[8] 骆倩倩,刘冉冉,张冬梅,等. Kisspeptin/Kiss1r系统在多囊卵巢综合症大鼠下丘脑弓状核的表达[J].中国计划生育学杂志,2014,22(5):304-308.
[9] 刘丽伟.C-FOS、STAT3、Ub在PCOS患者着床窗口期子宫内膜的表达及意义[D].郑州:郑州大学,2016.
[10] Kakadia N,Patel P,Deshpande S,et al. Effect of Vitex negundo L. seeds in letrozole induced polycystic ovarian syndrome [J]. J Tradit Complement Med,2018,9(4):336-345.
[11] Trevisan CM,Montagna E,de Oliveira R,et al. Kisspeptin/GPR54 system:what do we know about its role in human reproduction? [J]. Cell Physiol Biochem,2018,49(4):1259-1276.
[12] Roa J,Barroso A,Ruiz-Pino F,et al. Metabolic regulation of female puberty via hypothalamic AMPK-kisspeptin signaling [J]. Proc Natl Acad Sci U S A,2018,15(45):E10758-E10767.
[13] Harter Campbell JL,Kavanagh GS,Smith JT. The role of kisspeptin neurons in reproduction and metabolism [J]. J Endocrinol,2018,238(3):R173-R183.
[14] Dudek M,Ko?覥odziejski PA,Pruszyńska-Oszma?覥ek E,et al. Effects of high-fat diet-induced obesity and diabetes on Kiss1 and GPR54 expression in the hypothalamic-pituitary-gonadal (HPG) axis and peripheral organs (fat,pancreas and liver) in male rats [J]. Neuropeptides,2016, 56:41-49.
[15] Hu KL,Zhao H,Chang HM,et al. Kisspeptin/kisspeptin receptor system in the ovary [J]. Front Endocrinol (Lausanne),2018,8:365.
[16] Maranesi M,Petrucci L,Leonardi L,et al. Kisspeptin/kisspeptin receptor system in pseudopregnant rabbit corpora lutea:presence and function [J]. Sci Rep,2019,9(1):5044.
[17] Peng J,Tang M,Zhang BP,et al. Kisspeptin stimulates progesterone secretion via the Erk1/2 mitogen-activated protein kinase signaling pathway in rat luteal cells [J]. Fertil Steril,2013,99(5):1436-1443.
[18] Liu H,Xu G,Yuan Z,et al. Effect of kisspeptin on the proliferation and apoptosis of bovine granulosa cells [J]. Anim Reprod Sci,2017,185:1-7.
[19] 郭威.Kisspeptin参与多嚢卵巢综合征患者颗粒细胞孕激素分泌的调节[D].郑州:郑州大学,2015.
[20] 翟君钰.Kisspeptin与卵巢功能及排卵的关联性研究[D].济南:山东大学,2014.
(收稿日期:2019-08-08)
