靶向MSLN的CAR-NK-92细胞在胃癌中的抗肿瘤活性研究
2020-08-27张军董雅璐
张军 董雅璐
[摘要] 目的 探索靶向间皮素(MSLN)嵌合抗原受体改造的NK-92细胞在胃癌中的抗肿瘤活性。 方法 构建靶向MSLN的二代嵌合抗原受体,利用慢病毒转染的方式将其导入NK-92细胞中得到MSLN CAR-NK-92细胞。通过免疫组化分析、流式细胞术及Western blot实验检测人胃癌肿瘤组织、人胃癌细胞中MSLN的表达情况。通过体外激活及体内肿瘤抑制实验研究CAR-NK-92细胞的特异性识别能力和抗肿瘤活性。 结果 人胃癌肿瘤组织及肿瘤细胞中高表达MSLN。CAR-NK-92细胞可以特异性激活并裂解肿瘤细胞。与转染空载体的NK-92细胞比较,CAR-NK-92细胞可以明显抑制胃癌肿瘤的生长(P < 0.01)。 结论 构建的靶向MSLN的CAR-NK-92在体内外都展现出显著的特异性杀伤MSLN+的胃癌细胞的活性,将有可能在胃癌的治疗中提供新的思路。
[关键词] 胃癌;间皮素;NK-92细胞;免疫治疗
[中图分类号] R730.51 [文献标识码] A [文章编号] 1673-7210(2020)07(a)-0011-05
[Abstract] Objective To explore the antitumor activity of NK-92 cells modified with chimeric antigen receptor targeting mesothelin (MSLN) in gastric cancer. Methods The second generation chimeric antigen receptor targeting MSLN was constructed and transfected into NK-92 cells by lentivirus transfection to obtain MSLN CAR-NK-92 cells. The expression of MSLN in human gastric cancer tissues and human gastric cancer cells was detected by immunohistochemistry, flow cytometry and Western blot. The specific recognition ability and the anti-tumor activity of CAR-NK-92 cells were studied through in vitro activation and in vivo tumor inhibition experiments. Results MSLN was highly expressed in human gastric cancer tissue and tumor cells. CAR-NK-92 cells could specifically activate and lyse tumor cells. Compared with NK-92 cells transfected with an empty vector, CAR-NK-92 cells can significantly inhibited the growth of gastric cancer (P < 0.01). Conclusion CAR-NK-92 targeting MSLN has shown significant activity in vivo and in vitro to kill gastric cancer cells specific to MSLN+, which may provide a new idea in the treatment of gastric cancer.
[Key words] Gastric cancer; Mesothelin; NK-92 cell; Immunotherapy
胃癌是全球癌症相关死亡的第三大原因,每年约有100万新诊断病例[1-2]。CAR修饰的淋巴细胞是一种很有前途的免疫治疗方法[3]。目前T细胞、NK细胞代表了另一种可以用CAR改造的高度有效的效应细胞类型,同种异体NK细胞過继转移安全性高[4],但培养相对困难[5]。NK-92细胞是目前比较理想的原代NK细胞替代品[6],其安全性和有效性已被证实[7]。此外,一项早期的临床试验证实输注经过辐射的NK-92细胞具有良好的耐受性,并且部分接受治疗的癌症患者得到了长时间的疾病缓解[8],这使得NK-92细胞成为CAR工程化的一个极具希望的选择[9]。
本研究首先设计了靶向间皮素(MSLN)的二代CAR来改造NK-92细胞,以探究这种MSLN CAR-NK-92细胞是否会对胃癌产生显著的抗肿瘤活性。随后选择在实体瘤中高表达MSLN作为靶标[10-11]。结果发现靶向MSLN的CAR-NK-92细胞可以在体外充分激活并裂解MSLN+胃癌细胞。体内实验显示这种CAR-NK-92细胞可以显著抑制MSLN+胃癌肿瘤生长。本研究显示靶向MSLN的CAR-NK-92细胞可以为胃癌的治疗提供一种新的策略。
1 材料与方法
1.1 细胞系及主要试剂
MGC803细胞、BGC-823细胞、AGS细胞、SGC-7901细胞购自美国模式菌种库;NK-92细胞购自上海细胞库。MGC803细胞、BGC-823细胞、SGC-7901细胞培养在含10%胎牛血清的DMEM培养基中,AGS细胞培养在含10%胎牛血清的RPMI-1640培养基中,NK-92细胞培养在添加5%人AB血清的X-VIVO 10培养基中。
Poly-brane购自Sigma公司(美国,P8136);BX795购自InvivoGen公司(法国,S49953);抗-MSLN免疫组化抗体购自R&D公司(AF3256);抗MSLN(594004)及CD107a(121607)流式抗体购自美国Biolegend公司;LDH检测试剂盒购自碧云天生物科技有限公司(中国,C0016);化学发光试剂盒购自万类生物(中国,WLA003);山羊抗兔二抗(LK-GAM0072)及GAPDH一抗(70-Mab5465-040)购自联科生物科技有限公司。
1.2 MSLN CAR载体的构建
MSLN CAR的结构如文献[10]研究所述。在胞外区包含Anti-MSLN scFv及CD8铰链区,紧随其后的是CD8的跨膜区、胞内的4-1BB信号转导结构域和CD3ζ信号转导结构域。CAR序列被整合到含有绿色荧光蛋白的表达载体中,绿色荧光蛋白序列与CAR序列以T2A位点分隔。另外一个只编码绿色荧光蛋白的空载体作为对照。
1.3 慢病毒转染NK-92细胞
转染前1 d,在6孔板中将NK-92细胞密度调整为1×105个/mL,加入X-VIVO 10培养基;第2天,细胞与慢病毒颗粒(MOI为2)、Poly-brane(8 μg/mL)和激酶抑制剂BX795(8 μmol/L)混合(这两种试剂都被证明能提高NK细胞的慢病毒转导效率)。6孔板离心60 min(32℃,1800×g),37℃孵育6 h,离心除去转染混合物(360×g离心5 min),换成2 mL新鲜的X-VIVO 10培养基;次日,将NK-92细胞接种于含慢病毒颗粒、Poly-brane和BX795的5 mL培养基中,37℃培养6 h,更换新鲜培养基,37℃孵育;次日重复第3次转染。通过流式细胞仪检测绿色荧光蛋白的表达来评价转导效率。对于转染CAR载体的NK-92细胞,命名为CAR-NK-92细胞,对于转染空载体的NK-92细胞,命名为Control NK-92细胞(C-NK-92细胞)。
1.4 流式细胞术
对于流式细胞检测MSLN,4种肿瘤细胞(mGC803细胞、BGC-823细胞、SGC-7901细胞、AGS细胞)分别通过离心获得所有细胞,用FACS洗涤缓冲液(含有0.5% BSA和0.03%疊氮化钠的1×PBS)洗涤3次。用针对抗MSLN的流式抗体进行细胞表面染色,避光孵育30 min,用FACS洗涤缓冲液洗3次,进行流式细胞分析。
对于NK细胞激活实验,将构建好的CAR-NK-92细胞与MGC803细胞及SGC-7901共孵育6 h,通过抗人CD107a抗体检测CAR-NK-92细胞上的CD107a的表达。所有样本在LSR Ⅱ细胞仪(BD Biosciences)上进行操作,使用FACS DIVA软件v8.0(BD Biosciences)进行分析。
1.5 Western blot检测
在含有蛋白酶抑制剂的RIPA缓冲液中分别裂解MGC803细胞、BGC-823细胞、AGS细胞、SGC-7901细胞。通过12% SDS-PAGE凝胶分离等量的蛋白质。电泳后,将蛋白质转移至PVDF膜上,在5%脱脂乳中封闭,并在4℃下与MSLN抗体一抗(1∶500)孵育过夜。TBST洗涤3次后,将膜与HRP缀合的山羊抗兔二抗(1∶10 000)在室温下孵育2 h。增强型化学发光分析试剂盒对PVDF膜进行处理,ChemiDocTM XRS+成像系统(BIO-RAD)进行曝光。通过使用Image J对条带的强度进行量化。GAPDH为同型对照。
1.6 免疫组化分析
肿瘤组织样本来自新疆军区总医院(以下简称“我院”)接收的胃癌患者,本研究经我院医学伦理委员会批准,患者签署知情同意书。肿瘤组织经石蜡包埋切片,并在二甲苯中脱蜡。切片在0.3%的过氧化氢(H2O2)-甲醇溶液中浸泡30 min,PBS洗涤,在4℃用抗MSLN的单克隆抗体孵育过夜。使用缓冲液洗涤后,将石蜡切片与生物素标记的山羊抗兔或抗鼠IgG在室温下孵育2 h。免疫染色用链霉亲和素/过氧化物酶复合物和二氨基联苯胺(DAB)显色,苏木精复染。在倒置显微镜下的明场下观察并拍照。
1.7 细胞毒性实验
分别取1×104个肿瘤细胞进行铺板,以2∶1的效靶比在37℃条件下与效应细胞共孵育24 h。测量乳酸脱氢酶(LDH)反映细胞毒性。实验组和对照组根据制造商的方案设计。Multiskan FC酶标仪(THERMO FISHER),检测490 nm处的吸光度来确定样品中的LDH活性;计算T细胞的细胞毒性,裂解率(%)=(实验组吸光度-效应细胞自发裂解吸光度-靶细胞自发裂解吸光度-培养基对照吸光度)/(靶细胞最大裂解吸光度-靶细胞自发裂解吸光度-培养基对照吸光度)×100%。
1.8 体内实验
5~7周龄的雌性SPF级balb/c裸鼠,16~18 g,购于新疆医科大学实验动物研究中心,共计10只,许可证号:SCXK(新)20190002,合格证号:SYXK(新)20190014。在标准无菌室中饲养,每日监测,健康状况良好。所有方案均经我院动物护理和使用委员会批准(IACUC编号:2019伦审第006号)进行。通过对小鼠皮下注射1×106个MGC803细胞建立异种移植模型。接种后7 d,通过尾静脉给予5×106 C-NK-92细胞和CAR-NK-92细胞,每组5只小鼠,之后每7天测量肿瘤长宽,计算体积,体积=(长×宽2)/2。在接瘤后第32天处死小鼠剥离肿瘤,拍照记录肿瘤大小并称量瘤重。
1.9 统计学方法
采用SPSS 19.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,两组间比较采用t检验。以P < 0.05为差异有统计学意义。
2 结果
2.1 MSLN CAR-NK-92细胞的构建和检测
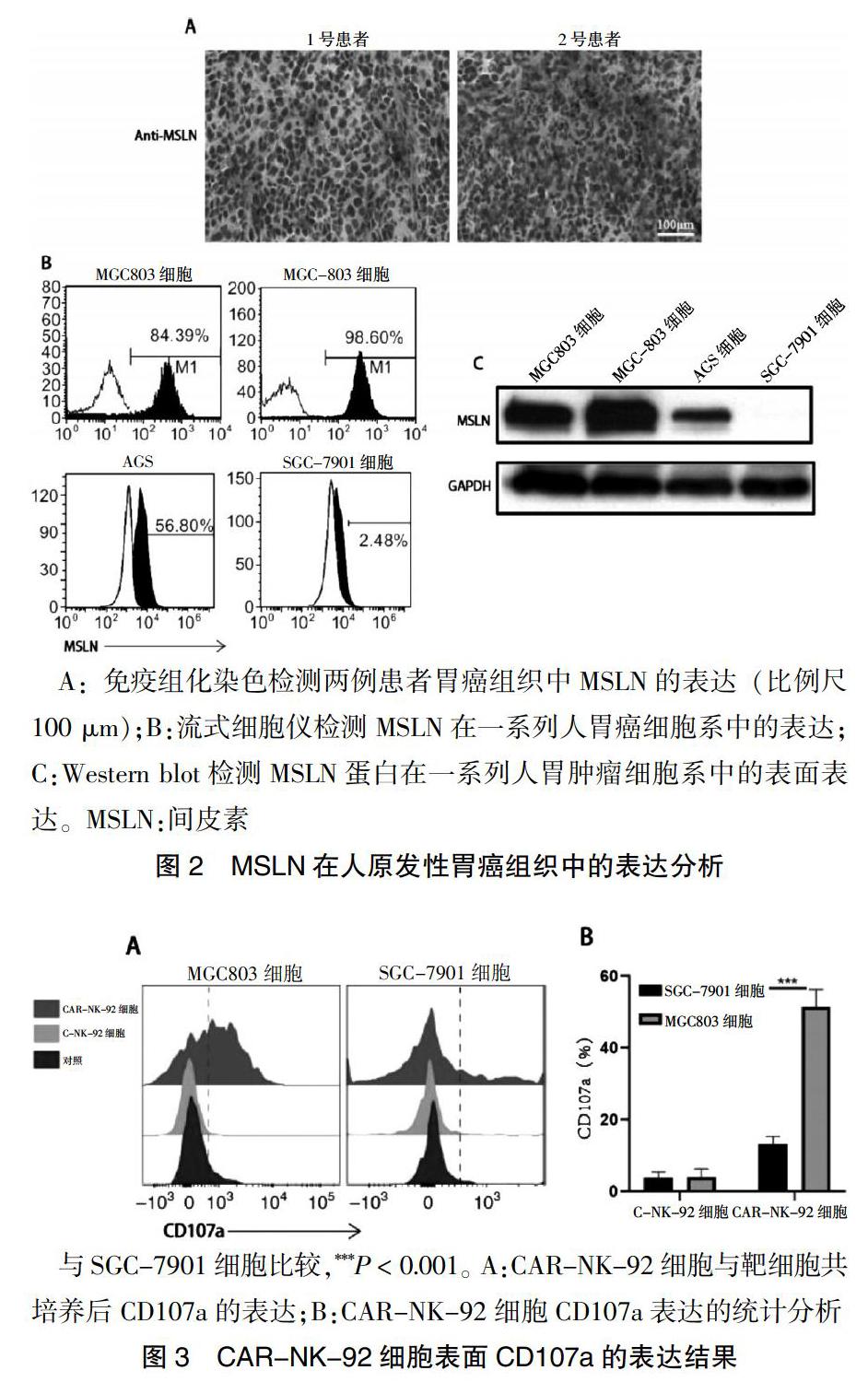
CAR结构由MSLN scFv,CD8铰链及跨膜区,4-1BB共刺激结构域及CD3ζ构成,载体中包含EGFP作为检测标签,见图1A(封四);细胞流式检测结果显示,C-NK-92细胞与CAR-NK-92细胞都显著表达增强型绿色荧光蛋白(EGFP),见图1B(封四),转染效率为40%左右,见图1C(封四)。
2.2 MSLN在人原发性胃癌组织中的表达分析
免疫组化结果显示,胃癌患者的肿瘤组织中高表达MSLN,见图2A;胃癌细胞流式检测结果显示,MGC803及BGC-823细胞显著高表达MSLN,AGS细胞表达量适中,而SGC-7901细胞几乎不表达MSLN,见图2B;Western blot结果验证了流式检测的结果,见图2C。
2.3 CAR-NK-92细胞表面CD107a的表达结果
效应细胞与MGC803细胞共孵育时,CAR-NK-92细胞表面CD107a表达高于NK-92细胞,差异有高度统计学意义(t = 32.59,P < 0.01);而与SGC-7901细胞共孵育时,CAR-NK-92细胞表面CD107a的表达与NK-92细胞比较,差异无统计学意义(P > 0.05)。见图3。
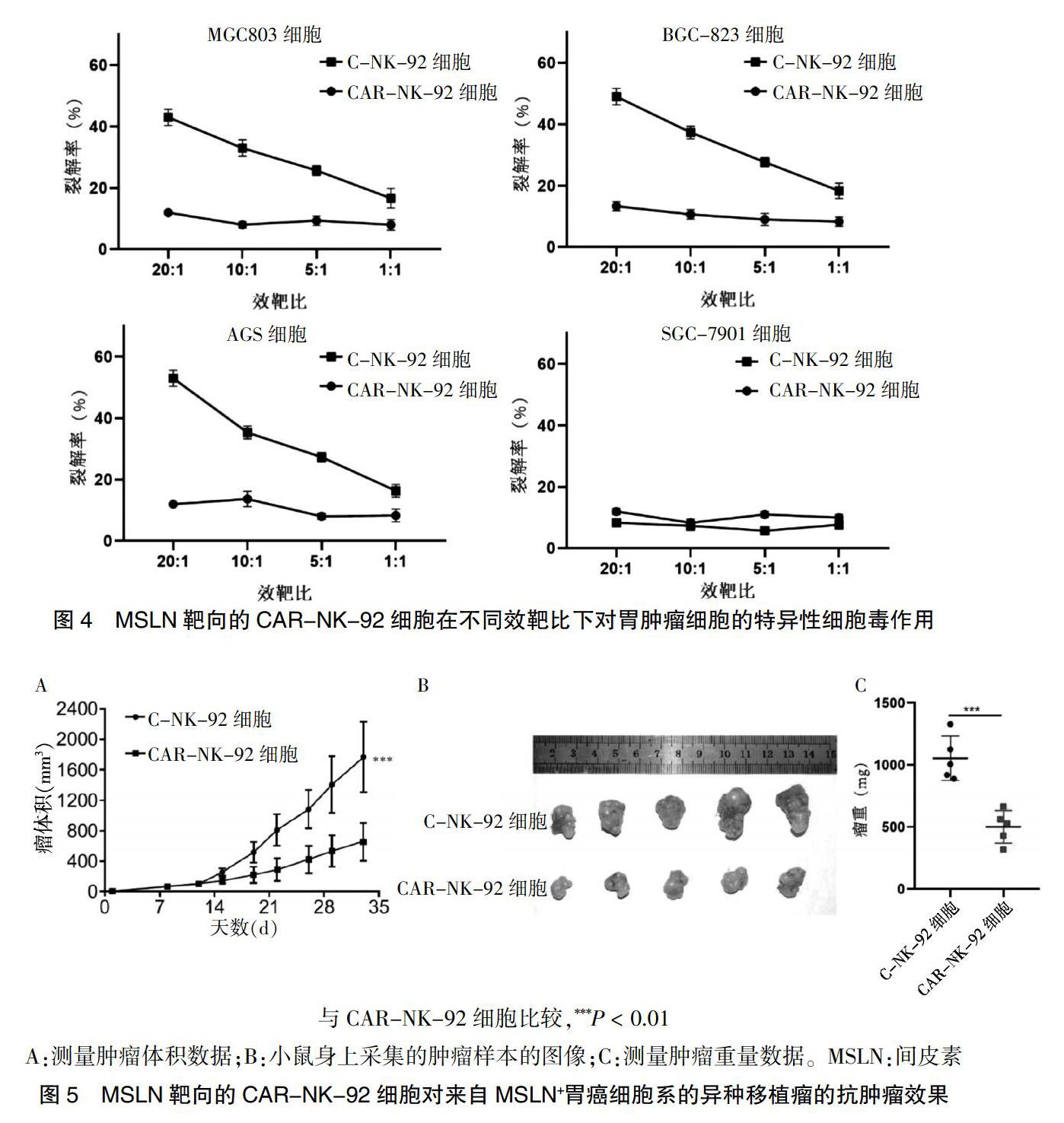
2.4 MSLN靶向的CAR-NK-92细胞在不同效靶比下对胃肿瘤细胞的特异性细胞毒作用
当靶细胞为MSLN阳性的肿瘤细胞时,随着效靶比的增加,CAR-NK-92细胞毒性也随之增强;而对于MSLN阴性的SGC-7901细胞,在多种效靶比下均不能有效裂解靶细胞。而对于C-NK-92细胞,在任何条件下都不能产生明显的细胞毒性。见图4。
2.5 MSLN靶向的CAR-NK-92细胞对来自MSLN+胃癌细胞系的异种移植瘤的抗肿瘤效果
小鼠皮下移植瘤瘤体积监测结果显示,CAR-NK-92细胞明显抑制肿瘤的生长,而C-NK-92细胞对肿瘤的生长没有抑制能力,组间比较差异有高度统计学意义(t = 33.89,P < 0.01),见图5A。接瘤后第32天处死小鼠剥离肿瘤发现,CAR-NK-92细胞治疗后的小鼠瘤重显著低于C-NK-92细胞(t = 5.571,P < 0.01),见图5B~C。
3 討论
已有临床实验将CAR-T细胞应用于胃癌患者的治疗[12],然而CAR-T细胞在实体瘤患者中响应率仍然很低。这些挑战主要与CAR-T细胞向肿瘤部位迁移效率低以及免疫抑制微环境有关[13]。除了T细胞,NK细胞的使用在近年来成为了一种非常有前途的治疗方法。然而,自体NK细胞的抗肿瘤效力是有限的,因为它们的活性在遇到自身抗原后可以被抑制[14]。因此,大多数现存的治疗方法都是基于供者来源的同种异体NK细胞或已建立的NK细胞系[15]。
本研究使用了人NK-92细胞系,因为其具有无限的扩增潜力和对癌细胞的细胞毒性。临床前研究显示,NK-92细胞或工程化的NK-92细胞在体外和体内模型中对包括血液恶性肿瘤和实体瘤在内的各种癌症有效[16]。此外,已证明用CAR改造的NK-92细胞可以克服肿瘤微环境中的抑制条件[17]。使其成为临床转化的一个有吸引力的选择。
MSLN是极少数可用于免疫细胞治疗的靶点之一[10],并开展了多项临床试验[18]。研究结果显示,MSLN在胃癌患者肿瘤组织中高表达,在多种胃癌细胞中也显著高表达。体内外抗肿瘤活性实验也显示,靶向MLSN的CAR-NK-92细胞可以有效杀伤胃癌细胞,抑制肿瘤生长。
NK细胞对恶性细胞有天然的感知能力,它不会像T细胞一样在肿瘤微环境中分化为抑制性的调节性T细胞,这些特性也许可以使得CAR-NK细胞对实体瘤产生更强的抗肿瘤活性。NK-92除了缺乏FcγRⅢ(CD16RⅢ)的表达外,还具有与激活的外周血NK细胞相似的特征[19]。因此,CAR-NK-92细胞更是成为一种非常有前途的治疗手段[20]。结合本研究结果,相信靶向MSLN的CAR-NK-92可以为胃癌的治疗提供新的策略。
[参考文献]
[1] Slagter AE,Tudela B,van Amelsfoort RM,et al. Older versus younger adults with gastric cancer receiving perioperative treatment:Results from the CRITICS trial [J]. Eur J Cancer,2020,130:146-154.
[2] Ferlay J,Soerjomataram I,Dikshit R,et al. Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012 [J]. Int J Cancer,2018,136(5):E359-E386.
[3] Miliotou AN,Papadopoulou LC. CAR T-cell Therapy:A New Era in Cancer Immunotherapy [J]. Curr Pharm Biotechnol,2018,19(1):5-18.
[4] Veluchamy JP,Kok N,van der Vliet HJ,et al. The Rise of Allogeneic Natural Killer Cells As a Platform for Cancer Immunotherapy:Recent Innovations and Future Developments [J]. Front Immunol,2017,8:631.
[5] Swift BE,Williams BA,Kosaka Y,et al. Natural killer cell lines preferentially kill clonogenic multiple myeloma cells and decrease myeloma engraftment in a bioluminescent xenograft mouse model [J]. Haematologica,2012,97(7):1020-1028.
[6] Angelo LS,Banerjee PP,Monaco-Shawver L,et al. Practical NK cell phenotyping and variability in healthy adults [J]. Immunol Res,2015,62(3):341-356.
[7] Klingemann H,Boissel L,Toneguzzo F. Natural Killer Cells for Immunotherapy-Advantages of the NK-92 Cell Line over Blood NK Cells [J]. Front Immunol,2016,7:91.
[8] Yan Y,Steinherz P,Klingemann HG,et al. Antileukemia activity of a natural killer cell line against human leukemias [J]. Clin Cancer Res,1998,4(11):2859-2868.
[9] Nowakowska P,Romanski A,Miller N,et al. Clinical grade manufacturing of genetically modified,CAR-expressing NK-92 cells for the treatment of ErbB2-positive malignancies [J]. Cancer Immunol Immunother,2018,67(1):25-38.
[10] Lv J,Zhao R,Wu D,et al. Mesothelin is a target of chimeric antigen receptor T cells for treating gastric cancer [J]. J Hematol Oncol,2019,12(1):18.
[11] Sotoudeh M,Shirvani SI,Merat S,et al. MSLN(Mesothelin),ANTXR1(TEM8),and MUC3A are the potent antigenic targets for CAR T cell therapy of gastric adenocarcinoma [J]. J Cell Biochem,2019,120(4):5010-5017.
[12] Yu S,Li A,Liu Q,et al. Chimeric antigen receptor T cells:a novel therapy for solid tumors [J]. J Hematol Oncol,2017,10(1):78.
[13] Srivastava S,Riddell SR. Chimeric Antigen Receptor T Cell Therapy:Challenges to Bench-to-Bedside Efficacy [J]. J Immunol,2018,200(2):459-468.
[14] Pascal V,Schleinitz N,Brunet C,et al. Comparative analysis of NK cell subset distribution in normal and lymphoproliferative disease of granular lymphocyte conditions [J]. Eur J Immunol,2004,34(10):2930-2940.
[15] Suck G,Odendahl M,Nowakowska P,et al. NK-92:an ′off-the-shelf therapeutic′ for adoptive natural killer cell-based cancer immunotherapy [J]. Cancer Immunol Immunother,2016,65(4):485-492.
[16] Arai S,Meagher R,Swearingen M,et al. Infusion of the allogeneic cell line NK-92 in patients with advanced renal cell cancer or melanoma:a phase Ⅰ trial [J]. Cytotherapy,2008,10(6):625-632.
[17] Zhang C,Oberoi P,Oelsner S,et al. Chimeric Antigen Receptor-Engineered NK-92 Cells:An Off-the-Shelf Cellular Therapeutic for Targeted Elimination of Cancer Cells and Induction of Protective Antitumor Immunity [J]. Front Immunol,2017,8:533.
[18] Adusumilli PS,Cherkassky L,Villena-Vargas J,et al. Regional delivery of mesothelin-targeted CAR T cell therapy generates potent and long-lasting CD4-dependent tumor immunity [J]. Sci Transl Med,2014,6(261):261ra151.
[19] Gong JH,Maki G,Klingemann HG. Characterization of a human cell line(NK-92)with phenotypical and functional characteristics of activated natural killer cells [J]. Leukemia,1994,8(4):652-658.
[20] 王志華.NK细胞抗肿瘤临床转化研究进展[J].中国肿瘤生物治疗杂志,2016,23(3):419-426.
(收稿日期:2020-04-01)
