miR-519d-3p靶向KPNA2对胶质瘤细胞增殖、迁移和侵袭的影响及机制
2020-08-27胡德献孙衍昶冯基高莫业和
胡德献 孙衍昶 冯基高 莫业和
(海南医学院第二附属医院神经外科,海南 海口 570311)
胶质瘤是颅内肿瘤中常见恶性肿瘤之一,其主要临床病理特征为发病率高、死亡率高及恶性程度高,现有医疗水平尚不可有效治疗胶质瘤,治疗后胶质瘤患者生存期短预后差〔1〕。因而从分子水平上分析胶质瘤发病机制对探寻新的诊疗方法及提高治疗效果均具有重要现实意义。研究表明微小RNA(miR)-519d-3p(miR-519d-3p)在胰腺癌组织和细胞中表达显著降低,miR-519d-3p过表达可抑制胰腺癌细胞增殖〔2〕。miR-519d-3p过表达可抑制乳腺癌细胞增殖、迁移和侵袭〔3〕。miR-519d-3p在胃癌组织中低表达,上调表达后可抑制胃癌细胞增殖和侵袭〔4〕。然而,miR-519d-3p在胶质瘤细胞中的表达及其可能作用机制尚未见报道。为进一步明确miR-519d-3p在胶质瘤发生及发展过程中的可能作用机制,通过靶基因预测软件检索发现核转运蛋白α-2(KPNA2)可能是miR-519d-3p的靶基因,研究表明KPNA2在胶质瘤中表达升高,敲除KPNA2后可显著减弱胶质瘤细胞增殖、迁移和侵袭能力,但关于KPNA2上游调控miRNA等基因研究相对较少〔5〕。研究报道指出KPNA2在食管鳞状细胞癌组织和细胞中过表达,抑制KPNA2表达可抑制癌细胞的增殖和克隆形成能力〔6〕。沉默KPNA2表达能够有效抑制膀胱癌细胞和舌鳞癌细胞的迁移和侵袭能力〔7,8〕。但miR-519d-3p在胶质瘤细胞中的表达及其对胶质瘤细胞增殖、迁移侵袭的影响,且miR-519d-3p是否通过调控KPNA2的表达影响胶质瘤细胞的增殖、迁移和侵袭目前还尚未可知。因此,本研究分析miR-519d-3p在胶质瘤细胞中的表达,通过miR-519d-3p过表达分析其对胶质瘤细胞增殖、迁移及侵袭的影响,并验证miR-519d-3p是否可通过调控KPNA2表达而参与胶质瘤发生及发展过程,以期为胶质瘤靶向治疗提供理论依据。
1 材料与方法
1.1材料与试剂 正常胶质细胞株SVGp12购自美国ATCC,人胶质瘤细胞株U251、U87、T98G均购自上海医学科学院细胞所。杜氏改良培养基(DMEM)购自美国Gibco公司;胎牛血清(FBS)购自上海吉泰依科赛生物科技有限公司;胰蛋白酶购自北京索莱宝科技有限公司;LipofectamineTM2000转染试剂盒购自美国Thermo Fisher公司;miR-519d-3p mimics及其阴性对照、miR-519d-3p抑制剂(anti-miR-519d-3p)及其阴性对照(anti-miR-NC)均购自广州锐博生物科技有限公司;KPNA2 siRNA干扰质粒(si-KPNA2)及其阴性对照(si-NC)均购自上海吉玛制药技术有限公司;MTT检测试剂盒购自美国Sigma公司;Western印迹所用的二喹啉甲酸(BCA)蛋白定量试剂盒购自美国TIANGEN公司;兔抗人KPNA2多克隆抗体购自美国Abcam公司;兔抗人磷酸甘油醛脱氢酶(GAPDH)多克隆抗体购自美国R&D Systems公司;实时荧光定量PCR检测试剂盒购自美国Bio-Rad公司;鼠抗人CyclinD1、p21、p27一抗均购自美国Cell Signaling Technology公司;辣根过氧化物酶标记的山羊抗兔与山羊抗鼠IgG二抗均购自北京中杉金桥生物技术有限公司;兔抗人MMP-2、MMP-9、MMP-14一抗均购自美国Santa Cruz公司;Trizol试剂与RNA反转录试剂盒均购自日本TaKaRa公司;pmiroGLO质粒与双荧光素酶报告系统均购自美国Promega公司;Mgteigel基质胶购自美国BD公司;双荧光素酶报告基因检测试剂盒购自美国Promega公司;电化学发光(ECL)试剂购自美国Bio-Rad公司;Transwell小室购自重庆威斯腾生物医药科技有限责任公司。
1.2方法
1.2.1细胞转染及分组 胶质瘤细胞株U251、U87、T98G与正常胶质细胞株SVGp12复苏后接种于含有10%FBS及青霉素-链霉素混合溶液的DMEM培养基中,放置在37 ℃、5%CO2培养箱内培养,用胰蛋白酶消化细胞进行传代培养。收集对数生长期细胞进行实验研究,调整细胞浓度后将胶质瘤U251细胞以每孔1×106个细胞的密度接种于6孔板,待细胞生长融合度达到80%左右时进行转染,参照Lipofectamine2000转染试剂盒说明书进行转染,严格按照试剂盒说明书进行操作,实验将胶质瘤U251细胞随机分为miR-NC组(U251细胞中转染无关序列RNA)、miR-519d-3p组(U251细胞中转染miR-519d-3p mimics),采用qRT-PCR法验证转染效率。转染前1 d将培养基更换为不含血清的培养基,转染6 h后弃旧培养基并更换为含有10%FBS及青霉素-链霉素混合溶液的DMEM培养基继续培养24 h或48 h。为验证miR-519d-3p与KPNA2的调控关系,将miR-519d-3p mimics、anti-miR-519d-3p及其各自阴性对照分别转染入胶质瘤U251细胞,即分别为miR-NC组、miR-519d-3p组、anti-miR-NC组、anti-miR-519d-3p组。为证实miR-519d-3p是否通过调控KPNA2表达而发挥作用,本研究设置共转染组,分别为miR-519d-3p+pcDNA组(miR-519d-3p mimics与pcDNA共转染入胶质瘤U251细胞)、miR-519d-3p+pcDNA-KPNA2组(miR-519d-3p mimics与pcDNA-KPNA2共转染入胶质瘤U251细胞),转染条件与上述转染相同,实验过程中均需严格按照Lipofectamine2000转染试剂盒说明书进行操作,转染6 h后更换为含有10%FBS及青霉素-链霉素混合溶液的DMEM培养基继续培养24 h或48 h,收集对数生长期细胞进行后续实验。
1.2.2qRT-PCR检测细胞中miR-519d-3p、KPNA2 mRNA表达水平 取胶质瘤细胞株、正常胶质细胞株及转染后各组对数生长期的胶质瘤U251细胞,胰蛋白酶消化细胞后计数,吸取5×106个细胞,用预冷PBS洗涤细胞3次×5 min,加入1 ml Trizol试剂,室温放置5 min后加入200 μl氯仿,放入涡旋振荡器振荡30 s,4℃条件下12 000 r/min转速离心15 min,吸取上清置于另一无菌无酶的1.5 ml离心管中,加入等体积异丙醇后放入涡旋振荡器振荡30 s,冰上放置5 min后,4℃条件下12 000 r/min转速离心10 min,弃上清,加入75%乙醇洗涤离心管底的RNA沉淀,洗涤2次,将离心管置于超净工作台晾干,加入20~40 μl DEPC水溶解(根据RNA量多少而定),经分光光度计测定RNA浓度,A260/A280在1.8~2.0之间为质量较好。根据RNA反转录试剂盒将RNA反转录合成cDNA。以cDNA为模板进行qRT-PCR反应,反应体系为20 μl:SYBR PCR Master mix 10 μl,正反向引物各0.4 μl,cDNA模板2 μl,无RNase水7.2 μl。反应程序设定为95℃ 5 min循环1次,95℃变性15 s,60℃退火60 s,72℃延伸30 s,共循环40次。反应结束后根据样本阈值Ct值,取3个复孔的平均值为该样本Ct值,计算△Ct值(目的基因Ct值与内参基因Ct值的差值)与△△Ct值(目的基因△Ct值与内参基因△Ct值的差值),以2-ΔΔCt法计算目的基因相对表达量。
1.2.3Western印迹检测KPNA2、CyclinD1、p21、p27、MMP-2、MMP-9、MMP-14蛋白表达 胶质瘤细胞株、正常胶质细胞株及转染后各组对数生长期的胶质瘤U251细胞,加入RIPA裂解缓冲液(1 ml RIPA、1%PMSF、0.1%抑肽酶)提取细胞总蛋白,用BCA法检测蛋白浓度,取蛋白样本进行10%SDS-PAGE电泳分离蛋白,将分离的蛋白凝胶转移至PVDF膜,加入5%脱脂牛奶封闭1 h,室温下依次加入KPNA2、CyclinD1、p21、p27、MMP-2、MMP-9、MMP-14蛋白一抗(稀释倍数1∶1 000),4℃条件下摇晃孵育24 h,TBST洗涤3次,加入IgG二抗(稀释倍数1∶3 000),将一抗反应膜放入二抗中,置于室温下避光孵育1 h,滴加ECL显影,暗室中曝光,凝胶分析系统及Quantity one软件检测条带灰度值,以目的蛋白条带与内参条带灰度值的比值表示目的蛋白相对表达量。
1.2.4细胞增殖实验 MTT检测细胞增殖的主要原理为:活细胞中琥珀酸脱氢酶可促使MTT分解而产生蓝色结晶状甲臜颗粒,其具有不溶于水的特性并可在细胞内及细胞周围沉积,蓝色颗粒数量与细胞活力呈正比,而二甲基亚砜(DMSO)又可溶解蓝色颗粒物,通过酶标仪检测OD值可确定细胞增殖速率。收集对数生长期胶质瘤U251细胞,用胰蛋白酶消化细胞制备单细胞悬液,以每孔2×103个细胞的密度接种于96孔板,100 μl/孔,每组均设置5个复孔,在转染后第24、48、72小时各取一组细胞,每孔分别加入20 μl MTT溶液(浓度为5 mg/ml),继续培养4 h后弃培养液,分别在每孔加入150 μl的DMSO溶液,继续培养2 h,选取波长为490 nm置于酶标仪检测各孔OD值。
1.2.5Transwell小室细胞迁移及侵袭实验 细胞迁移实验:取转染后各组对数生长期胶质瘤U251细胞,胰蛋白酶消化细胞后加入不含血清培养基制备单细胞悬液,调整细胞密度为2×105/ml,将Transwell小室置于24孔板内,上层加入100 μl单细胞悬液,下室加入含有10%FBS的DMEM培养基,置于温度为37℃、5%CO2、相对湿度95%的培养箱内继续培养8 h,取出Transwell小室,用棉签轻轻擦去微孔膜上层细胞,用4%多聚甲醛固定10 min,结晶紫染色5 min,置于光学显微镜下随机选取5个视野进行观察并计数。细胞侵袭实验:无血清DMEM培养基与基质胶以1∶8稀释比进行稀释,将100 μl基质胶稀释液平铺于Transwell小室底部的上室面,室温放置6 h后,将100 μl单细胞悬液加入Transwell小室的上室,细胞继续培养24 h,其余步骤与细胞迁移实验相同,实验均设置3次重复,取平均值表示实验结果。
1.2.6双荧光素酶报告基因实验 应用靶基因软件预测miR-519d-3p的靶基因,发现KPNA2基因可能为miR-519d-3p潜在的靶基因。预测miR-519d-3p调控KPNA2基因的结合序列,设计合成KPNA2的3′UTR序列与突变后KPNA2的3′UTR序列,将合成的目的基因片段分别克隆入双荧光素酶报告基因字啊提,构建KPNA2的3′UTR双荧光素酶报告基因野生型载体(WT-KPNA2)及其突变型载体(MUT-KPNA2)。用PCR电泳及基因测序等技术鉴定证明重组载体构建成功。参照Lipofectamine2000转染试剂分别将WT-KPNA2、MUT-KPNA2与miR-519d-3p mimics或miR-519d-3p的阴性对照(NC)共转染入胶质瘤U251细胞,利用双荧光素酶检测试剂盒检测其荧光素酶活性。

2 结 果
2.1miR-519d-3p和KPNA2在胶质瘤细胞和正常胶质细胞中的表达 与正常胶质细胞株SVGp12比较,胶质瘤细胞株U251、U87、T98G中miR-519d-3p的表达水平均显著降低(P<0.05),而KPNA2 mRNA的表达水平均显著升高(P<0.05),其中胶质瘤U251细胞中miR-519d-3p的表达水平较其他胶质瘤细胞株相对降低,而KPNA2 mRNA的表达水平相对升高,因此后续研究选用胶质瘤U251细胞为研究细胞。相较于正常胶质细胞株SVGp12,胶质瘤细胞株U251、U87、T98G中KPNA2的蛋白表达水平显著升高(P<0.05)。见图1,表1。

图1 KPNA2蛋白表达

表1 miR-519d-3p和KPNA2在胶质瘤细胞和正常胶质细胞中的表达
2.2miR-519d-3p过表达对胶质瘤细胞U251增殖的影响 转染miR-519d-3p mimics的胶质瘤U251细胞中miR-519d-3p的表达水平显著高于转染阴性对照序列的miR-NC组(P<0.05),提示成功升高胶质瘤U251细胞中miR-519d-3p的表达水平,见表2。转染miR-519d-3p mimics的胶质瘤U251细胞在转染后48 h、72 h后OD值显著高于miR-NC组(P<0.05),表明miR-519d-3p过表达可显著抑制胶质瘤细胞增殖。相较于miR-NC组,miR-519d-3p组胶质瘤U251细胞中CyclinD1蛋白表达水平显著降低(P<0.05),而p21、p27蛋白表达水平均显著升高(P<0.05),表明miR-519d-3p过表达可通过上调p21、p27蛋白表达及下调CyclinD1蛋白表达进而抑制胶质瘤细胞增殖,见图2,表2。
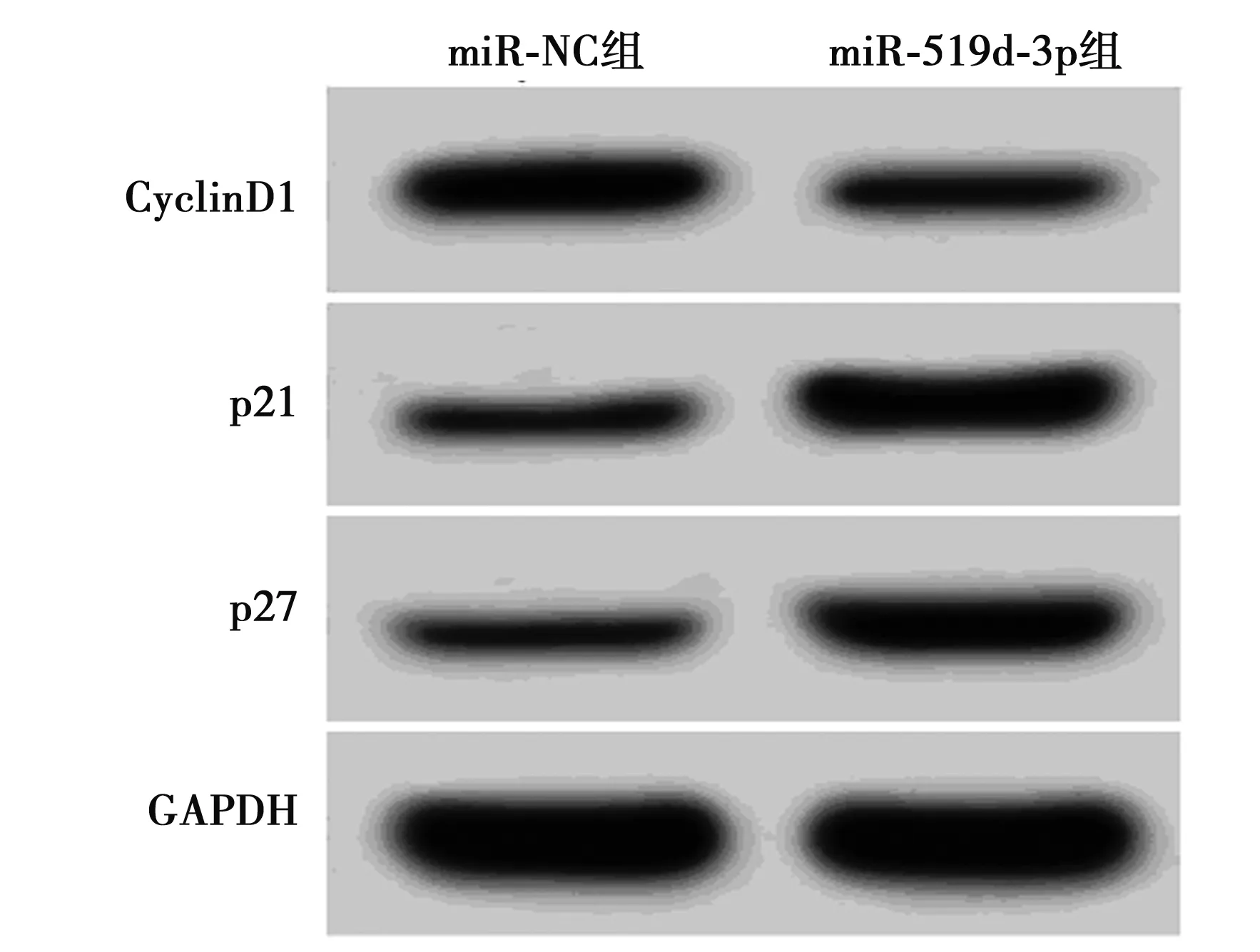
图2 增殖相关蛋白表达

表2 miR-519d-3p过表达对胶质瘤细胞U251增殖的影响
2.3miR-519d-3p过表达对胶质瘤细胞U251迁移、侵袭的影响 miR-519d-3p组胶质瘤U251细胞迁移及侵袭数均显著少于miR-NC组(P<0.05),见表3,表明miR-519d-3p过表达可显著降低胶质瘤细胞迁移及侵袭能力。miR-519d-3p组胶质瘤U251细胞中MMP-2、MMP-9、MMP-14蛋白表达水平较miR-NC组显著降低(P<0.05),见表3,图3、图4。表明miR-519d-3p过表达可通过下调MMP-2、MMP-9、MMP-14蛋白表达进而抑制胶质瘤细胞迁移及侵袭。

表3 miR-519d-3p过表达对胶质瘤细胞U251迁移、侵袭的影响

图3 两组迁移侵袭相关蛋白表达

图4 miR-519d-3p过表达对胶质瘤细胞U251迁移、侵袭的影响(×200)
2.4抑制KPNA2表达对胶质瘤细胞增殖、迁移和侵袭的影响 转染si-KPNA2的胶质瘤U251细胞中KPNA2的蛋白表达水平显著降低(P<0.05),见图5、表4,提示成功降低胶质瘤细胞中KPNA2的高表达。si-KPNA2组胶质瘤U251细胞增殖活性与si-NC组比较显著降低(P<0.05),迁移及侵袭细胞数与si-NC组比较均显著减少(P<0.05),表明抑制KPNA2表达可显著抑制胶质瘤细胞增殖、迁移及侵袭。与si-NC组比较,si-KPNA2组胶质瘤U251细胞中CyclinD1、MMP-2、MMP-9蛋白表达水平均显著降低(P<0.05),而p21的蛋白表达水平显著升高(P<0.05),表明抑制KPNA2表达可通过上调p21表达及下调CyclinD1、MMP-2、MMP-9表达进而抑制胶质瘤细胞增殖、迁移及侵袭。见图5,表4。

图5 KPNA2蛋白和增殖、迁移侵袭相关蛋白表达

表4 抑制KPNA2表达对胶质瘤细胞增殖、迁移和侵袭的影响
2.5miR-519d-3p靶向调控KPNA2的表达 通过生物信息学分析发现KPNA2基因的3′UTR存在miR-519d-3p的结合位点,且结合稳定性较好,其互补结合序列见图6A。双荧光素酶报告基因实验结果显示,转染克隆有KPNA2基因的3′UTR突变型载体质粒(MUT-KPNA2)中,共转染miR-519d-3p mimics与转染阴性对照(miR-NC)比较荧光素酶活性比较差异不显著(P>0.05);转染克隆有KPNA2基因的3′UTR载体质粒(WT-KPNA2)中,共转染miR-519d-3p mimics的荧光素酶活性较共转染miR-NC的荧光素酶活性明显降低(P<0.05),见表5。表明miR-519d-3p与KPNA2存在结合位点,并可调控KPNA2的活性。如图6B所示,与miR-NC组(0.63±0.06)比较,miR-519d-3p组胶质瘤U251细胞中KPNA2的蛋白表达水平显著降低(0.26±0.03,P<0.05);与anti-miR-NC组(0.61±0.05)比较,anti-miR-519d-3p组胶质瘤U251细胞中KPNA2的蛋白表达水平显著升高(0.92±0.09,P<0.05),表明miR-519d-3p可负向调控靶基因KPNA2的表达。

A:KPNA2的3′UTR中含有与miR-519d-3p互补的核苷酸序列;B:KPNA2蛋白表达,1~4:miR-NC组、miR-519d-3p组、anti-miR-NC组、anti-miR-519d-3p组图6 miR-519d-3p靶向调控KPNA2的表达

表5 双荧光素酶报告实验
2.6KPNA2过表达逆转了miR-519d-3p过表达对胶质瘤细胞U251增殖、迁移和侵袭的作用 如图7、表6所示,相较于miR-519d-3p+pcDNA组,miR-519d-3p+pcDNA-KPNA2组胶质瘤U251细胞OD值显著增加,迁移及侵袭细胞数均显著增多(P<0.05),CyclinD1、MMP-2、MMP-9蛋白表达水平均显著升高,而p21的蛋白表达水平显著降低(P<0.05)。表明KPNA2过表达可部分逆转miR-519d-3p过表达对胶质瘤细胞增殖、迁移及侵袭的抑制作用。

1~4:miR-NC组、miR-519d-3p组、miR-519d-3p+pcDNA组、miR-519d-3p+pcDNA-KPNA2组图7 KPNA2蛋白和增殖、迁移侵袭相关蛋白表达

表6 KPNA2过表达逆转了miR-519d-3p过表达对U251增细胞殖、迁移和侵袭的作用
3 讨 论
胶质瘤具有浸润性生长等特点,临床常采用手术及放疗或放疗等手段进行治疗,但手术治疗效果较差,因此深入探究胶质瘤发生及进展机制对寻找新治疗方法具有重要意义〔9〕。miR是一类内源性非编码小RNA分子,其可调节应激反应、细胞分化、增殖、侵袭及凋亡等多种生物学过程〔10〕。miR可通过与靶基因的结合而抑制靶基因翻译进而抑制其表达,而靶基因又可调控细胞增殖及侵袭等生物学行为〔11〕。因此,深入探究miRNA及其靶基因在胶质瘤发生及发展过程中的作用机制对研发胶质瘤治疗药物具有重要指导意义。
miR-519d在喉鳞癌细胞中呈低表达,上调miR-519d表达可通过抑制转录激活子(STAT)3表达进而抑制细胞增殖并诱导细胞凋亡〔12〕。miR-519d在胰腺癌细胞中表达水平降低并可促进胰腺癌细胞增殖及侵袭,提示上调miR-519d表达可能抑制胰腺癌细胞增殖及侵袭〔13〕。miR-519d表达水平升高可能通过抑制XIAP基因表达进而抑制卵巢癌细胞增殖最终抑制卵巢癌生长〔14〕。相关研究报道指出miR-519d-3p可抑制宫颈癌细胞增殖并促进细胞凋亡〔15〕。本研究结果说明miR-519d-3p在胶质瘤发生及发展过程中可能发挥抑癌基因作用,U251细胞过表达可抑制胶质瘤细胞增殖、迁移及侵袭。p21是CDK2抑制剂且可作为胶质瘤细胞周期相关的泛素-蛋白酶体通路靶蛋白,p27是细胞周期蛋白D-CDK4等的负性调节因子,通过抑制CyclinD1蛋白表达及促进p21、p27蛋白表达可诱导胶质瘤细胞周期停滞于G1期,抑制胶质瘤细胞增殖〔16,17〕。本研究结果提示miR-519d-3p 过表达后可通过促进p21、p27蛋白表达及抑制CyclinD1蛋白表达进而抑制胶质瘤细胞增殖。MMPs类是一种降解细胞外基质蛋白的酶,其中MMP-2、MMP-9、MMP-14是基质金属蛋白酶中的重要酶类,期可通过降解血管周围基膜中层黏连蛋白及纤连蛋白等进而促进肿瘤细胞向周围组织浸润导致细胞转移及侵袭〔18,19〕。本研究结果提示miR-519d-3过表达后可通过抑制MMP-2、MMP-9、MMP-14蛋白表达进而抑制胶质瘤细胞迁移及侵袭。KPNA2位于人染色体17q23-q24,可参与细胞分化、免疫反应及细胞增殖凋亡等多种生理病理过程,近来研究发现KPNA2可参与肿瘤发生及发展过程〔20〕。乳腺癌细胞中KPNA2表达水平升高并可促进肿瘤细胞增殖及迁移,沉默KPNA2表达后乳腺癌细胞增殖能力明显降低〔21〕。表明KPNA2高表达可促进乳腺癌细胞恶性转化进程进而促进乳腺癌发生及发展。进一步研究发现敲低KPNA2表达可通过上调E-cadherin表达及下调Vimentin表达而抑制EMT转化进程进而抑制卵巢癌细胞迁移及侵袭,同时在体内实验证明微小RNA-26b(microRNA-26b,miR-26b)可通过抑制KPNA2表达进而抑制卵巢癌生长〔22〕。相关研究表明原发性肠癌组织中KPNA2的表达水平显著高于癌旁组织,KPNA2高表达于结肠癌患者高分化程度、发生淋巴结转移等呈明显正相关,并可作为结肠癌患者预后的独立预测因子,同时在裸鼠移植瘤中敲低KPNA2表达可明显抑制肿瘤细胞增殖及克隆形成能力〔23〕。本研究结果说明抑制KPNA2表达可有效抑制胶质瘤细胞增殖、迁移及侵袭,同时本研究提示miR-519d-3p可通过抑制靶基因KPNA2表达而抑制胶质瘤细胞增殖、迁移及侵袭。
综上所述,miR-519d-3p在胶质瘤细胞中呈低表达,KPNA2表达上调,上调miR-519d-3p表达可通过靶向抑制KPNA2表达进而减弱胶质瘤细胞增殖、迁移及侵袭能力,其可能作用机制与上调p21蛋白表达及下调CyclinD1、MMP-2、MMP-9蛋白表达有关,miR-519d-3p可能作为治疗胶质瘤的潜在靶点。但miR-519d-3p在体内实验中的表达如何及其可能作用机制仍需深入研究。
