不同特征患者胚胎植入前遗传学检测结果和治疗结局分析
2020-08-25杨小璇王菁沈鉴东谢佳孜崔毓桂刘嘉茵吴畏
杨小璇,王菁,沈鉴东,谢佳孜,崔毓桂,刘嘉茵,吴畏
(南京医科大学第一附属医院生殖医学中心,南京 210000)
在备孕夫妇中,有20%面临不孕困扰,其中约三分之一的病例由男性因素引起[8-9]。男性精子DNA碎片指数(DNA fragmentation index,DFI)作为传统精液分析的补充,具有较强的稳定性,是预测男性生育力有价值的指标[10-11]。研究发现DFI可能对胚胎非整倍体的发生具有潜在影响[12]。
本研究对行PGT助孕患者进行多种组间分类,分析不同类型患者染色体异常率及胚胎异常率的差异及妊娠结局,为深入理解胚胎染色体异常的发生提供思路,为PGT技术应用人群的选择提供临床依据。
材料与方法
一、研究对象及分组
回顾性分析2011年6月至2019年12月于本中心行PGT助孕的1 602个取卵周期及对应的复苏周期。其中有1 066个周期进行了DFI检测。
1.根据夫妇双方是否有染色体核型异常分组:(1)夫妇双方染色体核型均正常的分为:有复发性流产病史(PGT-A)组和无复发性流产史但有遗传病生育风险(PGT-M)组。(2)夫妇双方至少一方染色体核型异常的,根据染色体核型分为普通易位组和罗氏易位组。再根据染色体易位发生的性别差异分组:普通易位组中,易位发生在女方为A组、易位发生在男方为B组;罗氏易位组中,易位发生在女方为C组、易位发生在男方为D组。
2.根据精子DFI检测结果,以20%为临界值分为低DFI组和高DFI组。
二、研究方法
1.促排卵方案:所有患者均采用合适的促排卵方案。当主导卵泡的直径达到18 mm左右,注射人绒毛膜促性腺激素(HCG),36 h后阴道超声引导下行取卵术。使用精子染色质结构分析(sperm chromatin structure assay,SCSA)作为DFI检测方法。
2.胚胎检测:使用微阵列-比较基因组杂交(array-based comparative genomic hybridiza-tion,aCGH)或二代测序技术(next-generation sequencing,NGS)进行囊胚活检或卵裂球活检。胚胎异常率=非整倍体胚胎数目/活检胚胎数目;染色体异常率=非整倍体胚胎的异常染色体总条数和/(活检胚胎数目×46)。MⅡ受精率=受精卵数/MⅡ卵子数;卵裂率=发生卵裂的受精卵数/总受精卵数;D3胚胎形成率=形成D3胚胎数/发生卵裂的受精卵数;囊胚形成率=形成囊胚数/D3胚胎数。
3.妊娠结局随访:移植后2周随访血清β-HCG,β-HCG>25 U/L时为HCG阳性,停经50 d左右行阴道超声检查,记录宫腔孕囊数目和心管搏动确定临床妊娠;停经70 d第二次阴道超声检查了解胚胎发育情况;后期电话随访流产或活产情况。HCG阳性率=HCG阳性周期数/取卵周期数;累积妊娠率=临床妊娠周期数/取卵周期数;流产率=流产周期数/临床妊娠周期数;累积活产率=活产数/临床妊娠周期数。
养殖场卫生环境较差,通风不良,粪便不能及时清理,湿度较大,导致虫卵生长发育,也有利于螨虫的寄生活动。因此,要高度重视养殖舍卫生环境控制,强化养殖舍通风换气,减少成虫寄生场所,控制养殖舍内害虫密度,一旦鹅群出现不安现象,应该及时查明原因,及时采用药物消灭成虫,将病情控制在萌芽阶段,将损失降低到最小程度。
三、统计学分析

结 果
一、PGT-A组和PGT-M组一般资料、实验室指标和妊娠结局比较
PGT-A组纳入308个周期,检测1 174枚胚胎;PGT-M组纳入108个周期,检测338枚胚胎。两组在女方年龄、男方年龄、女方体重指数(BMI)、血清基础FSH、基础LH和抗苗勒管激素(AMH)水平方面,差异均无统计学意义(P>0.05)(表1)。
与PGT-M组相比较,PGT-A组的D3胚胎形成率、囊胚形成率显著降低(P<0.05);染色体异常率、胚胎异常率显著升高(P<0.01)。单次取卵周期中,PGT-A组的累积妊娠率显著降低,流产率显著升高(P<0.05)。两组累积活产率差异无统计学意义(P>0.05)(表2)。PGT-A组和PGT-M组分别有26例和12例仍在继续妊娠中。

表1 PGT-A组与PGT-M组基础情况比较(-±s)
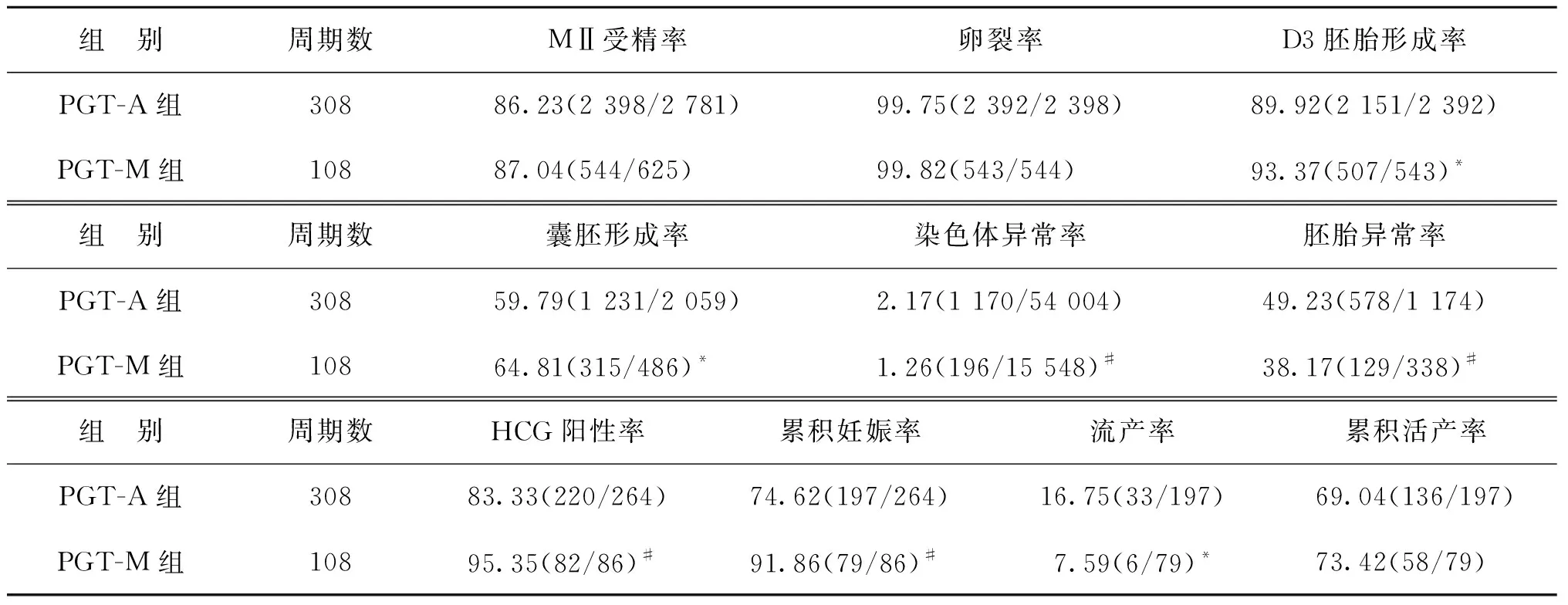
表2 PGT-A组与PGT-M组实验室指标及妊娠结局比较(%)
二、普通易位组和罗氏易位组的一般资料、实验室指标和妊娠结局比较
1.总体比较:普通易位组纳入829个周期,检测胚胎3 600枚;罗氏易位组纳入357个周期,共检测胚胎1 595枚。两组在女方年龄、男方年龄、女方体重指数(BMI)、血清基础FSH、基础LH和AMH水平方面,差异均无统计学意义(P>0.05)(表3)。

表3 普通易位组与罗氏易位组基础情况比较(-±s)
两组卵裂率、D3胚胎形成率差异无统计学意义(P>0.05)。与罗氏易位组相比较,普通易位组的囊胚形成率显著降低,染色体异常率和胚胎异常率显著升高(P<0.01),HCG阳性率和累积妊娠率均显著降低(P均<0.05)。单次取卵周期,两组妊娠结局的差异无统计学意义(P>0.05)(表4)。普通易位组和罗氏易位组分别有53例和22例仍在继续妊娠中。
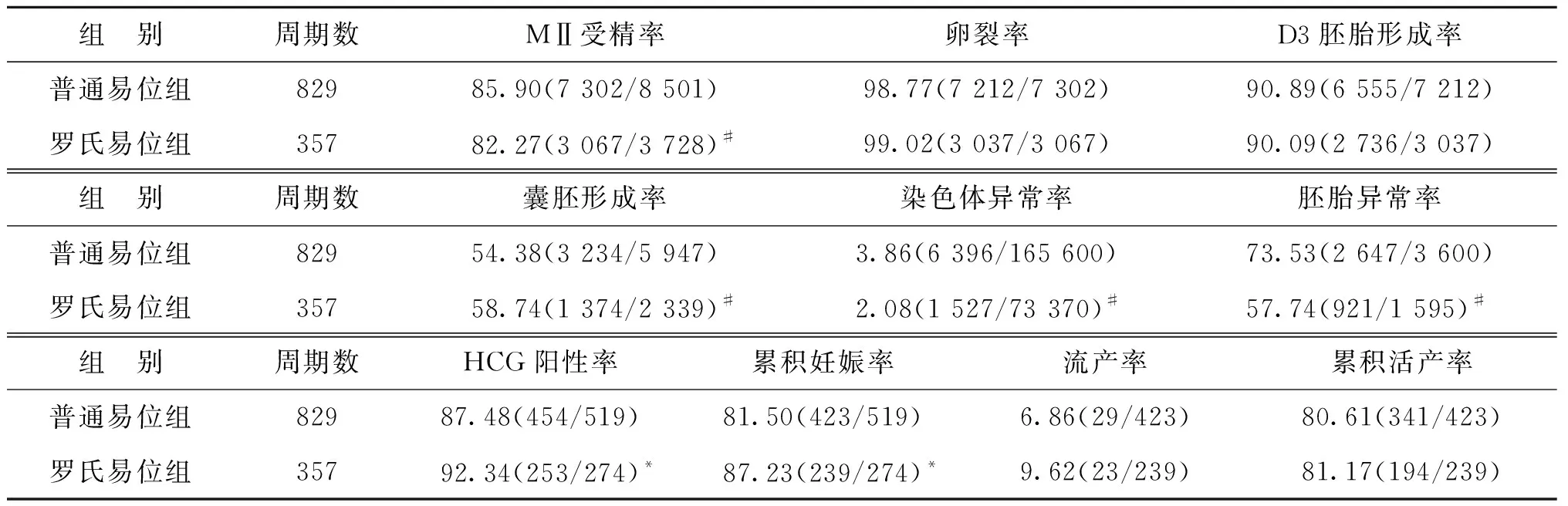
表4 普通易位组与罗氏易位组实验室指标及妊娠结局比较(%)
2.易位发生性别亚组比较:A组纳入387个周期、检测胚胎1 698枚,B组纳入442个周期、检测胚胎1 902枚,C组纳入145个周期、检测胚胎669枚,D组纳入212个周期、检测胚胎926枚。A组与B组进行比较、C组与D组进行比较。在女方年龄、男方年龄、女方体重指数(BMI)、血清基础FSH、基础LH和AMH水平方面,组间差异均无统计学意义(P>0.05)(表5)。与B组相比较,A组的卵裂率显著降低(P<0.05);与D组相比较,C组的D3胚胎形成率显著降低(P<0.05)。其他实验室指标的组间差异均无统计学意义(P>0.05)(表6)。

表5 易位发生性别亚组基础情况比较(-±s)

表6 易位发生性别亚组实验室指标比较(%)
三、低DFI组和高DFI组一般资料、实验室指标和妊娠结局比较
低DFI组纳入890个周期、检测3 669枚囊胚,高DFI组纳入176个周期、检测651枚囊胚。两组在女方BMI、血清基础FSH和基础LH方面,差异无统计学意义(P>0.05)。低DFI组的双方年龄均低于高DFI组,差异有统计学意义(P<0.01)(表7)。与高DFI组相比,低DFI组受精率显著升高(P<0.05),染色体异常率和胚胎异常率显著降低(P<0.05,P<0.01),两组囊胚形成率、累积妊娠率、累积活产率差异无统计学意义(P>0.05)(表8)。

表7 低DFI组与高DFI组基础情况比较(-±s)
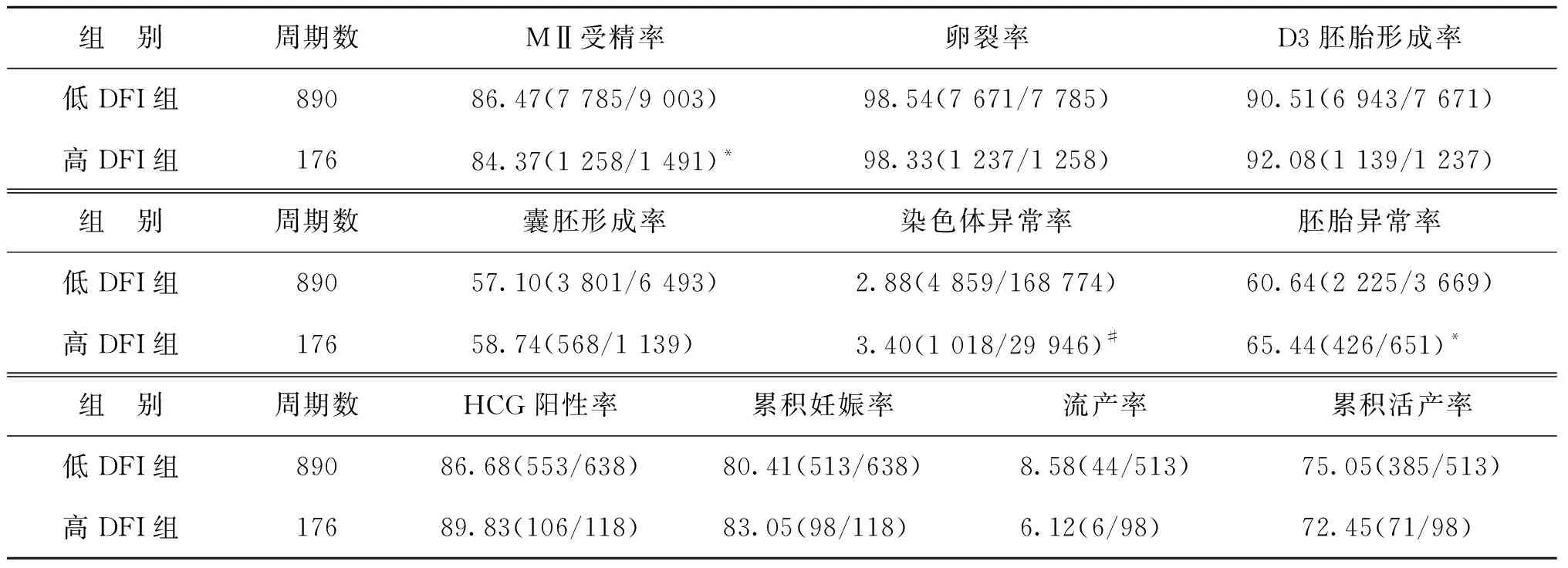
表8 低DFI组与高DFI组实验室指标及妊娠结局比较(%)
四、DFI和异常率的偏相关性分析
线性相关分析表明,DFI与染色体异常率、胚胎异常率之间有正相关关系(r=0.109,P<0.01;r=0.063,P<0.05)。男方年龄与DFI之间有正相关关系(r=0.133,P<0.01)。采用偏相关分析,控制双方年龄变量,分析DFI与染色体异常率呈正相关(r=0.105,P<0.01),与胚胎异常率不相关(r=0.057,P>0.05)(表9)。
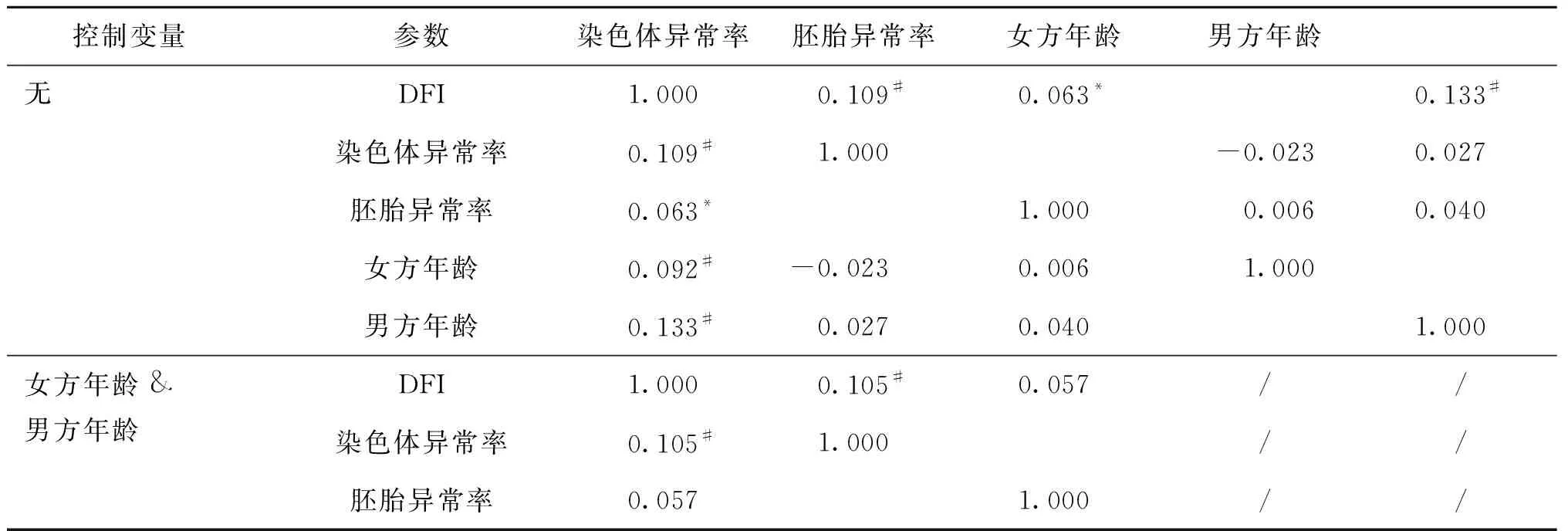
表9 精子DFI与异常率的偏相关分析
讨 论
生殖细胞染色体发生的随机错误导致散发的自然流产标本中有50%~70%表现出某种细胞遗传异常,最常见的核型是常染色体三体(60%),X染色体单体(20%)和多倍体(20%)。无论夫妇双方是否有反复妊娠丢失(RPL)病史,妊娠时均会受到这种错误的影响[13]。本研究中选择夫妇双方染色体核型正常进行单基因疾病诊断的PGT-M做对照组,其胚胎染色体仍有一定的异常率,证明了这一点。双方年龄是配子及胚胎形成过程中非整倍体发生的重要影响因素。PGT-A组和PGT-M组的年龄等基础情况差异无统计学意义,PGT-A组的D3胚胎形成率和囊胚形成率低于PGT-M组,而染色体异常率和胚胎异常率显著升高,可见有复发性流产(RSA)病史的夫妇更难获得胚胎,且胚胎更容易发生染色体异常,证实了对反复妊娠丢失人群进行非整倍体筛查的必要性。本研究中,PGT-A组和PGT-M组的夫妇均选择整倍体胚胎移植,虽然累积活产率的差异无统计学意义,但PGT-A组累积妊娠率仍较PGT-M组低,而流产率高,说明除染色体异常因素外,RSA病史夫妇还受到其它流产危险因素的影响,PGT-A对其妊娠结局的改善效果有限,这与之前的报道一致[14-17]。
普通相互易位携带者较罗氏易位携带者更难获得胚胎,且胚胎染色体异常率更高,累积妊娠率更低。而两组流产率、累积活产率的差异无统计学意义,说明PGT-SR能够通过移植正常/平衡胚胎改善染色体异常因素导致的不良妊娠结局[18]。普通易位组和罗氏易位组分别表现出易位发生在女方时卵裂率和D3胚胎形成率更低,而其他实验室指标和胚胎异常率差异无统计学意义,说明卵母细胞染色体异常可能影响受精卵形成后的早期胚胎发育,而获得正常胚胎的概率与易位发生在男方或女方无关[19]。
很大一部分精液正常的男性也表现出精子非整倍体增加,提示仅依靠常规精液参数无法鉴别出大部分处于精子非整倍体风险中的不育男性[12]。使用SCSA检测精子DFI,其与精子总数、浓度、活力及前向运动百分率呈负相关关系[20-21],在评估男性生育潜力方面更有临床价值[9]。男方高龄对生殖结局有负面影响,包括延长受孕时间、增加胚胎移植失败率、影响活产结局等[22-23],甚至与孩子的自闭症、精神分裂症及某些类型染色体病的发生相关[24-25]。并非总能观察到所有的常规精液参数随年龄增加同时出现负性变化[26-27],而精子DNA碎片的增加对年龄具有依赖性[9,26,28-29]。本研究在选择PGT助孕患者中也发现了DFI与男性年龄呈正相关,控制双方年龄变量,分析DFI与染色体异常率仍呈正相关,而与胚胎异常率不相关。低DFI组与高DFI组的累积妊娠率及妊娠结局差异无统计学意义。这说明精子DNA碎片的增加使异常胚胎的染色体组成更加混乱,但未显著增加异常胚胎的数量,未达到影响更多胚胎的程度,可能与PGT均采取卵胞浆内单精子注射(ICSI)的受精方式有关,这与一些关于精子DFI和IVF妊娠结局没有相关性的研究结果相一致[30-32]。此外,高DFI组患者的纳入人数较少也可能影响妊娠结局的分析,需要更大样本量的研究。
本研究通过分析不同特征人群的PGT治疗周期,探索复发性流产史、染色体易位、精子DFI等影响胚胎染色体组成并可能预测临床治疗结局的因素,评估PGT对不同人群妊娠结局的益处,为理解胚胎染色体异常的发生提供思路,为高危人群相关临床指标的筛查及PGT的合理选择提供依据。
