重症急性胰腺炎并发感染的危险因素及对机体免疫水平的影响
2020-08-25谢蕾刘航申洋李金枝赵天霞
谢蕾 刘航 申洋 李金枝 赵天霞
1四川德阳市人民医院核医学科,德阳 618000;2四川德阳市人民医院急性胰腺炎中心,德阳 618000;3四川德阳市人民医院消化内科,德阳 618000;4四川德阳市人民医院呼吸内科,德阳 618000
SAP常并发感染,导致患者出现器官功能衰竭及休克等不良结局[1]。临床统计表明[2-3],60%以上SAP的死因是继发性感染,降低并发感染的风险是临床治疗SAP患者的重点干预措施。感染与机体的免疫系统紊乱有着密切的关系,但有关SAP患者免疫水平的研究较少[4-6]。因此本研究分析SAP并发感染的病原学分布、并发感染的危险因素、血炎症因子水平和T淋巴细胞亚群变化,以期提高对SAP并发感染防治的认知。
资料与方法
一、入组患者及分组
以2018年2月至2019年4月间四川德阳市人民医院急性胰腺炎中心收治的150例SAP患者作为研究对象,其中90例并发感染(感染组),60例未并发感染(未感染组)。感染组患者中女性54例,男性36例,年龄40~65岁,平均59岁;未感染组患者中女性38例,男性22例,年龄38~66岁,平均60岁。感染组与未感染组患者的性别、年龄等基线差异无统计学意义(P>0.05),具有可比性。排除恶性肿瘤、脏器性疾病、妊娠期、免疫性疾病等患者。本研究经医院伦理委员会批准,所有患者及家属均签署知情同意协议书。
二、诊断标准及治疗
SAP诊断符合我国制定的急性胰腺炎诊治指南的标准[7]。SAP并发感染的诊断标准:(1)腹部症状为腹痛,肠鸣音消失,腹部压痛、反跳痛以及肌肉紧张等;(2)腹腔脓液、胰腺病灶组织的病原微生物培养为阳性;(3)影像学检查示胰腺病灶区域出现气泡征;(4)出现全身炎症反应综合征。满足以上临床表现中的3项即可诊断为SAP并发感染。
所有患者均采取禁食水、补液、抑胰酶分泌、抑酸、肠胃减压、营养支持等治疗。肾衰竭者给予连续性血液净化治疗,呼吸衰竭者给予气管插管治疗,待胰腺功能逐渐恢复后给予肠内营养治疗,部分患者转外科手术治疗。
三、方法
1.病原微生物检验:根据《全国临床检验操作规程》对致病微生物进行分离鉴定,根据MicroScan微生物鉴定系统对病原菌进行分析。
2.并发感染的影响因素:对患者年龄、性别、病因、全肠外营养时间、APACHEⅡ评分、外科干预、机械通气、连续性血液净化治疗、低氧血症等项进行单因素分析。
3.炎症因子:采集SAP患者发病24 h、30 d静脉血样本,由医院检验科采用ELISA法测定血IL-4、IL-6、IL-10、TNF-ɑ水平,按试剂盒说明书操作。
4.T淋巴细胞亚群检测:采集SAP患者发病24 h、30 d空腹静脉血,由医院检验科采用流式细胞仪(型号:DxFLEX,美国贝克曼库尔特公司)检测CD4+、CD8+T淋巴细胞亚群,并计算CD4+/CD8+比值。
四、统计学处理

结 果
一、SAP并发感染的病原菌分布
90例SAP并发感染患者共检出105株病原菌,其中74株(70.5%)为革兰阴性菌,包括大肠埃希菌28株(26.7%)、肺炎克雷伯菌22株(21.0%)、铜绿假单胞菌14株(13.3%)、阴沟肠杆菌4株(3.8%)、产酸克雷伯菌3株(2.9%)和鲍氏不动杆菌3株(2.9%);27株(25.7%)为革兰阳性菌,包括金黄色葡萄球菌12株(11.4%)、D群链球菌7株(6.7%)、表皮葡萄球菌4株(3.8%)、粪肠球菌2株(1.9%)和屎肠球菌2株(1.9%);4株(3.8%)为真菌,包括光滑假丝酵母菌2株(1.9%)和白色念珠菌2株(1.9%)。
二、SAP并发感染的单因素分析
单因素分析结果表明,胆源性、全肠外营养时间≥1周、APACHEⅡ评分≥11分、外科干预、机械通气是SAP并发感染的危险因素,而患者的年龄、性别、连续性血液净化治疗、低氧血症与感染发生无明显相关性(表1)。
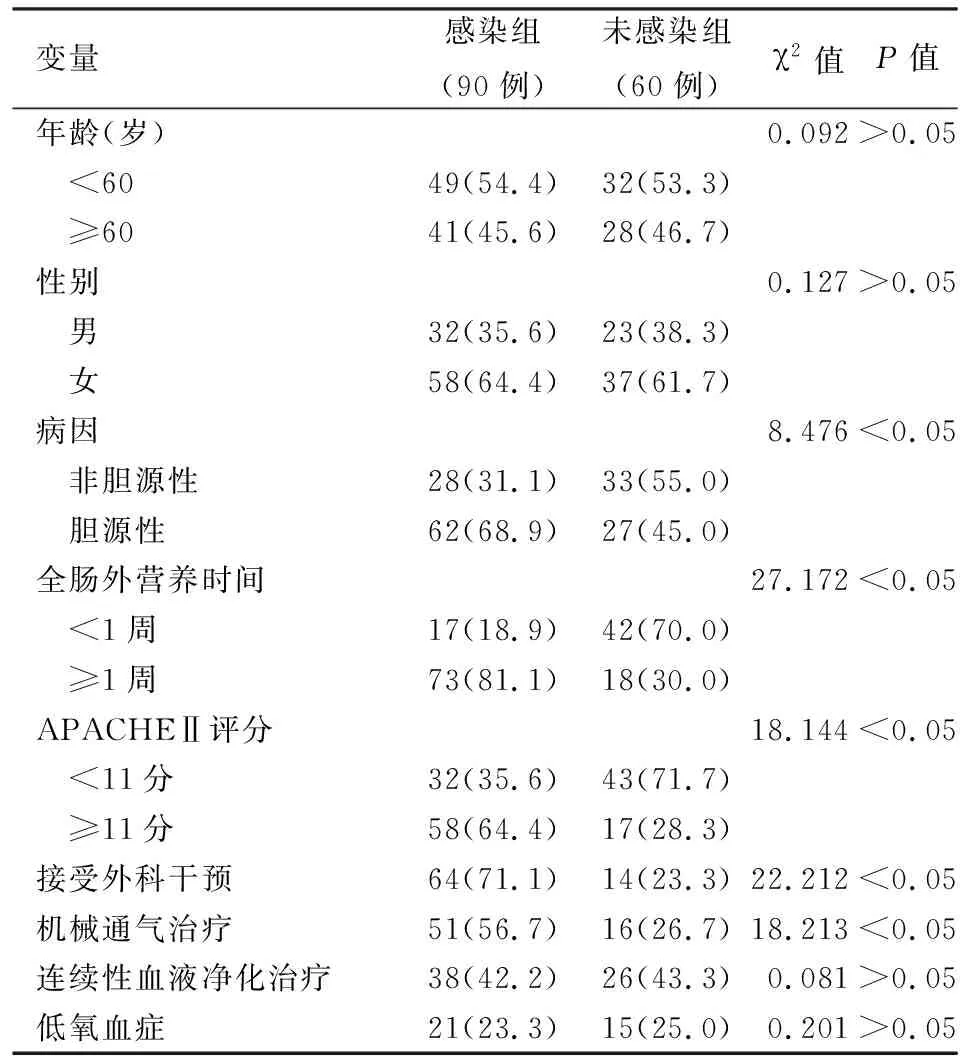
表1 重症急性胰腺炎患者并发感染的单因素分析[例(%)]
三、血IL-4、IL-6、IL-10、TNF-ɑ水平的变化
发病24 h,感染组患者血IL-4、IL-6、IL-10、TNF-ɑ水平显著高于未感染组;发病30 d,感染组患者血IL-4、IL-6、IL-10、TNF-ɑ水平显著低于未感染组,差异均有统计学意义(P值均<0.05,表2)。
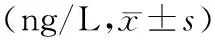
表2 感染组与未感染组重症急性胰腺炎患者发病后24 h、30 d时血炎症因子水平变化
四、T淋巴细胞亚群分析
发病24 h,感染组CD4+T淋巴细胞占比显著高于未感染组,而CD8+T淋巴细胞占比显著低于未感染组;发病30 d,感染组CD4+T淋巴细胞占比显著低于未感染组,而CD8+T淋巴细胞占比显著高于未感染组(表3)。
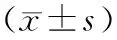
表3 感染组与未感染组重症急性胰腺炎患者发病后24 h、30 d T淋巴细胞亚群占比
讨 论
SAP早期因炎症反应导致肠黏膜屏障功能损伤,肠道细菌易位,同时机体免疫力降低,最终发生腹腔感染,严重者甚至可发生全身感染,诱发器官功能衰竭。此外,外科操作、胆道感染等也会导致腹腔感染。腹腔感染的病原菌主要为革兰阴性菌[8-10]。
本研究结果表明,70.5%的腹腔感染菌为革兰阴性菌,25.7%为革兰阳性菌。革兰阳性菌均为球菌属,可能与侵入性操作、外科操作等有关。本组真菌感染率低,但近年来临床观察发现真菌感染比例呈增长趋势[4],这可能与抗生素的使用有关。针对不明病因发热、抗生素等无效患者应注意是否发生真菌感染。此外,本研究90例SAP并发感染患者共检出105株病原菌,这表明感染具有多重性。
单因素分析结果表明,胆源性病因、APACHEⅡ评分≥11分、全肠外营养时间≥1周、机械通气治疗以及外科干预是导致SAP患者并发感染的独立危险因素(P值均<0.05)。胆道感染本身就存在细菌,造成腹腔感染的风险较大。APACHEⅡ评分可评估患者生理、健康状态,评分越高病情越严重,故发生腹腔感染的概率也增加。肠外营养时间延长会影响肠道黏膜上皮细胞的修复与生长,延缓肠屏障功能的恢复,因此可增加腹腔感染的风险[11-12]。机械通气治疗以及外科干预等可增加细菌污染的机会,进而增加腹腔感染的机会。
IL-6、TNF-α为促炎因子,IL-4、IL-10为抗炎因子。杜时雨等[9]报道,SAP并发感染时IL-6、TNF-α水平明显升高,同时IL-4、IL-10水平也会升高。本研究结果表明,入院24 h时感染组患者IL-4、IL-6、IL-10、TNF-α水平显著高于未感染组(P值均<0.05),与文献报道结果一致,表明SAP早期存在过度的炎症反应,且并发感染者的炎症反应更强。
现代研究认为[13],SAP并发感染分为两个阶段:第一阶段,病发诱因导致胰腺细胞出现损伤,释放大量炎症因子,从而激发机体炎症反应,此时机体免疫系统处于应激状态,促炎因子会加快胰腺细胞凋亡,持续炎症反应诱发免疫连锁反应。第二阶段,机体促炎因子不断激活,免疫水平不断下降,炎症因子最终抑制机体免疫,抗炎因子水平降低,导致患者免疫力下降,病情加重。本研究中病发30 d时感染组炎症因子水平显著低于未感染组,表明导致发病30 d后患者还未恢复至健康水平,器官还存在一定程度损伤,证实SAP感染患者在晚期发生免疫抑制现象。此外,感染组30 d时IL-6水平较24 h略高,TNF-α水平则略有降低,未感染组30 d的IL-4、IL-10水平均较24 h时升高,两组患者促炎因子、抗炎因子均未恢复正常。由于未感染组患者机体内炎症反应程度较低,免疫系统不会被抑制,而抗炎因子不断激活,因此机体内抗炎因子水平升高,而促炎因子水平会相对平稳或降低。
人体正常免疫功能是由T细胞的CD4+与CD8+细胞亚群的相互作用而维持,CD4+、CD8+细胞的百分率及它们的比值对患者免疫状态的评估具有重要的意义。本研究表明,发病24 h时感染组患者CD4+/CD8+比值显著高于未感染组,发病30 d时感染组CD4+/CD8+比值显著低于未感染组(P<0.05),这与炎症因子变化趋势一致,与罗少媚等[11]报道相符。研究结果提示,SAP早期感染组患者的免疫应答能力更强烈,导致免疫细胞的损伤较重,功能恢复缓慢,故发病30 d时细胞免疫应答能力仍低下。CD4+/CD8+比值降低提示机体免疫细胞效能减退,并促使B淋巴细胞大量增殖,进一步加重患者机体免疫损坏,增加患者外源性病原感染风险。
综上所述,SAP并发感染患者主要以革兰阴性菌为主,诱发SAP感染因素较多,应做好防治措施。SAP患者早期存在过度免疫,晚期出现免疫抑制状态,在临床治疗时应给予重视。
利益冲突所有作者均声明不存在利益冲突
