超声内镜对小胰癌的分型研究
2020-08-25周帆张松徐桂芳吕瑛彭春艳
周帆 张松 徐桂芳 吕瑛 彭春艳
南京大学医学院附属鼓楼医院消化内科,南京 210008
【提要】 回顾性分析行外科手术的13例小胰癌(≤2 cm)患者,EUS分型中肿瘤狭窄型(A3型)占大多数,而单纯扩张型(B型)及间质肿瘤型(C型)较少。EUS对小胰癌的分型可为未来胰腺癌的处理提供一定诊治思路。
胰腺癌以高侵袭性、高耐药率著称,5年生存率<6%[1-2]。既往研究表明,肿瘤长径<10 mm的患者5年生存率较肿瘤长径10~20 mm的患者明显升高(80.4%比50%)[3]。胰腺癌的诊断主要依靠增强CT和MRI,然而对小胰癌(肿瘤长径≤2 cm)的诊断仍有困难。相较于增强CT和MRI,EUS因其空间分辨率的优势对胰腺癌的诊断价值更高[4],EUS-FNA更增加了其诊断准确性。通常,在EUS下会显示胰管狭窄或扩张,其中部分病例与胰腺癌相关[5]。然而小胰癌,尤其是胰腺原位癌的EUS表现报道较少。本研究回顾性分析13例手术切除的小胰癌的临床病理资料,探讨EUS早期识别和诊断胰腺癌的价值。
一、资料与方法
1.研究对象:收集2016年1月至2019年6月间南京鼓楼医院13例行外科手术的小胰癌患者。纳入标准:年龄≥18周岁,性别不限;经手术病理确诊为胰腺癌;肿瘤长径≤2 cm。排除标准:胰腺导管内乳头状黏液性肿瘤伴上皮内瘤变者;临床内镜及病理资料缺失者;胆管癌或十二指肠壶腹部肿瘤累及胰腺者。本研究通过南京鼓楼医院伦理委员会批准。
根据国际抗癌联盟第8版肿瘤TNM分期[6],T分期中Tis为原位癌,T1a~1c期分别指肿瘤长径≤5 mm、6~10 mm、11~20 mm,T2期肿瘤局限于胰腺,长径21~40 mm,T3期肿瘤局限于胰腺,长径>40 mm,T4期肿瘤侵犯腹腔干、肠系膜上动脉和(或)肝总动脉,肿瘤大小不限。
2.EUS检查:使用奥林巴斯公司GF UE-260主机和EU-ME2的超声内镜。根据Terada等[7]的研究,基于胰管狭窄或扩张情况将小胰癌的EUS表型分为A1~A3型、B型及C型。A1型为单纯狭窄型,狭窄周围无病变;A2型为低回声狭窄型,狭窄处可见低回声病灶;A3型为肿瘤狭窄型,狭窄处可见肿瘤;B型为单纯扩张型,扩张下游无狭窄;C型为间质肿瘤型,肿瘤远离主胰管。
二、结果
1.一般资料:13例小胰癌患者中男性6例,女性7例,年龄48~76岁,平均63岁。肿瘤位于胰头部9例(69.2%),胰颈部2例(15.4%),胰体尾部2例(15.4%)。高分化2例(15.4%),中分化11例(84.6%)。术后T分期中Tis 1例,T1b 1例,T1c 11例。TNM分期中Ⅰ期(ⅠA+ⅠB) 7例(53.9%),Ⅱ期4例(30.8%),Ⅲ期1例(7.7%),Ⅳ期1例(7.7%)。6例(46.2%)发生淋巴结转移,11例(84.6%)累及神经,3例(23.1%)侵犯脉管。
2.小胰癌的EUS分型:13例小胰癌患者中A3型10例(76.9%),B型1例(7.7%),C型2例(15.4%)。Tis 1例(7.7%),T1b 1例(7.7%),T1c 11例(84.6%)。
10例A3型患者中7例肿瘤位于胰头部,2例胰颈部,1例胰体尾部;1例肿瘤长径10 mm,9例11~20 mm;T分期1例T1b,9例T1c;6例TNM Ⅰ期,3例ⅡB期,1例Ⅳ期;EUS示10例肿瘤均为低回声,其中2例回声均匀,8例回声不均匀;7例病变边界不清,2例边界清晰,1例边界尚清晰;10例均主胰管扩张。Ⅳ期的1例患者肿瘤大小1.0 cm×1.0 cm×0.6 cm,位于胰腺钩突,转移至十二指肠,肿瘤分期为pIV(T1c, N2, M1),其CT、EUS及病理表现见图1。
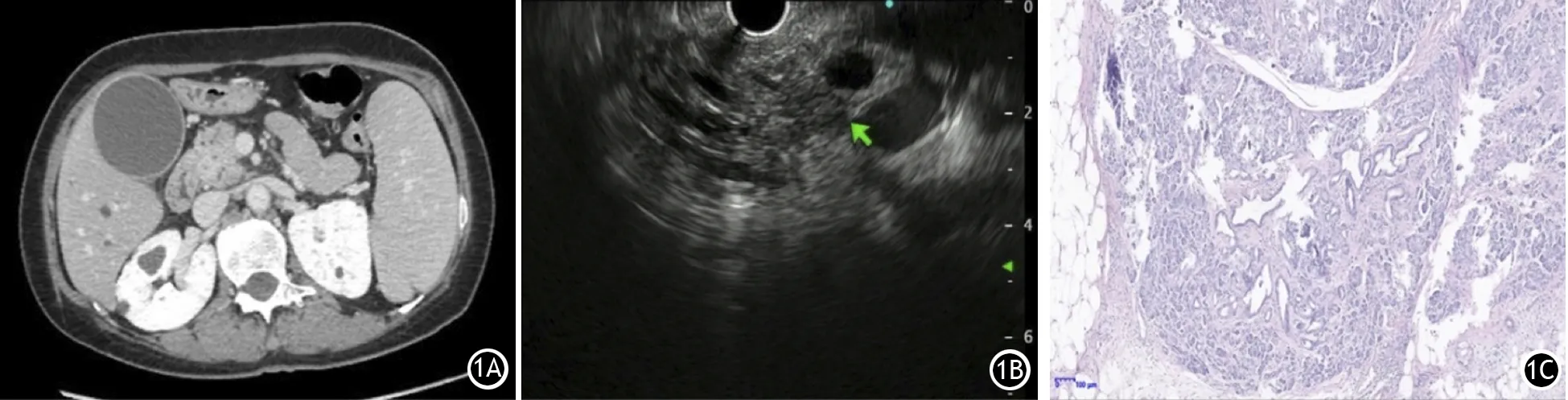
图1 A3型Ⅳ期小胰癌患者。CT见胰腺钩突部不规则肿块,近端胰管扩张(1A),EUS示胰腺钩突部不规则低回声团块影,近端胰管扩张(1B),病理示中分化胰腺导管腺癌,脉管内有癌栓,神经侵犯并累及胆管壁(1C,HE染色 ×100)
1例B型,CT示胰体尾部多发囊性低密度影(图2A),EUS示胰体尾部一囊性病变,其内回声不均匀,可及低回声病变(图2B),病理诊断为胰腺导管上皮高度上皮内瘤变(原位癌变),范围1.2 cm×0.8 cm×0.5 cm,局灶见微小间质浸润(2C),肿瘤分期为pIA(Tis, N0, M0)。
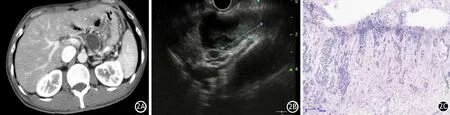
图2 B型小胰癌患者。CT见胰体尾部多发囊性低密度影(2A),EUS示胰体尾部一囊性病变内回声不均匀,可及低回声病变(2B),病理示部分胰腺导管上皮高度上皮内瘤变(原位癌变),局灶见微小间质浸润(2C,HE染色 ×100)
2例C型中1例肿瘤大小2.0 cm×2.0 cm×1.8 cm,肿瘤分期为ⅡB(T1c, N1, M0),EUS示低回声病灶,回声均匀,边界尚清,主胰管不扩张;另1例肿瘤大小2.0 cm×2.0 cm×1.5 cm,肿瘤分期为Ⅲ(T1c, N2, M0),EUS示低回声病灶,回声不均匀,边界不清,主胰管扩张(图3)。
讨论胰腺癌中原位癌及T1期肿瘤非常罕见。一项日本的多中心研究提出胰腺癌手术切除标本中原位癌发生率仅为1.6%[8],此外德国的一项研究得出pT1期胰腺癌的发生率为11.3%~12.5%,且胰腺癌T分期(即肿瘤大小)相较于N分期更能指导胰腺癌患者的预后[9]。尽管早期胰腺癌可通过MRI、EUS-FNA及鼻胰管连续胰液抽吸细胞学化验方法得到诊断,但小胰癌的超声内镜分型特点仍未有阐述。本研究主要就小胰癌在EUS下的表现进行分型并与病理对照,以期为CT或MRI下单纯胰管狭窄、扩张或胰腺囊性病变的患者行EUS时提高胰腺癌的诊断准确率。
EUS可将探头送至十二指肠或胃部观察胰头、体、尾部,因而是目前对胰腺局部病变观察最精准的工具[10]。国外文献报道[11],EUS在鉴别小的胰腺实体肿瘤中,灵敏度可达到96%,特异性为64%,明显优于腹部CT。传统胰腺癌在EUS下常表现为不均质的低回声肿块,有时内部可及囊性坏死,高回声较少见,部分病灶出现胰腺实质萎缩,胰管扩张,临床异质性较大[12]。小胰癌依据主胰管狭窄或扩张及其与肿块的关系分为5型。其中A2型与A3型区别在于A2的低回声主要包括脂肪变和纤维组织[13],为边界不清的低回声,而A3型则为边界清楚的低回声肿瘤性病灶。无肿块型的胰管狭窄与扩张被认为是胰腺原位癌的标志[14],临床上常需要多种影像手段参与鉴别诊断,包括胰液脱落细胞学分析,例如鼻胰管连续胰液抽吸细胞学化验或EUS-FNA胰液细胞学分析[15]。Terada等[7]报道36例小胰癌患者,其中6例原位癌中4例为A1型,2例为A2型2,20例为A3型。本研究13例小胰癌患者中10例A3型,1例B型,2例C型,未发现A1型及A2型,与Terada等的结果基本一致。日本的个案报道提示1例单纯狭窄型患者3个月内进展成伴淋巴结转移的进展期胰腺癌[16]。因而无论胰管狭窄周围有无病变,均需完善进一步检查,包括胰液细胞学分析。
胰管狭窄的病理基础主要为纤维化[17],胰腺原位癌可造成周围组织形成局灶性炎症、纤维化,从而促使其向周围组织浸润,而纤维化组织在EUS下则为低回声,也可能无低回声表现[18]。本研究中胰管狭窄型患者均为A3型,即在EUS下可明确肿瘤病灶,其中1例已出现远处转移,提示A型小胰癌在临床上需积极处理,否则易延误诊治。
胰管扩张通常是由于胰液流出受阻,下游胰管狭窄导致[19]。本研究中的B型小胰癌的胰管为单纯胰管扩张,无下游狭窄,病理证实为胰腺原位癌,慢性胰腺炎伴胰管内结石,故笔者认为胰管扩张的原因可能为周围胰腺组织的萎缩导致的胰管内压力下降所致,也可能为小结石的嵌顿造成胰液流出受阻所致。
C型的肿瘤与胰管不相关,主要靠对肿瘤本身的观察而发现。荷兰的一项多中心研究比较了EUS和MRI在筛查高危人群胰腺癌中的价值,结果显示MRI在发现囊性病变时占优势,而EUS在发现实性病变中更有价值[20]。
本研究EUS发现的实体肿瘤T分期均为T1b以后,即肿瘤长径≥6 mm,提示EUS也很难发现T1a期的5 mm以内的小胰癌,因而学者们建议联合胰液细胞学分析来协助诊断胰腺癌很有必要。
总之,当腹部超声、CT或MRI观察到胰管狭窄、扩张或局部肿块时均需进一步完善EUS检查。小胰癌(≤2 cm)的EUS表现以A3型为主。B型可能多为原位癌,EUS未及明确肿块时可进一步行EUS-FNA获取病理组织进行诊断。对于无肿块型患者也可行ERCP下鼻胰管连续胰液抽吸细胞学化验检查或EUS下获取胰液进行细胞学分析。由于本研究为回顾性分析,且样本量较少,未来需要扩大样本量,并进行长期随访,以证实小胰癌早期诊断的临床价值。
利益冲突所有作者均声明不存在利益冲突
