伴皮质下梗死和白质脑病的常染色体隐性遗传性脑动脉病的研究进展
2020-08-24王华园孙瑞华张昊晗时英英张杰文
李 改 赵 静 王华园 孙瑞华 张昊晗 时英英 张杰文
郑州大学人民医院,河南 郑州 450003
伴有皮质下梗死和白质脑病的常染色体隐性遗传性脑动脉病(CARASIL)是一种以脱发、反复缺血性卒中、认知障碍及腰痛为特征的常染色体隐形性脑动脉病。该病最早在1965年由日本学者MAEDA等首先报道,1995年FUKUTAKE等将其正式命名为CARASIL[1-2]。患者一般在10~30岁时出现多种表型,如腰痛、脱发甚至白质脑病[3-4]。年龄超过30岁的患者可能会出现其他症状,如步态障碍、缺血性卒中、假性延髓性麻痹、锥体或锥体外系症状、巴宾斯基体征和进行性认知障碍,严重的会导致严重痴呆[4-5]。2009年HARA等[6]通过基因连锁分析及候选基因序列分析将其致病基因定位于10号染色体上的HTRA1基因。临床症状、影像特点及病理活检为CARASIL的诊断提供了线索,其确诊需基因检测。迄今为止,全球已报道了19个CARASIL家系涉及到19个不同的突变位点,大部分来自日本,还有欧洲、北美洲、土耳其、新加坡及中国等(表1)。
1 临床特征
从既往的报道中总结出的CARASIL的临床特征如表1所示[6-20]。CARASIL患者常见的临床表现有腰背痛、缺血性卒中、脱发、偏头痛、认知障碍、精神障碍、步态障碍、尿潴留等。患者一般10~30岁即出现多种临床症状,如腰痛、偏头痛、步态障碍等,脱发的症状甚至可早在出生就伴有。脱发的平均发病年龄为20.1岁,腰背痛为25.1岁,偏头痛为26.5岁,步态障碍为29.4岁,尿储留为31岁,缺血性卒中为31.6岁,精神障碍为33.8岁,认知障碍为34.7岁。脱发、腰背痛、偏头痛、步态障碍较早出现(20~30岁),而缺血性卒中、尿储留、精神障碍、认知障碍出现较晚(30~40岁),其中脱发症状相对最早出现,认知障碍出现最晚。腰背痛、步态障碍、脱发、认知障碍是CARASIL患者较常见的临床表现,精神障碍和偏头痛相对少见。
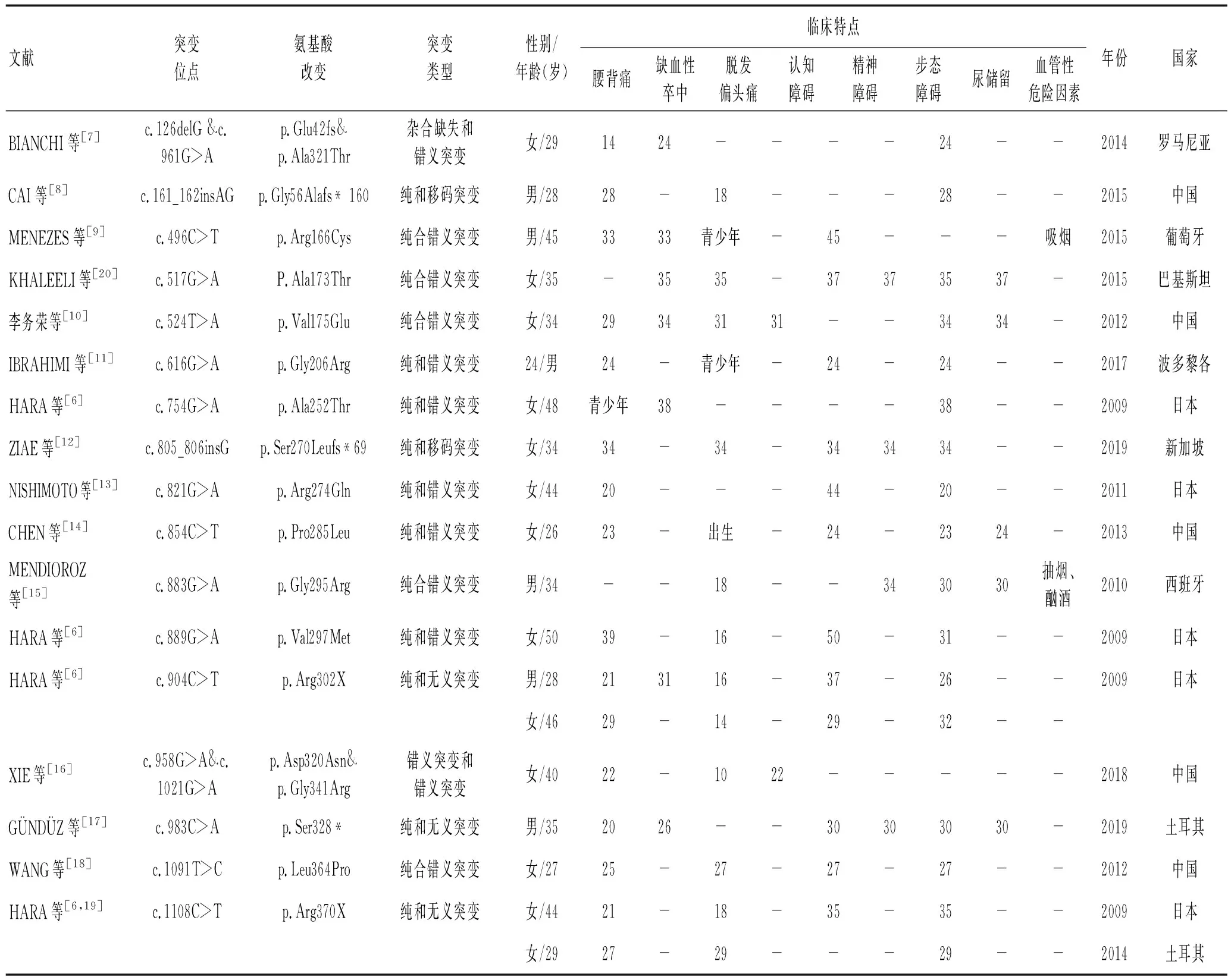
表1 CARASIL突变的文献报道Table 1 CARASIL mutation literature reports
2 影像特征
CARASIL患者最具特征性的影像表现为白质高信号及分布于基底节区及丘脑的腔隙性梗死灶[21]。早在出现临床症状前,CARASIL患者的头颅MRI即可表现出异常[22]。CARASIL患者早期头颅MRI可以发现分布于皮质下白质的双侧弥漫性脑白质病变,随着疾病进展逐渐扩展到基底神经节、丘脑、脑干和小脑[21]。CARASIL患者早期头颅MRI也可以出现CADASIL特征性的累及外囊及前颞叶的白质病变,因此单纯从影像上难以区分CADASIL和CARASIL[22-23]。但CARASIL的脑白质病变似乎倾向于均匀发展,而CADASIL的脑白质病变首先是点状、结节状,随疾病进展逐渐融合成片[21]。CARASIL进展期累及脑桥小脑束,在头颅MRI上会出现特征性的脑桥到小脑中脚的弧形白质高信号[22]。腔隙性梗死灶见于丘脑、基底节和深部白质,疾病进展期会出现全脑弥漫性脑萎缩及大脑皮质、丘脑、小脑散在的微出血[24]。头颅MRA及血管造影一般无明显异常。30岁时脊椎MRI可见椎间盘退行性变、椎间盘突出及不同程度的椎管狭窄[22]。
3 病理特征
CARASIL影响脑实质及脑膜的小动脉,直径100~400 μm,从组织病理学看主要表现为动脉硬化:血管平滑肌细胞(SMCs)的丢失、中膜玻璃样变、内弹性膜的增厚和碎裂、纤维内膜增生和管腔狭窄等[25-26]。与动脉粥样硬化不同的是,CARASIL的病理特征中SMCs的丢失远远比管腔的狭窄的表现更为突出[27]。小动脉硬化的改变在脑白质和基底神经节表现最为明显,脑干及胼胝体相对表现较弱,由于动脉硬化,在脑白质、基底节及脑干可看到多发小软化灶及不累及U形纤维的弥漫性髓鞘苍白[28]。电镜下观察不到类似CADASIL的典型的GOM沉积,也无淀粉样物质沉积,因此皮肤活检对疾病诊断的作用有限[29]。CARASIL也会影响其他组织器官的血管,其受影响的程度较脑血管较轻[30]。
4 遗传特点
HTRA1属于热休克诱导的丝氨酸蛋白酶家族,在进化上高度保守,由一个功能未知的N端结构域、一个丝氨酸蛋白酶结构域和一个C端PDZ结构域构成[31-32]。HTRA1蛋白兼具蛋白酶及分子伴侣的功能,涉及蛋白质质量控制的各个方面,包括识别错误折叠、错误定位或片段化的蛋白质及其重新折叠和蛋白水解[31]。HTRA1不仅可以降解包括细胞外基质蛋白在内的多种底物,也可以抑制转化生长因子TGF-β的信号转导[33-34]。但是近来也有关于HTRA1促进TGF-β的信号转导的报道[35]。HTRA1活性的丧失与很多严重疾病有关,包括关节炎、癌症、CARASIL、年龄相关性黄斑变性,以及阿尔茨海默病等[36-38]。
HTRA1的正常功能是在内质网中裂解TGF-β1前体,HTRA1突变降低了丝氨酸蛋白酶的活性,因此成熟的TGF-β1增多[39]。TGF-β1增多如何导致CARASIL的临床表型目前尚不完全清楚[41]。既往研究发现,TGF-β信号的增加诱导包括粘连蛋白、蛋白聚糖和透明质酸等的细胞外基质蛋白在脑小动脉壁中积累,导致血管壁纤维化,内膜增厚[6,24]。TGF-β1减弱了周细胞的吞噬能力,增强了IL-6、NOX4等经典促炎因子及酶MMP2的活动,其中NOX4已经被证明可以通过氧化应激促进内皮细胞凋亡,MMP2的表达通过影响基底膜和内皮细胞紧密连接的表达,促进血脑屏障的破坏[40]。TGF-β参与VSMCs的形成和发展,这可能是CARASIL中VSMCs缺失的原因[41]。CARASIL病人存在严重的头皮毛囊破坏,但头皮动脉改变很小,提示脱发可能是由于毛囊受损所致,而TGF-β1在毛发生长中起抑制作用,因此CARASIL可能是通过调控TGF-β1影响毛囊生长[42-43]。
也有研究推测TGF-β的信号转导可能不是CARASIL病理的核心进程,发现HTRA1-/-小鼠与野生型小鼠主动脉中TGF-β信号转导的通路下游磷酸化Smad2水平无显著不同[44]。基质金属蛋白酶(Matrix metalloproteinases,MMPs)可以降解和重塑血管壁内的细胞外基质,在VSMCs的表型调节及动脉弹性纤维断裂中起重要作用[44]。HtrA1-/-小鼠的主动脉VSMCs倾向于转化为基质合成细胞,表达高MMP9活性,并容易出现应激诱导的细胞死亡[44]。
5 治疗进展
CARASIL患者尚无有效的针对性治疗。目前的治疗主要是为患者提供遗传咨询,预防缺血性卒中的再发,认知功能的改善及其他支持治疗等。抗血小板药物及抗凝药物对CARASIL患者的作用仍不清楚。CARASIL相关药物研究的研究目前有两个可以考虑的方向,一个为增加HTRA1活性。对于p.Arg370X无义突变的患者,含有Arg370X突变的HTRA1蛋白拥有野生型HTRA1蛋白的活性,因此抑制无义介导的 mRNA 降解的药物可能有助于增加活性HTRA1的数量[6,45]。抑制TGF-β的活动是另一种可以考虑的方法。马凡综合征是增加的TGF-β转导引起的疾病,而既往研究中血管紧张素Ⅱ 1型受体拮抗剂(一种临床用于降压的药物)已被证明可以抑制TGF-β信号通路并改善马凡综合征转基因小鼠和患者的进展[24]。
