阿托伐他汀预处理对大鼠脑缺血再灌注损伤的保护作用及炎症机制
2020-08-24杨晓炜刘凤海崔新宇石文秀王锦涛姚立岩
杨晓炜 刘凤海 崔新宇 石文秀 王锦涛 姚立岩
牡丹江医学院公共卫生学院,黑龙江 牡丹江 157011
随着老龄化社会的到来,缺血性脑卒中的发病率呈上升趋势,严重威胁着老年人的健康[1]。因而,缺血性脑卒中的治疗一直是医学领域研究的热点。通常情况下,当缺血性脑卒中发生时,为了尽快缓解脑缺血缺氧条件下引发的神经细胞肿胀、坏死,原则上应尽快恢复大脑供血。然而有研究证实,在快速恢复大脑供血后,组织、器官的损害有时并未得到好转反而可能出现进一步恶化,该现象被称为脑缺血再灌注(cerebral ischemia reperfusion CIR)损伤[2-3]。对其机制分析发现,过度的炎症反应在脑缺血再灌注损伤过程中起到至关重要的作用。因而,探明脑缺血再灌注损伤的炎症机制拮抗炎症反应对于治疗缺血性脑卒中十分关键[4]。
引起神经系统炎症放大的关键因素是脑内小胶质细胞的激活[5-6]。小胶质细胞可被缺血后死亡神经细胞所释放的如热休克蛋白-60、纤维蛋白原、透明质酸等多种内源性配体激活,被激活的小胶质细胞会释放出大量的炎性介质形成炎症级联放大效应,进一步加重神经损伤。因此,抑制小胶质细胞的激活对于抑制炎症反应从而减轻脑缺血再灌注损伤十分重要。
阿托伐他汀在临床上主要用于降血脂,研究显示阿托伐他汀对缺血性卒中也具有预防和治疗的作用[7]。阿托伐他汀对缺血性脑卒中的神经保护机制尚不完全清楚,除降脂作用外对脑缺血再灌注后炎症反应是否有影响少有报道。阿托伐他汀是否在TRL4/NF-κB 通路中起重要作用,尚需进一步研究证实。因此本研究采用线栓法制备大鼠局灶性脑缺血-再灌注(ischemia-reperfusion,I/R)模型,观察阿托伐他汀对大鼠脑缺血再灌注后 TNF-α、TRL4、NF-κB的表达的影响,旨在观察和探讨阿托伐他汀对SD大鼠脑缺血再灌注后脑保护的炎症机制,为该药实现缺血性脑卒中的临床应用提供科学依据。
1 材料与方法
1.1动物清洁级健康雄性SD大鼠,8周龄,体质量 200~250 g,20~25 ℃ 下分笼饲养,相对湿度 57%,自然昼夜,自由饮水和进食,术前禁食12 h。
1.2试剂大鼠TNF-αELISA试剂盒(武汉博士得生物公司)、大鼠NF-κB ELISA试剂盒(武汉博士得生物公司)、阿托伐他汀:纯度大于99.19%(广东阳江制药厂有限公司)、2,3,5氯化三苯基四氮唑(TTC)(北京索莱宝科技有限公司)
1.3动物分组及给药用随机数字表将大鼠按体质量随机分为假手术组(15只)、模型组(15只)及预处理组(15只)。给药:预处理组术前连续14 d每天给予10 mg/kg阿托伐他汀灌胃,假手术组和模型组术前给予等体积生理盐水灌胃。
1.4造模应用改良的Zea-Longa[8]线栓法制备局灶性脑缺血再灌注模型:大鼠术前腹腔注射10 % 水合氯醛3.5 mL/kg,麻醉后固定于手术板,碘伏消毒,沿颈部正中自下而上切一纵向切口,分离右侧颈总动脉、结扎其近心端,分离颈外动脉并结扎其根部,在颈内动脉根部备线并打一活结。在颈总动脉近颅侧夹一小动脉夹,结扎处的远端剪口,将石蜡处理过的线栓插入切口小心向颅侧推进,到达动脉夹处取下动脉夹,使线栓得以经颈内动脉到达大脑前动脉,结扎备线固定线栓。由内而外逐层缝合皮肤消毒后分笼饲养。2 h后将线栓前端拔出至颈内、外动脉分叉处,实现血流再灌注。大鼠苏醒后行Zea-Longa 5分法[8]神经评分,1~3分者说明造模成功,评分标准见下文。
1.5神经功能缺损评分采用 Zea-Longa 5 分法对各组大鼠术后2 h、6 h、12 h、24 h、48 h、72 h进行神经功能缺损评分,具体标准为:0分,神经功能正常;1分,左侧前爪无法伸展;2分,出现追尾征;3分,行走时身体向左侧倾倒;4分,意识丧失。
1.6梗死体积计算用水合氯醛麻醉后断头取脑。将脑组织置于-20 ℃冰箱中20 min取出,切去额端1.0 mm,由前向后每隔2.0 mm作冠状切片,共切5片。放置于1%TTC磷酸缓冲液(0.23 mol/L,pH 7.5)中,37.5 ℃避光孵育,每隔15 min翻面一次,共孵育30 min。正常组织显示出红色,梗死组织显示为白色。染色后数码相机拍照,使用ImageJ图像分析系统计算梗死体积。大鼠脑梗死体积百分比=(正常侧大脑半球体积-梗死侧非梗死区大脑半球的体积)/正常侧大脑半球体积。
1.7TNF-α、NF-κB测定血清:各时间点行内眦静脉丛取血,室温静置2 h左右,将血样4 ℃ 3 000 r/min,离心10 min。分离血清,按试剂盒说明书操作采用酶联免疫吸附法(ELISA法)测定TNF-α、NF-κB浓度。脑组织:末次取血后,迅速冰盘上断头取脑,加入9倍量的 0~4 ℃ 生理盐水,在冰浴上匀浆得10% 脑组织匀浆,将脑匀浆在4 ℃ 条件下以3 500 r/min低温离心15 min,取上清置于-80 ℃ 冰箱备用,用于 TNF-α、NF-κB测定。具体方法参照试剂盒说明。
1.8实时荧光定量PCR技术检测脑组织TLR4和NF-κBmRNA的表达取大鼠脑缺血再灌注72 h的脑组织,用Trizol法提取组织总RNA,采用 Prime-ScriptTM逆转录试剂盒合成 cDNA,再将逆转录的产物稀释5倍,用于荧光定量 PCR(RT-PCR)分析。查找 NCBI 数据库中的大鼠 TLR4 、NF-κB 和 β-actin 的 mRNA 序列作为模板,设计RT-PCR 引物。TLR4上游5’-GCCGGAAAGTTATTGTGGTGGT-3’,下游5’-ATGGGTTTTAGGCGCAGAGTTT-3’;NF-κB上游5’-GCTTTTCCAGCTGCTATTGG-3’下游5’-GTGGGGACTGCGATCCTTA-3’;β-actin上游5’-GGAGATTACTGCCCTGGCTCCTA-3’下游5’-ACTCATCGTACTCCTGCTTGCTC-3’。引物均由大连宝生物工程有限公司合成。RT-PCR 扩增条件:预变性 95 ℃×5 min,变性95 ℃×30 s,退火 60 ℃×30 s,延伸 72 ℃×30 s,均为35个循环。以β-actin为内参,采用 2-△△Ct法对数据进行分析,即基因表达差异= 2-△△Ct,△△Ct= 实验组(目的基因Ct值-内参基因Ct值)-对照组 (目的基因Ct值-内参基因Ct值)。

2 结果
2.1各组大鼠再灌注后不同时间点神经功能缺损评分比较假手术组再灌注后各时间点均无神经功能缺损,模型组及预处理组再灌注后各时间点均表现出明显的神经运动功能障碍。预处理组各再灌注时间点的神经功能缺损评分均明显低于模型组(P<0.05)。见表1。
2.2大鼠再灌注各时间点血清TNF-α、NF-κB比较与假手术组比较,模型组和预处理组大鼠再灌注各时间点血清TNF-α、NF-κB均有升高(P<0.05);与模型组比较,预处理组大鼠于再灌注2 h、6 h、12 h、24 h血清TNF-α、NF-κB有所下降(P<0.05),再灌注48 h、72 h 2组间差异无统计学意义(P>0.05)。见表2、表3。
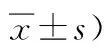
表1 再灌注各时间点神经功能缺损评分比较 (分,Table 1 Comparison of neurological deficit scores at various time points of

表2 各组大鼠再灌注后各时间点血清TNF-α比较Table 2 Comparison of serum TNF-α at various time points after reperfusion of rats in each

表3 各组大鼠再灌注后各时间点血清NF-κB比较Table 3 Comparison of serum NF-κB at various time points after reperfusion in each group of
2.3大鼠再灌注72h脑组织中TNF-α、NF-κB比较与假手术组比较,模型组与预处理组大鼠再灌注72 h脑组织中TNF-α、NF-κB均有所升高(P<0.05);与模型组比较,预处理组TNF-α、NF-κB有所降低(P<0.05)。见表4。
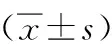
表4 各组大鼠再灌注72 h 脑组织TNF-α、NF-κB比较Table 4 Comparison of TNF-α and NF-κB in brain tissue of rats in each group after 72 hours of
2.4再灌注72h各组脑组织TLR4和NF-κBmRNA表达比较与假手术组相比,模型组和预处理组脑组织中TLR4、NF-κB mRNA 表达显著上调 (P<0.01),预处理组 TLR4、NF-κB mRNA 表达与模型组相比有所下调(P<0.05)。见表5。
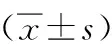
表5 各组大鼠再灌注后72 h脑组织TLR4 、NF-κBmRNA表达比较Table 5 Comparison of TLR4 and NF-κB mRNA expression in brain tissue of rats in 72 hours after
2.5脑缺血再灌注后72h各组大鼠脑梗死体积比较脑缺血再灌注后72 h,假手术组无梗死灶形成;模型组脑梗死体积为 (49.44±1.23)%。预处理组脑梗死体积为(23.54±2.14)%,低于模型组(P<0.05)。见图1。

图1 各组梗死体积的比较Figure 1 Comparison of infarct volume in each group
3 讨论
缺血性脑卒中是严重威胁人类健康的常见病之一,具有极高的致残率及致死率,然而目前临床治疗效果仍不理想,缺血性脑卒中的治疗手段主要是超早期溶栓,但有效治疗时间窗短并易继发脑缺血再灌注损伤[9-10]。脑缺血再灌注损伤病理过程十分复杂,包括过度神经炎性反应、大量自由基生成、膜脂质过氧化等,其中神经炎性反应是最关键的病理机制。过度炎症反应可以使血脑屏障通透性增加,大量的炎性因子通过血脑屏障加重脑损伤。在这一过程中TNF-α与缺血再灌注损伤关系最为直接[11]。首先,TNF-α可通过调节细胞间黏附因子-1(ICAM-1)水平引发血管炎性反应,炎性细胞进入脑组织可损伤神经系统。TNF-α还可促进血管内皮细胞产生凝血活性,使血栓形成。动物研究显示脑中的TNF-α还会促进前列环素、血栓烷B2等因子的释放,这些因子除促凝外也会减少血管舒张因子,使血管收缩,从而加重脑损伤[12]。
阿托伐他汀属于3-羟基-3-甲基戊二酸单酰辅酶A还原酶抑制剂,它能有效降低低密度脂蛋白和胆固醇、降低三酰甘油,增高高密度脂蛋白,故临床上主要用于调脂治疗。临床应用发现接受阿托伐他汀治疗的患者脑卒中的发病风险降低[13]。动物实验显示,即使血脂水平正常的大鼠,阿托伐他汀也可减小其缺血再灌注后脑梗死体积,表现为脑保护作用,因此阿托伐他汀可能通过降脂、抗炎、抗氧化等多种机制来发挥神经保护作用,其机制还有待研究[14]。
本研究发现预处理组大鼠脑缺血再灌注后各时间点神经功能评分均低于模型组,脑梗死程度也更轻,且各时间点预处理组TNF-α表达低于模型组。说明阿托伐他汀可抑制神经元的丢失,减轻神经功能损伤的程度,其作用机制可能与影响和调节TNF-α的表达水平有关。阿托伐他汀通过什么机制下调TNF-α表达,有研究发现NF-κB 信号通路可以通过介导炎症反应促进脑缺血再灌注时的神经损伤。因此,本研究进一步探讨了TNF-α下调与NF-κB 信号通路是否有关。
NF-κB 是真核细胞中广泛存在的核转录因子,当细胞处于静息状态时,NF-κB通常存在于胞浆中;脑缺血-再灌注时脑组织细胞中的NF-κB 被激活,致使其与抑制性蛋白I-κB 发生分离,从胞浆转至胞核发挥调控作用,活化后的NF-κB可以促进 TNF-α、IL-1β及IL-6 等促炎因子基因的表达,从而促进炎性反应[15],而这些因子反过来又可进一步激活 NF-κB,使 NF-κB 活化在组织间不断扩散,加重炎症反应[16]。NF-κB 活化还可以激活大量氧化活性物质释放,导致氧化应激,自由基瀑布效应等,加速细胞凋亡进程,故 NF-κB 活化被认为是介导脑缺血再灌注后炎性损伤的关键环节。
本研究证明阿托伐他汀在抑制TNF-α的同时也能够抑制脑组织中NF-κB的表达。说明阿托伐他汀对TNF-α的抑制可能是NF-κB活化受到抑制的结果。为找到NF-κB活化受到抑制的原因,本研究对其作用机制进行了进一步的探究。
与脑缺血再灌注损伤相关的细胞信号转导通路有很多[17-18],其中TLR4/NF-κB 信号转导通路对中枢神经系统炎症反应的调控居于核心地位[19]。TLR4在脑组织中主要由小胶质细胞表达,TLR4 基因敲除小鼠脑缺血再灌注时产生的炎症因子减少,脑损伤程度减轻[20]。TLR4与配体结合后通过髓样分化因子88(MyD88)依赖信号通路和非 MyD88依赖信号通路发挥作用。其中MyD88依赖信号通路可引发NF-κB的活化,如前所述,活化后的NF-κB可使TNF-α、IL-6等炎性因子分泌增加,放大炎症反应[21-22]。
通过本研究观察到假手术组大鼠TLR4和NF-κB表达极低,模型组明显高于假手术组,证明 TLR4/NF-κB信号通路在脑缺血再灌注损伤过程中发挥重要作用。当脑缺血发生后,坏死的神经元产生热休克蛋白-60、透明质酸等大量内源性配体,这些配体与TLR4结合后激活小胶质细胞,后者分泌大量炎性因子,放大的炎症反应导致更多神经元坏死,坏死神经元释放更多TLR4的内源性配体,从而激活更多小胶质细胞,周而复始形成恶性循环。而预处理组较模型组TLR4和NF-κB表达降低,可能机制是阿托伐他汀使小胶质细胞表面 TLR4内源性配体减少,TLR4/NF-κB通路受到抑制,TNF-α等炎症因子分泌受到抑制,炎症反应减轻,神经元得到保护[22]。
阿托伐他汀通过抑制TLR4/NF-κB通路能够抑制TNF-α等炎症因子的表达,从而起到对脑缺血再灌注损伤的保护作用。阿托伐他汀作为调脂药由于具有临床疗效好、不良反应少等特点被广泛应用。本研究显示,阿托伐他汀在缺血性脑卒中的防治方面也具有广阔的前景。
