改良四妙散颗粒对小鼠急性胰岛素抵抗的影响
2020-08-20
温州市中医院 浙江 温州 325000
改良四妙散颗粒采用黄连、苍术、黄柏和薏苡仁四味药材,应用现代制剂技术制成颗粒剂。改良四妙散颗粒,是在古方四妙散(出自《成方便读》)基础上去牛膝加黄连而成,以加强清热燥湿之力。具有清热燥湿、健脾祛浊作用,用于治疗2型糖尿病(T2DM)、胰岛素抵抗(IR)属湿热困脾证者。同时现代药理研究表明,黄连素具有与二甲双胍相似的增加胰岛素敏感性的作用[1]。对改良四妙散颗粒不同的处方配比进行药效学筛选,实验结果发现,处方量为黄柏6份、苍术10份、薏苡仁10份、黄连3份的改良四妙散颗粒改善急性胰岛素抵抗效果最为显著。
早期实验发现,改良四妙散颗粒通过阻断巨噬细胞中ERK/NF-κB信号通路来抑制炎症反应,表明改良四妙散颗粒具有抗炎活性[2],其中主要活性成分是小檗碱[3]。后来进一步证实了改良四妙散颗粒阻断IKKβ/IRS-1/Akt信号途径,进而抑制肝细胞中炎症反应并调节胰岛素敏感性[4]。
炎症学说认为T2DM和IR是一种慢性炎症性疾病,与炎症因子,如肿瘤坏死因子(TNF-α)、白介素-6(IL-6)、C反应蛋白(CRP)等有密切的联系。在诸多刺激中,细菌脂多糖(LPS)能诱导巨噬细胞激活产生炎症反应,LPS是内毒素的主要成分,能刺激机体发生炎症反应,释放大量的细胞因子,如一氧化碳(NO)、前列腺素、过氧化物,以及前炎症因子类:TNF-α、IL-1β、IL-6等。TNF-α和IL-6均可致小鼠胰岛素抵抗,而LPS刺激的巨噬细胞上清液含有大量的TNF-α和IL-6,所以我们采用这种方法造模。本实验研究的目的是考察改良四妙散颗粒改善急性胰岛素抵抗的作用。
1 材料与方法
1.1 药物:改良四妙散颗粒,批号:101203,0.2082g浸膏粉相当于1g生药,每10g浸膏粉需加入220mg的挥发油包合物。实验设3个剂量组,高剂量组:2.4g/kg,中剂量组:1.2g/kg,低剂量组:0.6g/kg。临用前采用双蒸水配置不同浓度的溶液供动物灌胃用。
1.2 试剂:葡萄糖,批号:F20101115,国药集团化学试剂有限公司;蒽酮试剂:0.01g蒽酮加0.2g硫脲溶于20ml的72%浓硫酸中,呈黄色透明溶液,储存于棕色瓶中,4℃保存。4%磺基水杨酸:0.8g的磺基水杨酸溶于20ml的双蒸水中。
1.3 实验仪器:酶标仪(Multiskan sPectrum),型号1500,Thermo Electrom CorPoration;低温离心机,型号1-15K,Sigma CorPoration;电子天平,TP114,丹佛仪器(北京)有限公司;全自动纯水仪(Water Purifica‐tion System),Hi-Tech Instruments CO.Ltd;DY89-Ⅱ电动玻璃匀浆机,宁波新芝生物科技股份有限公司。细胞培养箱,型号3111,Thermo Electron CorPoration;XSZ-Dz倒置显微镜,重庆光学仪器厂;超低温冰箱,型号702,Thermo Electron CorPoration。
1.4 实验动物:健康ICR种CL级雄性小鼠,体重18~22g,购自扬州大学比较医学中心,实验动物合格证:SCXK(苏)2007-0001,饲养于22±2℃的环境中,动物分笼饲养,自由摄食和饮水,室内采取12h光照、黑暗循环。
1.5 方法:分述如下。
1.5.1 LPS刺激巨噬细胞上清液的制备:从健康雄性小鼠提取巨噬细胞,细胞以6×105接于6孔培养板,4h细胞贴壁后换成无血清HG-DMEM培养,在每孔加入终浓度5μg/ml的LPS,48h后收集上清。收集的上清0.22μm滤膜过滤后贮存于-70℃超低温冰箱中。注射用上清配制:取上述所收集上清按1∶2用生理盐水稀释为3倍。
1.5.2 改良四妙散颗粒对急性胰岛素抵抗小鼠糖耐量的影响:将84只雄性CL级小鼠按体重随机分成7组:空白组,模型组,改良四妙散颗粒高、中、低剂量组,二甲双胍0.2g/kg组和消渴丸2g/kg组,每组12只。隔夜禁食不禁水12h后,毛细管眼球静脉丛取血,此为0时,灌胃给药,空白组和模型组灌胃给予双蒸水0.1ml/10g,0.5h后腹腔注射LPS刺激小鼠巨噬细胞上清液0.2ml/只,0.5h后灌胃20%葡萄糖溶液0.1ml/10g体重,于0.5h、1.0h、2.0h取血,静置15min,3000rPm,15min离心,吸取血清,用葡萄糖氧化酶法试剂盒测血糖。
1.5.3 改良四妙散颗粒对急性胰岛素抵抗小鼠胰岛素敏感指数(ISI)和肝糖原的影响:雄性CL级小鼠96只,按体重随机分成8组:正常动物组,空白组,模型组,改良四妙散颗粒高、中、低剂量组,二甲双胍0.2g/kg组和消渴丸2g/kg组。小鼠过夜禁食12h后,灌胃给药,正常动物组、空白组、模型组灌胃双蒸水0.1ml/10g,0.5h后除正常动物组、空白组外,其他各组腹腔注射巨噬细胞上清液0.2ml/只,0.5h后灌胃20%的葡萄糖溶液0.1ml/10g,正常动物组灌胃双蒸水0.1ml/10g,于0.5h摘眼球取血,同时称取0.2g的肝脏。①ISI的检测:将血液离心,吸取血清,血糖(BG)、胰岛素(INS)的检测分别按照试剂盒说明书提供的方法测定。按文献报导方法计算,计算公式为:ISI=Ln1/(INS×BG)胰岛素抵抗指数(HOMA-IR)=(INS×BG)/22.5。②肝糖原的检测:将称取的0.2g肝组织按重量∶体积=1∶9,用PBS制备匀浆;取匀浆0.5ml,加4%磺基水杨酸0.5ml,混匀,离心(1000rPm,20min);取上清10µl,加到490µl蒽酮试剂中,沸水浴15min,冷却,620nm测吸光度值(OD)。取肝脏匀浆液,12000rPm,离心20min,吸取上清用考马斯亮蓝测蛋白含量。处理完毕后,以糖原/蛋白(mg/mg)表示糖原合成量。
1.6 统计学处理:数据以平均值±标准差(±s)表示,组间比较采用student-t检验。检验标准α=0.05。
2 结果
2.1 改良四妙散颗粒对急性胰岛素抵抗小鼠糖耐量的影响:0.5h时小鼠血糖达到峰值,模型组与空白组比较,血糖明显升高(P<0.05),改良四妙散颗粒组与模型组比较,血糖明显降低并呈剂量依赖性,二甲双胍和消渴丸也明显降低血糖,在1h时呈现一样的情形,2h时血糖都恢复正常。说明改良四妙散颗粒能有效改善急性胰岛素抵抗小鼠的糖耐量,并有剂量依赖性。见表1。
2.2 改良四妙散颗粒对急性胰岛素抵抗小鼠ISI的影响:小鼠禁食12h后,灌胃给药,0.5h后注射上清液,0.5h后灌胃20%的葡萄糖溶液0.1ml/10g,之后于0.5h摘眼球取血。血糖:除改良四妙散颗粒低剂量组外,中、高剂量组的小鼠血糖值明显低于模型组(P<0.05),二甲双胍和消渴丸组也明显降低血糖。胰岛素:与正常动物组比较,给糖空白组胰岛素明显升高,说明葡萄糖可以促进胰岛素的分泌;与空白组比较,模型组的胰岛素显著升高(P<0.05);改良四妙散颗粒(除低剂量组)中、高剂量组与模型组比较较明显的降低(P<0.05);二甲双胍和消渴丸具有相同的作用。胰岛素敏感指数(ISI):改良四妙散颗粒中、高剂量组明显优于模型组(P<0.05);二甲双胍和消渴丸也较明显优于模型组。HOMA-IR:与空白组比较,模型组显著性升高(P<0.05),说明小鼠的急性胰岛素抵抗模型成功;与模型组比较,改良四妙散颗粒的中剂量、高剂量可以显著性改善小鼠胰岛素抵抗。二甲双胍和消渴丸也明显改善胰岛素抵抗。见表2。
表1 改良四妙散颗粒对急性胰岛素抵抗小鼠糖耐量的影响(±s)

表1 改良四妙散颗粒对急性胰岛素抵抗小鼠糖耐量的影响(±s)
注:与模型组比较,*P<0.05。
组别空白组模型组低剂量组中剂量组高剂量组二甲双胍组消渴丸组血糖(mmol/L)2h 6.218±1.562 5.716±0.924 5.140±0.741 5.123±1.284 5.460±0.745 5.194±1.045 5.092±1.617例数12 12 12 12 12 12 12剂量(g/kg)——0.6 1.2 2.4 0.2 2 0h 4.500±0.678 4.808±0.958 4.419±0.472 4.804±0.530 4.111±0.418 4.893±0.737 4.465±1.066 0.5h 9.390±1.538*16.07±2.264 14.61±2.868 12.94±2.063*11.10±2.740*11.16±2.242*6.887±1.880*1h 7.071±1.029*11.09±1.182 9.495±1.958*8.550±1.046*8.264±1.813*7.480±1.193*4.588±1.228*
表2 改良四妙散颗粒对小鼠急性胰岛素抵抗模型ISI的影响(±s)
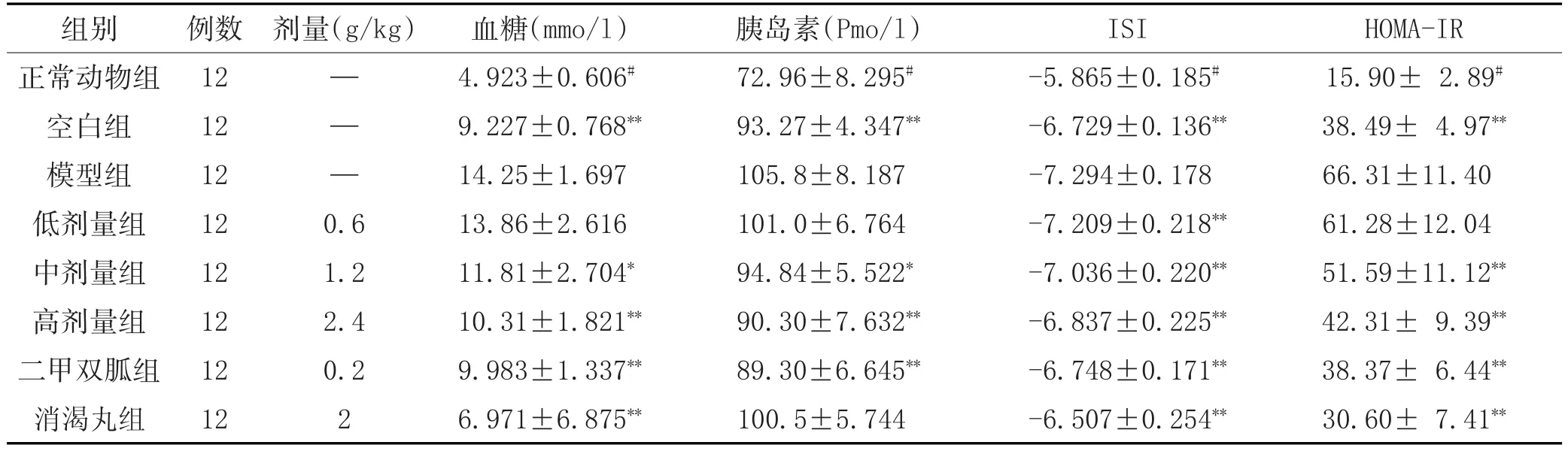
表2 改良四妙散颗粒对小鼠急性胰岛素抵抗模型ISI的影响(±s)
注:与模型组比较,*P<0.05,**P<0.01;与空白组比较,#P<0.05。
组别正常动物组空白组模型组低剂量组中剂量组高剂量组二甲双胍组消渴丸组HOMA-IR 15.90±2.89#38.49±4.97**66.31±11.40 61.28±12.04 51.59±11.12**42.31±9.39**38.37±6.44**30.60±7.41**例数12 12 12 12 12 12 12 12剂量(g/kg)— —0.6 1.2 2.4 0.2 2血糖(mmo/l)4.923±0.606#9.227±0.768**14.25±1.697 13.86±2.616 11.81±2.704*10.31±1.821**9.983±1.337**6.971±6.875**胰岛素(Pmo/l)72.96±8.295#93.27±4.347**105.8±8.187 101.0±6.764 94.84±5.522*90.30±7.632**89.30±6.645**100.5±5.744 ISI-5.865±0.185#-6.729±0.136**-7.294±0.178-7.209±0.218**-7.036±0.220**-6.837±0.225**-6.748±0.171**-6.507±0.254**
2.3 改良四妙散颗粒对小鼠急性胰岛素抵抗模型肝糖原的影响:小鼠禁食12.0h后,灌胃给药0.5h后iP 0.2ml的巨噬细胞上清液,0.5h后ig给予2g/kg的葡萄糖,0.5h处死小鼠0.2g取肝组织。不同浓度的改良四妙散颗粒均能增加肝糖原的合成,并有剂量依赖性。其中剂量2.4g/kg的改良四妙散颗粒处理组与模型组相比,显著增加肝糖原的合成。阳性对照组二甲双胍(0.2g/kg)和消渴丸(2g/kg)亦能明显的增加肝糖原的合成。见表3。
表3 改良四妙散颗粒对小鼠急性胰岛素抵抗模型肝糖原的影响(±s)
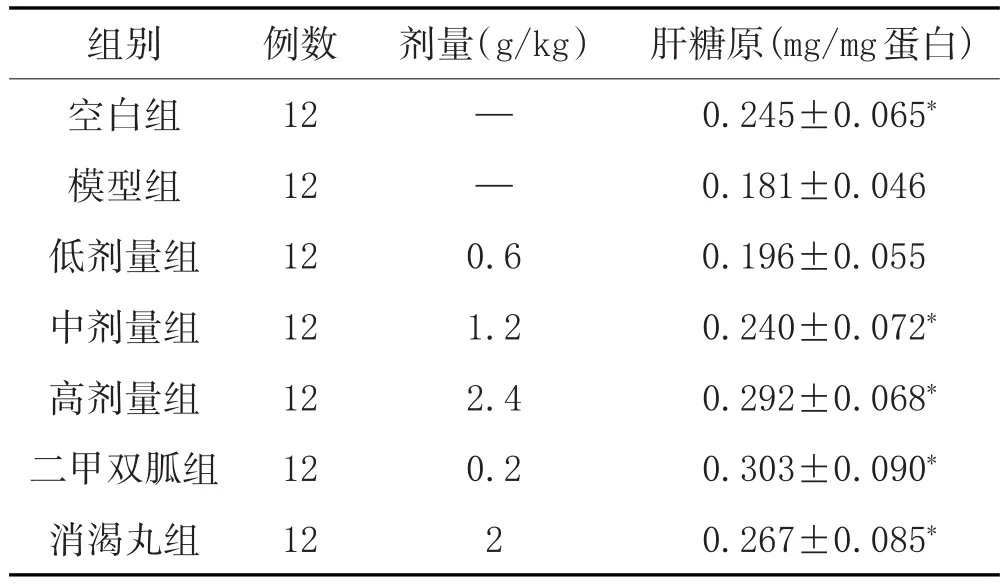
表3 改良四妙散颗粒对小鼠急性胰岛素抵抗模型肝糖原的影响(±s)
注:与模型组比较,*P<0.05。
组别空白组模型组低剂量组中剂量组高剂量组二甲双胍组消渴丸组肝糖原(mg/mg蛋白)0.245±0.065*0.181±0.046 0.196±0.055 0.240±0.072*0.292±0.068*0.303±0.090*0.267±0.085*例数12 12 12 12 12 12 12剂量(g/kg)— —0.6 1.2 2.4 0.2 2
3 讨论
IR是T2DM发生和发展的驱动因素,又是引起一系列代谢异常的重要原因,为此Reaven[5]于1988年提出了胰岛素抵抗综合征这一概念,认为肥胖、2型糖尿病、心血管疾病等诸多危险因素与IR有关,之后,鉴于此综合征与多种代谢相关疾病有密切的联系,命名为代谢综合征 (MS)或胰岛素抵抗综合征。早期研究发现,在肥胖动物模型脂肪细胞中TNF-α表达明显增加,用可溶性的TNF-α受体中和TNF-α后,实验动物的胰岛素抵抗有所减轻[6]。近期研究结果揭示,炎性刺激或脂肪颗粒在脂肪细胞的沉积促使脂肪细胞分泌较高水平的炎性细胞因子IL-6、TNF-α、γ干扰素(INF-γ)和抵抗素等,而这些炎性介质可分别通过JNK和NF-κB两条信号通路引发IR。IR是指机体对一定量的胰岛素的生物学效应低于预计正常水平的现象,表现为胰岛素的敏感性和反应性降低,葡萄糖摄取减少和糖原合成减少。了解IR及其机制对于防治糖尿病有重要意义。
IR是2型糖尿病的发病机制之一。本研究结果表明,笔者采用炎性因子成功复制小鼠急性胰岛素抵抗模型,改良四妙散颗粒能有效改善急性胰岛素抵抗小鼠的糖耐量,并有剂量依赖性;除低剂量组外,中、高剂量组的小鼠血糖值明显低于模型组(P<0.05),且与模型组比较,明显降低胰岛素分泌(P<0.05);中、高剂量组的ISI明显优于模型组(P<0.05);与模型组比较,改良四妙散颗粒的中剂量、高剂量可以显著改善小鼠胰岛素抵抗,并增加肝糖原的合成。综上所述,改良四妙散颗粒可以改善小鼠急性胰岛素抵抗。
