长链非编码RNA HCP5通过调控凋亡通路促进三阴性乳腺癌的研究
2020-08-20邢佳妮王丽虹
仝 潇 邢佳妮 王丽虹
乳腺癌的发病率位居我国女性恶性肿瘤之首,而占比10%~17%的三阴性乳腺癌(TNBC)更是由于缺乏治疗靶点,而具有高侵袭性以及预后不良的特征[1]。因此,了解三阴性乳腺癌的发病机理,明确其疾病进展的相关机制对乳腺癌的预防和治疗具有十分重要的意义。
长链非编码RNA(lncRNA)是一类长度超过200个核苷酸但却没有蛋白编码能力的RNA转录本[2]。最新的证据表明,lncRNA参与了乳腺癌的发生发展[3-4]。HCP5是HLA和P5的复合物,主要在免疫系统细胞中表达,并在自身免疫中具有潜在作用[5]。最近的研究表明,HCP5在人类的一些癌症中表达异常。HCP5是与HCV相关的肝细胞癌的易感性位点[6],它也被认为是肺腺癌的潜在生物标志物[7],但是在卵巢癌患者中却显著下调[8]。通过共表达网络分析,我们发现HCP5与乳腺癌的预后息息相关[9]。然而,HCP5在TNBC中的作用机制尚未明确。本研究通过探讨HCP5在TNBC中的表达、功能和调控机制,为寻找新的TNBC治疗靶点提供理论依据。
1 资料与方法
1.1 细胞培养和临床组织样本
实验所需的人乳腺癌细胞系(MCF-7、T47D、SK-BR-3、MDA-MB-231、MDA-MB-468、MDA-MB-453)和人正常乳腺上皮细胞系MCF-10A均由中国科学院上海生物科学研究所提供。MCF-10A细胞系在F12/DMEM 1∶1的培养基中进行培养。MCF-7细胞系在按比例加入0.01 mg/mL牛胰岛素和0.11 mg/mL丙酮酸钠的MEM培养基中培养。T47D和SK-BR-3细胞系使用DMEM培养基培养。以上所有细胞系均使用10%胎牛血清(FBS)在37℃和5% CO2培养箱中进行培养。而MDA-MB-231、MDA-MB-468和MDA-MB-453细胞系则使用含10%胎牛血清(FBS)的L-15培养基,在37℃、无CO2培养箱中培养。实验所需的临床组织样本为2014—2015年哈尔滨医科大学附属第三医院提供,其中包括30例浸润性导管癌(7例三阴、11例luminal A型、8例luminal B型和4例Her2+型)和30例浸润性导管癌的癌旁正常乳腺组织。上述所有组织的提供者在术前均未接受过放疗、化疗及免疫治疗,亦未合并其他恶性肿瘤。实验方案也获得了哈尔滨医科大学人类研究伦理委员会的批准。
1.2 基因敲除和慢病毒转染
将MDA-MB-231(1×105)和MDA-MB-468(2×105)细胞分别接种在6孔板中,24 h后使用Lipofectamine 2000试剂转染50 nM的siRNA。将含有细胞的6孔板按照浓度梯度分别加入适量的慢病毒后再加入1/1 000的聚丁二烯增强转染效果。HCP5 siRNA的序列为5′-GCAGTGTGCTTCCTTCCTT-3′。阴性对照组(NC)siRNA序列为5′-TTCTCCGAACGTGTCACGT-3′。
1.3 细胞RNA提取和荧光定量PCR
荧光定量PCR检测人乳腺癌细胞系(MCF-7、T47D、SK-BR-3、MDA-MB-231、MDA-MB-468、MDA-MB-453)和人正常乳腺上皮细胞系MCF-10A中HCP5 mRNA的相对表达。首先使用TRIzol试剂提取细胞总RNA。提取出来的RNA用核酸测量仪测量其浓度,其次利用ReverTra Ace-α qPCR RT试剂盒对RNA进行逆转录,合成cDNA。采用miRcute第一链cDNA合成试剂盒对成熟的miRNA进行RT-PCR检测。然后根据SYBR®Green RT-PCR试剂盒操作,在ABI 7500仪器上进行qRT-PCR扩增。以GAPDH为内参基因,所有样品进行3次独立重复性试验。本研究引物序列如下:HCP5-F:5′-GACTCTCCTACTGGTGCTTGGT-3′,HCP5-R:5′-CACTGCCTGGTGAGCCTGTT-3′;GAPDH-F:5′-CGTCACGGATTIGGTCG-3′,GAPDH-R:5′-TCICGCTCCIGAGGGGGAT-3′。最后用比较值2-△△CT法对qRT-PCR结果进行分析。
1.4 RNA Scope实验
乳腺癌组织芯片北京中山金桥公司代为检测。制备1×清洗缓冲液、复染试剂、脱水试剂,平衡试剂。在组织芯片上滴加探针,40℃以下杂交炉中2 h;用1×清洗缓冲液在室温下清洗玻片2次,每次2 min;加入约4滴Amp 1,40℃以下杂交炉中30 min,用1×清洗缓冲液清洗,方法同上;加入约4滴Amp 1,40℃以下杂交炉中30 min,用1×清洗缓冲液在室温下清洗玻片2次,每次2 min;加入约4滴Amp 2,40℃以下杂交炉中15 min,清洗同上;加入约4滴Amp 3,40℃以下杂交炉中30 min,清洗同上;加入约4滴Amp 4,40℃以下杂交炉中15 min,清洗同上;加入约4滴Amp 5,室温孵育中30 min,清洗同上;加入约4滴Amp 6,室温孵育中15 min,清洗同上;DAB染色室温10 min,蒸馏水清洗两次;50%苏木精染色室温2 min,蒸馏水清洗玻片3~5次;载玻片脱水,70% EtOH处理2 min,100% EtOH处理2 min,第二次100% EtOH处理2 min。二甲苯处理5 min;固定样品,向每个载玻片上滴加1~2滴Cytoseal,盖玻片盖好,风干载玻片。使用标准亮视野显微镜放大20~40倍观察组织切片,评估阳性对照强度和阴性对照背景。
1.5 细胞生存与毒性试验
使用Calcein-AM和ethidium homodimer(EthD-1)双染法检测活细胞和死细胞。将转染了HCP5 siRNA和对照siRNA的MDA-MB-231、MDA-MB-468细胞分别置于96孔板中,去除培养基,用PBS轻柔洗涤细胞2次。并根据实验方案制备分析试剂,在96孔板的每个孔中分别加入150 μL 的分析试剂。然后将96孔板置于37℃培养箱中孵育20 min。用BERTHOLD的LB 942 TriStar2进行检测。用530 nm激发滤光片观察到绿色的是活细胞,用645 nm激发滤光片观察到红色的为死细胞。最后根据说明说中的公式计算活细胞和死细胞的百分率。活细胞百分率=(F(530)sam-F(530)min/F(530)max-F(530)min)×100%;死细胞百分率=(F(645)sam-F(645)min/F(645)max-F(645)min)×100%。
1.6 CCK-8检测细胞增殖
将转染了HCP5 siRNA和对照siRNA的MDA-MB-231、MDA-MB-468细胞分别置于96孔板中,在37℃培养箱中分别孵育4 h、24 h、48 h、72 h后,在每孔中加入10 μL的CCK-8试剂。再置于37℃培养箱中培养2 h,酶标仪于450 nm波长处检测各孔的OD值,并绘制细胞生长曲线,所有的实验重复3次。
1.7 裸鼠体内实验
将稳定表达LV10-sh-NC或LV10-sh-HCP5的MDA-MB-231细胞(8×106)和MDA-MB-468细胞(1×107)的细胞皮下注射到4周龄雌性BALBc裸鼠的背部皮下(每组6只)。每5天测量一次小鼠的肿瘤体积。30天后处死裸鼠,切除肿瘤组织,称量瘤体重量,并用4%的多聚甲醛溶液固定。
1.8 抗体芯片
用转染了HCP5 siRNA和对照siRNA的MDA-MB-231细胞进行抗体芯片检测。选择RayBio C-Series人MAPK通路检测试剂盒(AAH-MAPK-1)和凋亡检测试剂盒(AAH-APO-1-2),由RayBio公司提供检测分析。首先将膜与生物素化检测抗体混合物的孵育阻断,然后再用HRP-偶联的链霉亲和素和检测缓冲液进行孵育。紧接着利用化学发光成像系统检测图像。最后,进行密度测定和分析。该实验重复三次取其平均值。
1.9 蛋白印迹实验
从转染了HCP5 siRNA和对照siRNA的MDA-MB-231、MDA-MB-468细胞中提取蛋白进行Western blot检测。用冷RIPA缓冲液与1% PMSF混合物裂解细胞,4℃,12 000×g离心30 min。根据说明书使用BCA蛋白检测试剂盒测定样品的浓度。然后通过SDS-PAGE技术将每孔中等量的总蛋白电转移到PVDF膜上。再在摇床上用5%的BSA室温封闭膜1 h,TBST洗膜(3次/10 min)。洗好的膜用一抗(抗BIRC3抗体1∶500,抗Caspase-3抗体1∶500,抗β-actin 1∶2 500)孵育,4℃过夜。次日用TBST洗膜(3次/10 min),洗好的膜在室温下加入相应的二抗(1∶10 000)孵育1 h。再用TBST洗膜3次,在膜上均匀加入超敏化学发光液(ECL),用SageCaptureTM微型检测系统检测并采用Lanc ID分析软件计算相对密度值。
1.10 统计分析
运用SPSS 17.0软件进行统计分析,计量资料以均数±标准差表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,TNBC细胞系与正常乳腺上皮细胞系及非TNBC细胞系多组间计量资料的比较,采用Kruskal-Wallis秩和检验,细胞增殖实验用重复测量方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 HCP5在TNBC细胞系和临床样本中的表达
与正常乳腺上皮细胞系MCF-10A和其他非TNBC细胞系MCF-7、T47D、SK-BR-3、MDA-MB-453相比,MDA MB-231和MDA-MB-468这两种TNBC细胞系中的HCP5 mRNA表达量明显升高(P<0.05)(图1A)。与30例浸润性导管癌癌旁正常组织以及其他亚型乳腺癌组织相比,HCP5 mRNA在TNBC中表达上调,差异具有统计学意义(P<0.05)(图1B)。为了验证我们的结果,我们从癌症基因组图谱(TCGA)数据库下载了含有1 095个临床浸润性乳腺癌样本和113个非肿瘤乳腺组织数据,其中包含115个TNBC样本。与非肿瘤乳腺组织以及TCGA数据集中的其他分子亚型相比,HCP5在基底样乳腺癌中的表达量上调(P<0.01),但是HCP5的表达量在正常乳腺与未分型的乳腺癌两组中无统计学差异(图1C)。
2.2 敲低HCP5对TNBC细胞凋亡和增殖的影响
CCK-8结果显示,转染24 h后,与对照组MDA-MB-231 siNC和MDA-MB-468 siNC相比,MDA-MB-231 siHCP5和MDA-MB-468 siHCP5组细胞增殖明显受到抑制(P<0.01)(图2A)。细胞存活/死亡实验结果表明,与对照组MDA-MB-231 siNC和MDA-MB-468 siNC相比,MDA-MB-231 siHCP5和MDA-MB-468 siHCP5组的细胞凋亡增加(P<0.01)(图2B)。
2.3 敲低HCP5对TNBC细胞体内成瘤能力的影响
用慢病毒转染的方法建立MDA-MB-231和MDA-MB-468的HCP5敲低稳转细胞系(MDA-MB-231-shNC、MDA-MB-231-shHCP5和MDA-MB-468-shNC、MDA-MB-468-shHCP5),分别接种于裸鼠背部皮下。结果显示,与MDA-MB-231-shNC和MDA-MB-468-shNC相比,MDA-MB-231-shHCP5和MDA-MB-468-shHCP5组肿瘤生长缓慢,肿瘤的重量明显降低(P<0.01)(图3A,C),肿瘤的体积也明显减小(P<0.01)(图3B,D)。
2.4 HCP5调控TNBC进展的途径
采用抗体芯片技术检测了敲低HCP5的MDA-MB-231细胞系和对照细胞系中MAPK通路和凋亡通路蛋白的表达。结果显示,MAPK通路中两组细胞系之间蛋白表达差异没有统计学意义(图4A);而凋亡通路检测结果发现,HCP5稳定敲低的细胞中,凋亡抑制因子BIRC3的表达显著降低,Caspase-3的表达增加(P<0.05)(图4B)。Western blot检测的结果也显示了相同的趋势:在两组细胞中,敲低HCP5的细胞BIRC3表达量下降,其下游因子Caspase-3表达量增加,差异具有统计学意义(P<0.05)(图4C)。
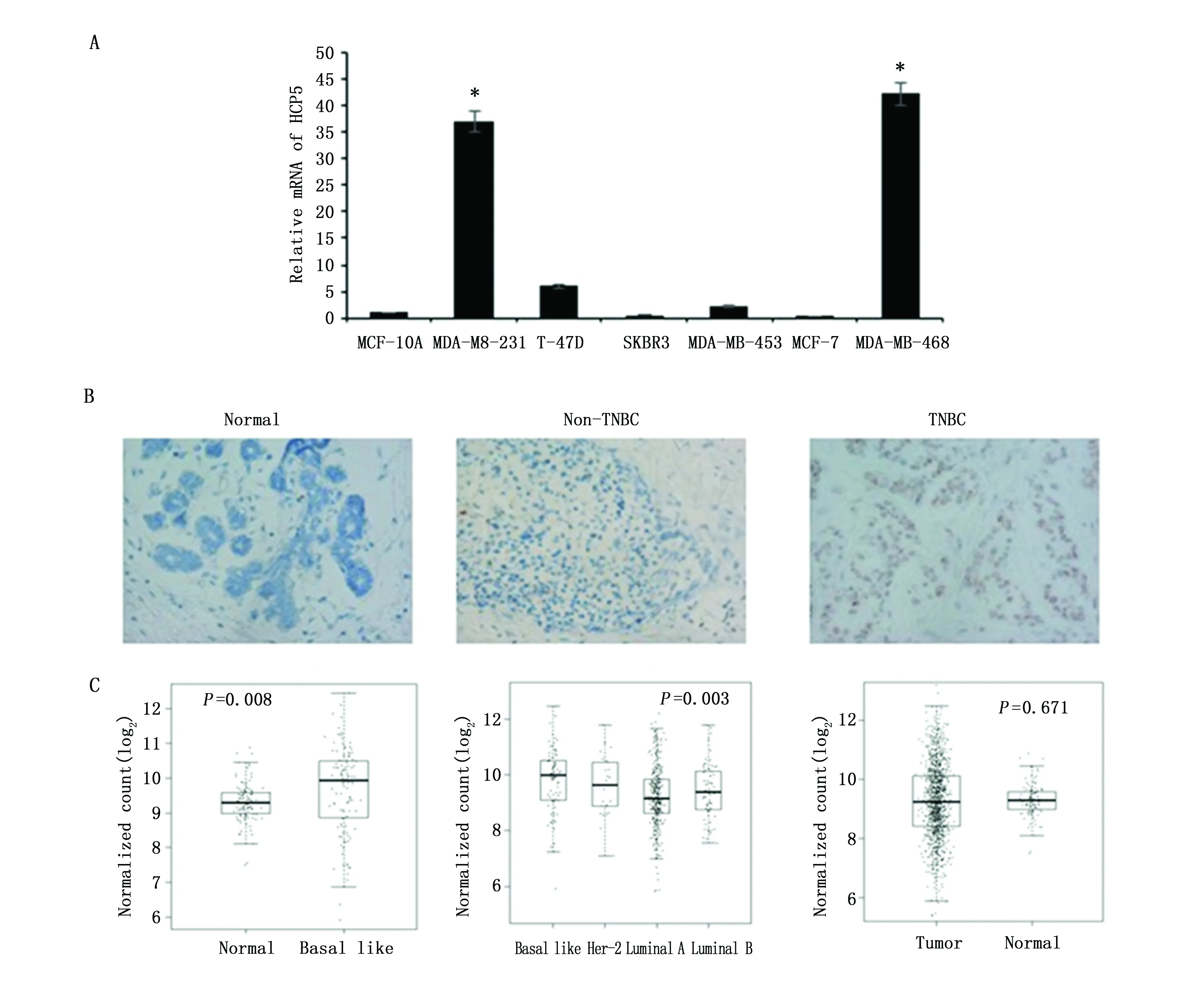
图1 HCP5在乳腺癌细胞和组织中的表达Figure 1 The expression of HCP5 in breast cancer cells and breast cancer tissuesNote:A.The expression of HCP5 was higher in TNBC cell lines than that in normal breast epithelial cell line MCF-10A and other breast cancer cell lines.*P<0.05,when compared with other cell lines;B.The RNA Scope detection showed that the expression of HCP5 was significantly up-regulated in TNBC tissues than that in adjacent normal tissues and other breast cancer subtype tissues(400×);C.The expression of HCP5 was higher in basal-like breast cancers than that in normal breast tissues and other subtypes from the TCGA database.
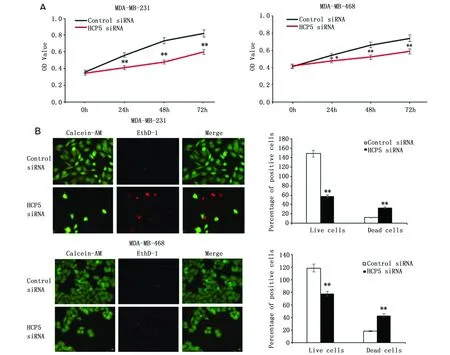
图2 敲低HCP5对TNBC细胞凋亡和增殖的影响Figure 2 Effect of knockdown HCP5 on apoptosis and proliferation of TNBC cellsNote:A.The CCK-8 assay was performed to measure the proliferation of MDA-MB-231 and MDA-MB-468 cells.*P<0.05,**P<0.01;B.Knockdown HCP5 promoted apoptosis of MDA-MB-231 cells and MDA-MB-468 cells as shown by Calcein-AM/EthD-1 staining.Green:live cells,Red:dead or dying cell(400×).
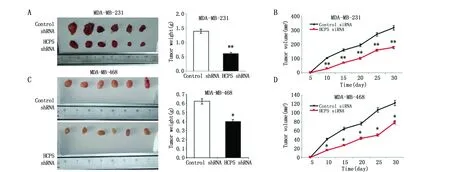
图3 敲低HCP5对TNBC细胞体内成瘤能力的影响Figure 3 Effects of knockdown HCP5 on orthotopic tumor in nude miceNote:A.The representation picture and tumor weight of tumor formation of xenograft from lv10-sh-control and lv10-sh-HCP5 MDA-MB-231 cells in nude mice(n=6);B.The summary for tumor volume was measured in nude mice every 5 days;C.The representation picture and tumor weight of tumor formation of xenograft in nude mice(n=6);D.The summary for tumor volume was measured in mice every 5 days.*P<0.05,**P<0.01,when compared with the control group.
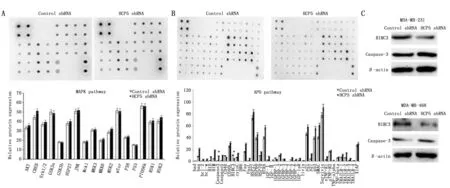
图4 HCP5调控TNBC进展的途径Figure 4 The mechanisms of HCP5 in the regulation of TNBC cellsNote:A.The MAPK antibody array showed no difference between wild and HCP5 knockdown MDA-MB-231 cells;B.The representative picture of APO antibody array showed an obviously decreased expression of BIRC3 and increased expression of caspase-3 in HCP5 knockdown MDA-MB-231 cells(n=3);C.HCP5 knockdown decreased the expression of BIRC3 protein and increased the expression of Caspase-3 protein in MDA-MB-231 and MDA-MB-468 cells.*P<0.05,when compared with the control group.
3 讨论
乳腺癌是女性最常见的恶性肿瘤,严重危害患者的身心健康[10]。同时在世界上大部分地区,乳腺癌的发病率和死亡率均居当地妇女恶性肿瘤之首。而TNBC作为乳腺癌恶性程度最高的亚型,由于其致病机制的复杂性,缺乏有效的治疗靶点,因此一直没有较好的治疗措施。
lncRNA是肿瘤发生发展过程中必不可少的调节因子[11-12],在肝细胞癌、卵巢癌、肺腺癌等许多癌症中人们发现了lncRNA HCP5的异常表达。然而,HCP5在乳腺癌中的作用机制尚不明确。
本研究用qPCR和RNA Scope方法检测了乳腺癌细胞系和临床样本中HCP5的表达量,发现HCP5在TNBC细胞系和临床样本中的表达量显著升高。为了进一步了解HCP5在TNBC中的作用机制,我们敲低了内源性HCP5,发现敲低HCP5可以增加TNBC细胞的凋亡,抑制细胞的增殖和裸鼠体内肿瘤的生长。因此,我们推测HCP5在TNBC中的表达上调可能促进了肿瘤的恶性进展。于是,我们通过抗体芯片对调控细胞增殖的MAPK通路和凋亡通路的蛋白进行检测,并用Western blot进行验证,我们发现当敲低HCP5时,MAPK通路蛋白表达没有显著差异,但凋亡通路中的凋亡抑制因子BIRC3表达量下降,而其下游凋亡因子Caspase-3表达量增加,说明细胞的凋亡过程与TNBC的进展密切相关。已知BIRC3是一种典型的细胞凋亡抑制剂,它通过抑制细胞凋亡来促进癌细胞的存活,是许多癌症的潜在致癌基因[13-14]。由此我们推测HCP5通过抑制肿瘤细胞凋亡促进TNBC恶性进展,但其调控BIRC3及Caspase-3的确切机制尚有待进一步研究。
综上所述,lncRNA HCP5在TNBC中显著上调,并通过调控细胞凋亡通路促进TNBC的恶性进展。此外,我们的研究强调了HCP5的作用,并证明靶向HCP5可能是TNBC患者的一种有前途的治疗策略。然而,HCP5能否作为治疗TNBC的分子靶点尚需进一步临床验证。
