miR-182对直肠癌细胞增殖、侵袭及Foxo3a/Wnt/β-catenin通路的调节作用
2020-08-20张艳玲刘小庆冉凤伟
陈 灿 张艳玲 刘小庆 冉凤伟
结直肠癌是我国常见的消化道恶性肿瘤之一,且近年来的发病率呈不断升高的趋势[1],但具体的机制并未阐明。虽然随着新型放化疗方案及新型靶向治疗药物的问世及应用,结直肠癌的治疗手段不断丰富,但中晚期结直肠癌患者的整体预后并不理想[2]。肿瘤的复发和转移是影响预后的主要原因,而癌细胞的增殖和侵袭又与肿瘤的复发和转移密切相关。因此,探明直肠癌增殖及侵袭的调控机制对深入认识疾病的发病机制具有重大意义。微小RNA(microRNA,miRNA)是一类在转录后水平发挥基因表达调控作用的小分子RNA,多种miRNA在恶性肿瘤的发生发展过程中通过靶向原癌基因或抑癌基因而起到相应作用。已有研究表明,miR-182在结直肠癌病灶内呈显著高表达[3-4];另有研究证实,miR-182能够靶向包括胶质瘤在内的多种癌细胞中的Foxo3a/Wnt/β-catenin通路[5]。基于此,本实验将探究miR-182对直肠癌细胞增殖、侵袭及Foxo3a/Wnt/β-catenin通路的调节作用,旨在阐明miR-182在直肠癌发生中的作用及可能机制。
1 材料与方法
1.1 临床样本
收集2016年6月—2019年7月在我院手术切除的直肠癌标本及癌旁标本,均经术后病理诊断为直肠癌且术前未接受过放化疗。共56例直肠癌标本及56例对应的癌旁标本,年龄42~62岁,平均51.38±9.82岁,男性36例,女性20例。
1.2 材料
直肠癌细胞株HT29、SW620、HCT-116及正常肠上皮细胞HIEC胞购自中科院上海细胞库;Lipofectamine2000试剂购自Invitrogen公司;miR-182模拟物、阴性对照(NC)模拟物购自上海吉玛公司;miRNA提取试剂盒、miRNA cDNA第一链合成试剂盒、miRNA荧光定量PCR检测试剂盒均购自北京康为世纪公司;MTS试剂盒购自Promega公司,Foxo3a、Wnt2、β-catenin的单克隆抗体均购自Abcam公司。
1.3 方法
1.3.1 细胞培养及分组处理
SW620细胞在含有10%胎牛血清的RPMI-1640培养基中贴壁培养,融合至90%后用0.25%胰蛋白酶消化传代。传代后的细胞接种在培养板内并进行分组,对照组用不含药物的RPMI-1640培养基处理,NC组转染NC模拟物,miR-182组转染miR-182模拟物。
1.3.2 miR-182表达的检测 分组处理24 h后,用miRNA提取试剂盒分离细胞中的miRNA,用miRNA cDNA第一链合成试剂盒将miRNA反转录为cDNA,用miRNA荧光定量PCR检测试剂盒对cDNA进行扩增。MiR-182的正向引物序列为:5′-ATGCTAGCATCGTACGTA-3′,反向引物序列为试剂盒内的通用引物;U6的正向引物序列为:5′-GCTTCGGCAGCACATATACTAAAAT-3′,反向引物序列为:5′-TAGTAGCTAGCTAGCTAGCTGTAT-3′。反应后软件自动生成循环曲线及循环阈值,以U6为内参计算miR-182的表达量。
1.3.3 细胞增殖活力的检测 分组处理24 h后,取MTS试剂盒的20 μL检测液加入培养孔内,在培养箱内继续培养4 h,而后将培养板放置在酶标仪上测定490 nm波长对应的吸光光度值。
1.3.4 细胞侵袭及迁移活力的检测 分组处理时,在Transwell的上室内预铺基质胶,细胞用不含血清的RMPI-1640培养基接种在Transwell的上室内,下室内加入含有10%胎牛血清的RMPI-1640培养基,分组处理24 h后取出小室,用棉签擦去上室内残留的细胞,而后用4%多聚甲醛固定、结晶紫染色,显微镜下观察随机视野内侵袭细胞的数目;另取分组处理时的细胞,直接将细胞接种在Transwell的上室内,按照侵袭检测的相同方法检测迁移数目。
1.3.5 信号通路分子表达的检测 分组处理24 h后,用RIPA裂解液裂解细胞并提取蛋白,4℃、12 000转/min离心10 min后收集蛋白上清,与上样缓冲液混合后煮沸5 min,而后将样本加入SDS-PAGE进行电泳,电转至NC膜后用5%脱脂牛奶封闭1 h,4℃孵育1∶1 000稀释的Foxo3a、Wnt2、β-catenin抗体或1∶5 000稀释的β-actin抗体,过夜。次日,NC膜用1∶2 000稀释的第二抗体室温孵育2 h,最后用ECL显影得到蛋白条带,根据条带的灰度值计算蛋白表达量。
1.3.6 统计学方法 采用SPSS21.0软件录入数据,本研究计量资料均满足正态性和方差齐性,以均值±标准差表示,癌组织与癌旁组织的比较采用配对t检验,多组间比较使用方差分析,SNK-q检验进行两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 直肠癌组织及癌旁组织中miR-182表达的比较
实时荧光定量PCR检测miR-182表达量结果显示,直肠癌组织中miR-182的表达量(2.14±0.55)明显高于癌旁组织(1.06±0.24),差异有统计学意义(P<0.05)(图1)。
2.2 直肠癌细胞株及正常肠上皮细胞株中miR-182表达的比较
实时荧光定量PCR检测显示,直肠癌细胞株HT29、SW620、HCT-116中miR-182的表达量分别为(1.77±0.34)、(2.31±0.61)、(1.61±0.32),均明显高于正常肠上皮细胞HIEC(1.05±0.26),差异有统计学意义(P<0.05),且SW620细胞中miR-182表达增加最显著,后续选择SW620细胞进行功能实验(图2)。

图1 直肠癌组织及癌旁组织中miR-182的表达Figure 1 The expression of miR-182 in rectal cancer and adjacent tissuesNote:*P<0.05,when compared with adjacent tissues.
2.3 miR-182模拟物转染效率的检测
实时荧光定量PCR检测显示,转染miR-182模拟物后24 h,miR-182组SW620细胞中miR-182的表达量(2.41±0.52)明显高于对照组(0.98±0.14)和NC组(1.02±0.19),差异有统计学意义(P<0.05)(图3)。
2.4 miR-182模拟物转染后SW620细胞的增殖活力
MTS法检测SW620细胞活力值OD490显示,转染miR-182模拟物后24 h,miR-182组SW620细胞的OD490值(194.35±18.15)%明显高于对照组(100.0±14.94)%和NC组(102.34±18.34)%,差异有统计学意义(P<0.05)(图4)。
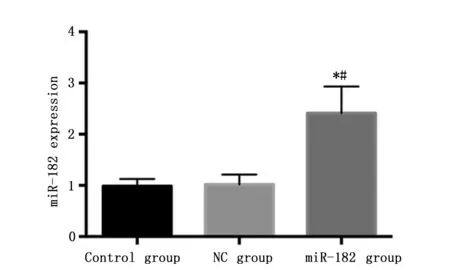
图3 实时荧光定量PCR检测转染后SW620细胞中miR-182的表达水平Figure 3 The expression of miR-182 in SW620 cells transfected with miR-182 mimicsNotes:*P<0.05,when compared with the control group;#P<0.05,when compared with the NC group.

图4 MTS法检测转染后的SW620细胞活力Figure 4 The viability of SW620 cells transfected with miR-182 mimicsNotes:*P<0.05,when compared with the control group;#P<0.05,when compared with the NC group.
2.5 miR-182模拟物转染后SW620细胞的侵袭活力
Transwell检测SW620细胞侵袭活力显示,转染miR-182模拟物后24 h,miR-182组的迁移及侵袭细胞数目明显高于对照组和NC组,差异有统计学意义(P<0.05)(图5,图6)。

图5 Transwell检测转染后的SW620细胞侵袭活力Figure 5 The invasive viability of SW620 cells transfected with miR-182 mimicsNotes:*P<0.05,when compared with the control group;#P<0.05,when compared with the NC group.

图6 Transwell检测转染后的SW620细胞迁移活力Figure 6 The migrated viability of SW620 cells transfected with miR-182 mimicsNotes:*P<0.05,when compared with the control group;#P<0.05,when compared with the NC group.
2.6 miR-182模拟物转染后SW620细胞中Foxo3a/Wnt/β-catenin通路的表达
Western blot检测SW620细胞中Foxo3a、Wnt2、β-catenin的表达量显示,转染miR-182模拟物后24 h,miR-182组SW620细胞中Foxo3a的蛋白表达量明显低于对照组和NC组,Wnt2、β-catenin的蛋白表达量明显高于对照组和NC组,差异有统计学意义(P<0.05)(表1,图7)。

表1 三组SW620细胞中Foxo3a、Wnt2、β-catenin表达量的比较
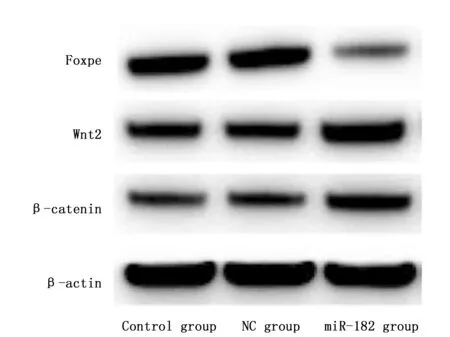
图7 Western blot检测转染后SW620细胞中Foxo3a、Wnt2、β-catenin的表达量Figure 7 The expression of Foxo3a,Wnt2,and β-catenin proteins in SW620 cells transfected with miR-182 mimics
3 讨论
我国结直肠癌的发病率呈逐年升高趋势,但疾病的早期诊断率仍较低,多数患者确诊时已经发展至中晚期,尽管通过根治性手术、放化疗、靶向治疗等能够取得一定疗效,但中晚期结直肠癌患者的5年生存率较低整体预后并不理想。癌细胞增殖及侵袭所造成的病灶复发及转移是影响结直肠癌患者预后的重要因素,探究癌细胞增殖及侵袭的调控机制一直是该领域的研究热点。近年来,miRNA与多种恶性肿瘤发生发展的关系受到了广泛关注,miRNA本身不具备编码功能,其生物学作用的发挥依赖于在转录后水平对靶基因表达的负调控。miRNA能够靶向原癌基因或抑癌基因,当miRNA的表达发生异常时,能够引起相应原癌基因或抑癌基因表达的变化,进而导致恶性肿瘤的发生发展[6-7]。
miR-182是具有促癌作用的miRNA,多项细胞研究证实,miR-182对乳腺癌、口腔癌等癌细胞的增殖、侵袭具有促进作用[8-10]。另有研究报道,miR-182在结直肠癌中呈显著高表达的趋势,但关于miR-182对结直肠癌细胞增殖、侵袭的影响尚未见报道。本实验通过转染miR模拟物的方式来使直肠癌细胞中的miR-182发生过表达,在转染24 h后,miR-182组细胞中miR-182的表达量明显高于对照组,说明转染miR-182的模拟物显著增加了直肠癌细胞中miR-182的表达。在增加miR-182的表达后,分别通过MTS法和Transwell对细胞的增殖和迁移活力进行了测定,研究结果显示:转染miR-182的模拟物能够使癌细胞的增殖活力和侵袭活力均增强,说明miR-182对直肠癌细胞的增殖和侵袭具有促进作用,这也与miR-182在其他恶性肿瘤中的作用相一致。
Chen等[11]和Cao等[12]分别在肺癌和肝癌中研究了miR-182的靶基因。在肺癌中,miR-182能够靶向Foxo3a并引起放疗抵抗;在肝癌中,miR-182能够靶向Foxo3a并促进增殖和侵袭。Foxo3a是一类抑癌基因,能够靶向抑制Wnt/β-catenin通路,阻断Wnt/β-catenin对细胞周期蛋白、蛋白酶等的调控,进而阻碍了细胞的增殖和侵袭[13-14]。在结直肠癌中,Foxo3a的表达明显减少且与β-catenin表达的增多具有负相关关系,提示Foxo3a/Wnt/β-catenin通路在结直肠癌的发生中起到关键作用[15]。本实验在转染miR-182的模拟物后对细胞中该通路进行了分析,miR-182的模拟物能够使细胞中Foxo3a的表达减少、Wnt2及β-catenin的表达增加,说明miR-182能够靶向调节直肠癌细胞中的Foxo3a/Wnt/β-catenin通路,抑制Foxo3a的表达并使下游Wnt/β-catenin表达增多,进而通过β-catenin的功能来促进癌细胞的增殖和侵袭。
综上所述,miR-182能够促进直肠癌细胞的增殖和侵袭,其机制可能与靶向Foxo3a/Wnt/β-catenin通路相关,未来miR-182可能成为直肠癌治疗的潜在靶点。
