基于计算流体力学的腹主动脉瘤破裂风险研究
2020-08-19周治军赵珅宇李凤贺
周治军, 王 哲, 赵珅宇, 李凤贺, 王 成, 赵 渝
腹主动脉瘤(abdominal aortic aneurysm,AAA)是一类病情凶险、死亡率和病残率均很高的大血管病变,一旦发生瘤体破裂,病死率极高[1]。目前还没有可靠的方法来评估AAA潜在破裂风险。国内外学者已将计算流体力学(computational fluid dynamics,CFD)应用于动脉瘤等血管疾病领域研究[2-4],但血流动力学参数与AAA破裂预测相关性研究较少。本研究基于既往有限元分析认为动脉瘤破裂发生在高应力区域[5],假设AAA破裂发生在高壁面剪切力区域,旨在应用CFD分析真实破裂、未破裂AAA中血流动力学参数和动脉瘤内血栓指数,以便将血流速度、壁面剪切力、壁压力等局部血流动力学因素和血栓指数与AAA破裂联系起来,以探索AAA破裂风险。
1 材料与方法
1.1 临床资料
收集重庆医科大学附属第一医院2016年2月至2018年9月收治的破裂和未破裂AAA患者,排除肾上AAA、无64层螺旋CTA(德国Siemens公司)影像资料患者,最后纳入肾下破裂AAA患者12例(破裂组),未破裂AAA 26例(未破裂组)进行回顾性分析,见表1。本研究获得医院伦理审查委员会审查批准(2017-179),并取得患者和家属知情同意。
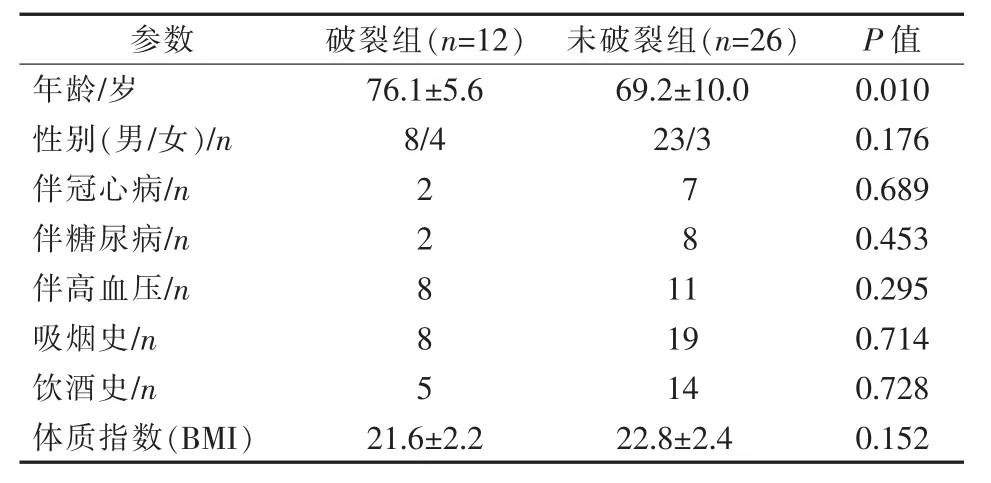
表1 两组AAA患者基本资料
1.2 建立CFD 3D模型
通过Siemens公司影像工作站下载所有入组患者入院时CTA图像资料,扫描层厚0.75 mm,并以医学数字成像和通信(digital imaging and communications in medicine,DICOM)国际标准格式保存。将DICOM格式CTA图像数据导入Mimics 19.0医学图像处理软件(比利时Materialise公司)重建目标血管3D模型,Mimics 19.0自带3-matic 11.0图像优化软件对3D模型进行网格优化和光顺处理。
1.3 边界条件设定
入口边界设为AAA上方2 cm,入口血流流速设定为0.18 m/s,入口压力设为140 mmHg(1 mmHg=0.133 kPa),出口压力设为 0 mmHg[6];血液性质可视为不可压缩的牛顿液体,密度为1.05 g/cm3,黏度为0.003 5 Pa/s;血管壁为刚性壁、无位移。根据雷诺公式Re=2ρuR/μ,计算得到各患者雷诺数,其中:ρ为血液密度;u为入口速度;R为血管半径;μ为运动黏度;数值模拟中所用控制方程为三维非定常流动的Navier-Stokes方程。
1.4 数值求解计算
采用ANSYS 15.0高级有限元分析软件(美国ANSYS公司)中Fluent模块进行求解计算。在上述边界条件下,通过CFD模拟计算得到两组AAA患者血流动力学参数。
1.5 腔内血栓指数计算
采用Mimics19.0软件测量两组AAA最大直径所在平面、破裂组实际破裂平面AAA总面积和血流面积(图1),计算出横断面腔内血栓面积,得出横断面腔内血栓指数(腔内血栓指数=横断面血栓面积/横断面瘤体面积)。
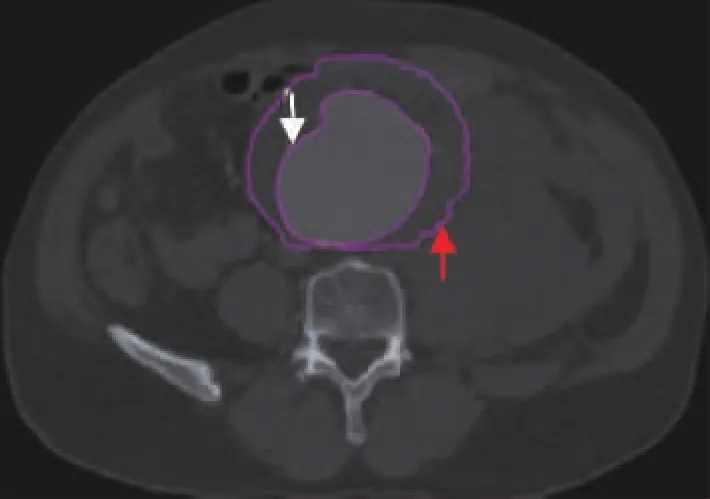
图1 在AAA分析平面测量瘤体囊腔面积区域(红箭头)、血流真腔面积(白箭头)
1.6 统计学分析
采用SPSS 23.0软件进行统计学分析。破裂组AAA自身比较用配对t检验,破裂组与未破裂组间计量资料比较用成组t检验,组间计数资料用卡方χ2或Fisher检验。P<0.05时,差异有统计学意义。
2 结果
2.1 两组瘤体最大平均直径
破裂组AAA中有4例瘤体破裂区域发生在瘤体最大直径横断面,瘤体破裂平面平均直径为(82.4±12.3) mm,最大直径平均为(86.4±13.7) mm;未破裂组瘤体最大直径平均为(53.2±11.4)mm。
2.2 腔内血栓指数
破裂组腔内血栓指数在瘤体最大直径平面为平均 0.551±0.188,在破裂平面为平均 0.630±0.190,差异有显著统计学意义(配对 t检验 P=0.002);未破裂组腔内血栓指数在瘤体最大直径平面为平均0.525±0.188, 与破裂组瘤体最大直径平面平均血栓指数比较,差异无统计学意义(成组t检验P=0.699)。
2.3 瘤体内血流特征
血流动力学分析显示,两组AAA腔内血流结构复杂,有一个优势血流通道和腔内低速涡流区,破裂组AAA破裂区域均位于涡流区。从流速流线图可看出,优势血流通道血流速度较快,涡流区域血流速度明显变慢(图2)。
2.4 瘤体内剪切力变化
血流动力学分析显示,两组AAA内壁面剪切力分布不均匀(图3)。破裂组瘤体内破裂未发生在高剪切力区域而发生在低剪切力区域,破裂区域壁面剪切力普遍较周围区域值小(图3);壁面剪切力在破裂AAA 血流最大冲击区域较高,为(0.630±0.215) Pa,而在实际破裂区域显著降低,为(0.031±0.017)Pa,差异有显著统计学意义(配对 t检验 P<0.001);未破裂AAA血流最大冲击区域壁面剪切力为(1.345±0.253) Pa,与破裂组差异有显著统计学意义(成组 t检验 P<0.001)。

图2 AAA内血流速度流线图

图3 AAA内壁剪切力分布图
3 讨论
随着CFD分析技术更多地用于医学领域分析,为基础和临床研究提供了一个很好的平台。通过分析动脉瘤血流速度、壁面剪切力、壁面压力、血流结构等流体力学参数[4,7-8],可以更好地获得患者动脉瘤血流动力学参数,更好应用于临床。
临床上及时发现并预测AAA破裂风险显得格外重要。迫切需要一种好的技术方法用于评估AAA破裂风险,从而及时处理,挽救患者生命,降低死亡率。准确预测破裂风险和破裂区域有助于了解AAA进展情况,并设计治疗方案,但如何有效地预测动脉瘤破裂风险和破裂区域是一项具有挑战性的任务。迄今尚无一种好的标准用于预测AAA潜在破裂风险和破裂区域。既往认为,AAA直径为影响瘤体破裂的主要预测因素,是判断是否手术干预的主要指征;AAA直径在男性>5.5 cm、女性>5 cm时,瘤体破裂风险较高,此时建议予以手术治疗[9]。然而,通过瘤体直径预测其破裂风险存在争议,临床上时常发现一些直径>5.5 cm动脉瘤未破裂且长期生存[10],小直径动脉瘤却发生了破裂[11-12],这表明单独应用动脉瘤直径标准评估AAA预后转归是不准确的,这值得广大临床工作者思考。因此,临床上迫切需要一种更为可靠的评估动脉瘤破裂风险的方法用于指导治疗。
本研究分析12例肾动脉下破裂AAA和26例未破裂AAA壁面剪切力,结果显示壁面剪切力在瘤体入口和出口处较高,在瘤体内逐渐减低。AAA破裂区域血流动力学分析提示,血流速度低、血流结构为涡流,壁面剪切力较周围降低,接近于零,并伴有腔内血栓大量形成,但壁面剪切力梯度较大(图3①);破裂小范围内,壁面剪切力大小存在巨大波动;同时AAA腔内出现特征性涡流,破裂发生于层流和涡流循环的边界区域(图2);破裂组与未破裂组血流最大冲击区域壁面剪切力比较显示,破裂组AAA壁面剪切力明显降低,提示AAA发生发展和破裂与局部低壁面剪切力有关。
本研究还发现,破裂组中仅有4例(33.3%)破裂发生在最大直径平面,表明并非所有AAA破裂均发生在最大直径平面区域,AAA直径大小不能完全准确地预测破裂区域;破裂组AAA破裂平面的腔内血栓指数明显高于最大直径平面的血栓指数,表明腔内血栓指数与AAA破裂区域有关,血栓指数越高的平面更容易破裂。
既往对AAA壁物理特征进行的有限元分析提示,高壁面应力与AAA破裂相关[5]。对AAA腔内血栓研究结果提示,腔内血栓能改变AAA壁应力分布[13],降低峰值壁应力,进而对 AAA起到保护作用。然而,本研究显示破裂组AAA破裂区域均发生在低剪切力、伴有腔内血栓大量形成区域,说明瘤体内低剪切力[2,14-15]、腔内血栓与 AAA 破裂有关。 同时有研究显示,高壁面剪切力可破坏动脉内皮细胞促进AAA起始形成[16-17],随后瘤腔内涡流形成、血流速度下降、血管壁剪切力下降,从而促进AAA腔内血栓形成[18]。AAA腔内血栓较厚区域局部易发生缺氧,导致局部新生血管、炎性细胞增加、血管壁变薄、细胞外基质降解[19-20],血栓形成和炎性细胞积累可能会扰乱血管壁结构完整性和稳定性,从而增加AAA破裂风险。
当然还有其他一些因素影响AAA破裂,例如血压增高将影响AAA内血流动力学稳定,血流速度增快,瘤体内壁面剪切力增大,这从一定意义上将减少腔内血栓形成,并一定程度上起到保护作用。然而,血压增高的同时血管壁所承受的壁面压力将快速增大,也将影响AAA破裂[21],综合作用下血压增高过大,AAA同样易破裂。同样,瘤体直径增大也将影响AAA血流动力学,随着瘤体内血流速度变慢,壁面剪切力更加降低,引起更多腔内血栓形成[18],血栓形成使动脉壁发生缺氧,局部新生血管炎症增加、血管壁变薄,扰乱血管壁结构完整性和稳定性,从而导致破裂。
动脉瘤发生发展是一多因素综合发展过程。动脉瘤发生发展及其破裂均与血流动力学因素和腔内血栓存在较大关系。采用CFD技术分析AAA局部血流动力学参数和腔内血栓指数,有助于更好地预测其破裂风险,更好地结合临床,及时干预治疗,这对阻止动脉瘤破裂,造福患者有重大意义。然而尽管医学影像学和CFD分析技术有了显著进展,但基于计算机的AAA破裂风险评估仍存在许多不确定性和争议。本研究分析的破裂AAA病例数较少,需要更多病例数研究加以验证。
综上所述,血流动力学参数结合腔内血栓指数对预测AAA破裂起到一定的作用。
