电解质溶液中离子浓度大小的比较技巧与方法
2020-08-17新疆陈天赐
◇ 新疆 陈天赐
离子浓度大小的比较是常考题型之一,笔者结合自身教学体会,对电解质溶液中离子浓度大小的比较进行了归纳与总结,并给出具体的解题技巧与方法.
1 多元弱酸
[解题规律]多元弱酸溶液中离子浓度大小的一般规律:显性离子>一级电离离子>二级电离离子>水电离出的OH-.
例10.1mol·L-1的H2S溶液中所有离子浓度由大到小的排列顺序为.
在H2S溶液中有:H++S2-,根据以上解题规律得:c(H+)>c(HS-)>c(S2-)>c(OH-).
2 一元弱酸或一元弱碱的正盐溶液
[解题规律]一元弱酸的正盐溶液(或一元弱碱的正盐溶液)中离子浓度大小的一般规律:不水解离子>水解离子>显性离子>水电离出的另一离子.
例2在NH4NO3溶液中所有离子浓度由大到小的排列顺序为.
不水解离子:NO-3.水解离子:.溶液显酸性.根据以上解题规律得
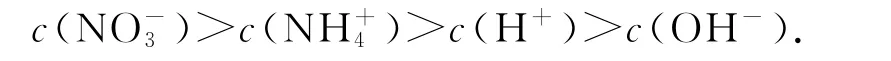
3 多元弱酸的正盐溶液
[解题规律]多元弱酸的正盐溶液中离子浓度大小的一般规律:不水解离子>水解离子>显性离子>二级水解离子>水电离出的另一离子.
例3在Na2S溶液中所有离子浓度由大到小的排列顺序为.
不水解离子:Na+.水解离子:S2-.二级水解离子:HS-.溶液显碱性.根据以上解题规律得c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+).
4 多元弱酸的酸式盐溶液
[解题规律]多元弱酸的酸式盐溶液显碱性时的规律:不水解离子>水解离子>显性离子>水电离出的另一离子>电离得到的酸根离子.显酸性时的规律:不水解离子>水解离子>显性离子>电离得到的酸根离子>水电离出的另一离子.
例4在草酸氢钠(NaHC2O4)溶液中所有离子浓度由大到小的排列顺序为.
5 两种或多种物质相混合
[解题规律]1)首先考虑混合后能否发生反应、反应后剩余物质是强电解质还是弱电解质.如果恰好完全反应,则考虑生成的物质是什么,然后按照只有一种物质作溶质进行处理;若溶液中同时存在能水解的盐和弱酸、弱碱,不特别注明则溶液通常显弱酸、弱碱的性质.2)常见的醋酸(或氨水)和醋酸钠(或氯化铵)溶液等浓度共存时,其电离大于水解,混合液显酸(碱)性.3)一元酸HA、一元碱BOH 的混合溶液中不可能出现两种阳(阴)离子浓度同时大于两种阴(阳)离子浓度的情况.
例5常温下,将a L0.1mol·L-1的NaOH 溶液与bL0.1mol·L-1的CH3COOH 溶液混合.分析各种情况时所得溶液中离子浓度的大小排列顺序.
1)若二者恰好反应得CH3COONa溶液并呈碱性时,按类型2(一元弱酸或一元弱碱的正盐溶液)技巧与方法得:c(Na+)>c(CH3COO-)>c(OH-)>c(H+).2)若反应后溶液呈酸性,溶质为CH3COONa 和CH3COOH 的 混 合 物,相 当 于 在CH3COONa和CH3COOH 的混合溶液呈中性的基础上又加入了醋酸.则大小关系:c(CH3COO-)>c(Na+)>c(H+)>c(OH-).3)若反应后溶液呈中性,溶质为CH3COONa和CH3COOH 的混合物,相当 于 CH3COONa 没 水 解.有 物 料 守 恒:c(CH3COO-)=c(Na+);质 子 守 恒:c(OH-)=c(H+);电 荷 守 恒:c(CH3COO-)+c(OH-)=c(Na+)+c (H+).大 小 关 系 为c (Na+)=c(CH3COO-)>c(OH-)=c(H+).4)当溶液呈碱性,溶质是CH3COONa和NaOH 的混合物,则大小关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)或c(Na+)>c(CH3COO-)=c(OH-)>c(H+)或c(Na+)>c(OH-)>c(CH3COO-)>c(H+).
虽然溶液中离子浓度大小的比较类型较多,但还是有规律可循的,在日常的学习中应多总结、多积累.
