弱酸中加水稀释的3种图象例析
2020-08-17湖北方小平
◇ 湖北 方小平
弱酸在水溶液中有少量分子电离为离子,存在电离平衡.在加水稀释过程中,弱酸分子继续电离,电离程度不断增大.本文主要讨论弱酸中加水稀释时溶液导电性、pH 等随溶液体积的增大而变化的图象.
1 溶液导电性变化
溶液的导电性与溶液中自由移动离子浓度和电荷数有关.溶液中离子浓度越大、电荷数越高,溶液的导电性越强.因此酸中加水稀释,溶液的导电性随溶液体积增大而减弱.
例1一定温度下,向弱酸HM 中不断加水稀释,溶液导电能力随着水量增加的变化情况如图1所示,下列说法不正确的是( ).

图1
A.“O”点导电能力为0,说明HM 没有电离
B.a 到b导电能力增强,证明溶液中离子浓度增大
C.b 点导电能力最强,说明此时HM 的电离程度最大
D.a 到b 溶液的pH 减小,b 到c溶液的pH 增大
分析 纯弱酸中没有水,没有发生电离,随着水的加入,弱酸开始电离,溶液中离子浓度增大,导电能力增强;加水量增大到一定量后,再加入水相当于稀释,虽然电离程度增大,但溶液体积增大的效应抵消了电离程度增大,因此溶液中离子浓度减小,溶液导电能力减弱.答案为C.
2 不同溶液中pH 变化
酸溶液中加水稀释,酸的电离程度增大,但溶液中c(H+)减小,溶液的pH 增大.
例2同温下,将pH和体积均相同的2 种酸HA、HB溶液分别加水稀释,其pH 随加水体积的变化如图2 所示.下列叙述正确的是( ).
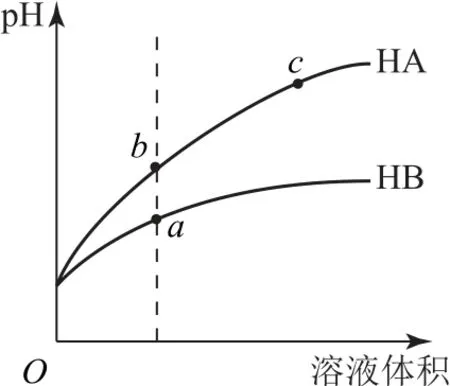
图2
A.酸性:HB>HA
B.水的电离程度:a>b
C.导电能力:c>b
D.a、c 两点中 和NaOH 的 能力:a>c
分析pH 相同的两种酸溶液,酸越弱溶液浓度越大,稀释过程中c(H+)变化越小,pH 变化越小.将pH 和体积均相同的两种酸HA、HB 溶液,随着加水量的增多,HA 的pH 变化大于HB,因此酸性:HA>HB,选项A 错误;a 点pH 小于b 点,a 点c(H+)大于b 点,对水的电离抑制程度大,水的电离程度:b>a,选项B 错 误;b 点pH 小 于c 点,b 点c(H+)大 于c 点,因此导电能力:b>c,选项C 错误;因酸性:HA>HB,pH 和体积均相同的两种酸HA、HB 溶液中,n(HB)多,中和NaOH 的能力:a>c,选项D正确.
3 溶液稀释时pH 定量变化
酸溶液稀释过程中c(H+)减小,pH 增大,对于强酸来说溶液体积增大10倍,溶液的pH 增大1个单位,而对于弱酸来说,溶液体积增大10倍,溶液的pH增大不到1个单位.
例3常温下,体积均为V0、浓度均为0.1 mol·L-1的HX、HY 两种酸溶液,分别加水稀释至体积V,pH 随的变化关系如图3所示.
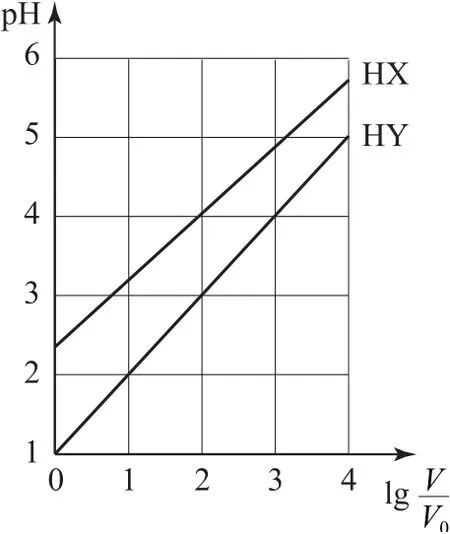
图3
(1)相同条件下,NaX和NaY 溶液的pH 大小为:NaXNaY(填“>”“<”或“=”).
分析根据酸溶液稀释的定量变化可判断酸的强弱,溶液体积增大10倍,pH 增大1个单位的是强酸,不到1个单位的是弱酸.(1)HY 酸溶液稀释10倍,pH 增大1,因此HY 是强酸;HX 的pH 变化小于1,HX 是弱酸.根据盐的水解,NaX 水解显碱性,NaY不水解,因此相同条件下,NaX 和NaY 溶液的pH 大小为NaX>NaY.(2)HX 是弱酸,部分电离;HY 是强酸,全部电离,因此时,c(X-)<c(Y-).
总之,弱酸在水溶液中存在电离平衡,加水稀释过程向电离方向移动,溶液越稀,弱酸的电离程度越大,溶液中离子浓度减小,pH 越大.
