超高压与热烫预处理对克氏原螯虾肉冻藏品质的影响
2020-08-17宇丁安子廖李汪
乔 宇丁安子廖 李汪 兰*
(1.湖北省农业科学院农产品加工与核农技术研究所,湖北省农业科技创新中心农产品加工研究分中心,湖北武汉 430064;2.湖北工业大学生物工程与食品学院,湖北武汉 430068)
小龙虾,学名克氏原鳌虾(Procambarusciarkii),原产于美国中西部、墨西哥以及古巴,二十世纪三十年代由日本传入我国南京,经过许多年的繁衍生长,目前克氏原螯虾己成为我国长江中下游地区重要的淡水虾类[1]。从小龙虾产业发展报告[2]了解到,近十年来我国小龙虾总产量迅速提升,己逐渐成为我国人民夏季餐桌上必不可少的美食之一。小龙虾肉质鲜嫩、味道鲜美,具有高蛋白、低脂肪、低热量的优点。而且蛋白中富含多种人体必需氨基酸,不但包括异亮氨酸、色氨酸、赖氨酸、苯丙氨酸、撷氨酸和苏氨酸,而且还含有少量的精氨酸,营养价值极高[3]。因此延长贮藏期间克氏原螯虾的品质,保证产品风味和安全显得尤为重要。
克氏原螯虾经过热加工或超高压(Ultra-high pressure processing,UHP)处理后不仅可以杀死有害微生物及钝化酶活,还能获得较完整的外观,最大限度提高克氏原螯虾的贮藏品质并延长其货架期[4]。生虾或熟透的对虾在常温下贮藏中会有发黑并发出哈喇味的现象[5]。而充分加热会使克氏原螯虾的肌肉蛋白质变性,使虾肉质地得到一定改善。UHP技术是当前较火热的一种食品非热加工预处理方式。UHP技术是以水或其他流体为传压介质,使生物体内的化学键发生变化。研究表明UHP处理只对大分子(如蛋白质)的非共价键有显著影响,对共价键无明显影响,所以UHP处理后能最大限度地保留克氏原螯虾的原有风味与营养价值。如:常耀光等[6]利用UHP有效杀灭南美白对虾中的绝大多数微生物,抑制冷藏过程中挥发性盐基氮的积累,延长了南美白对虾的货架期。同时,UHP处理能够使虾壳和肉之间的黏连组织蛋白发生变性,使得壳肉易于分离。汪兰等[7]联合UHP及热烫辅助脱壳发现,UHP与热烫联合预处理对小龙虾脱壳具有协同增效作用,300 MPa、1 min协同热烫预处理后脱壳效率较热烫提高 47.37%。王芝妍等[8]发现使用 200 MPa 压力预处理鲜活中华管鞭虾3 min 后,脱壳效果显著提高,虾仁结构完整,且生虾肉相关质构值比直接剥壳组分别有所提高。热烫作为一种广泛使用的传统预处理,不仅可以使酶钝化、杀灭部分微生物,而且贮藏期间可以抑制营养物质、维生素的损失,保存样品原有色泽、组织状态、风味、滋味等[9]。目前,热烫在果蔬、乳制品、罐头食品等方面应用广泛,且大多技术都已成熟,但其应用到水产品贮藏保鲜领域还鲜有报道研究,尤其在甲壳类动物上。
克氏原螯虾是一类季节性很强的甲壳类动物。目前,比较不同预处理对克氏原螯虾贮藏品质的影响相关报道较少。故本实验对克氏原螯虾进行热烫(4 min)、超高压(200 MPa,5 min)的预处理,置于-18 ℃冻藏,通过比较两种处理对克氏原螯虾冻藏过程中品质的影响,为两种预处理对克氏原螯虾在脱壳、贮藏、产品品质等方面提供参考依据。
1 材料与方法
1.1 材料与仪器
鲜活的克氏原鳌虾(Procambarusciarkii) 购于湖北省武汉市白沙洲水产品批发市场;磷酸氢二钾、磷酸二氢钾 西陇化工股份有限公司;无水硫酸铜 Shanghai Macklin Biochemical Co.Ltd;醋酸、液体石蜡、氧化镁、硼酸、甲基红、溴甲酚绿、亚甲基蓝、氢氧化钾、氯化钾、尿素、盐酸、三氯乙酸、酒石酸钾钠、乙酸乙酯、2,4-二硝基苯肼、无水乙醇、十二烷基硫酸钠、顺丁烯二酸、乙二胺四乙酸 国药集团化学试剂有限公司;8-苯胺-1苯磺酸 源叶生物有限公司;牛血清蛋白、DTNB Biosharp;EGTA 飞扬生物有限公司;Tris、盐酸胍 BioFroxx GmbH。
Ta.XT 2i/50质构仪 英国Stable Micro Ssytem公司;CR-400/410色彩色差 美能达投资有限公司;G2-B便携式pH计 梅特勒-托利多仪器(上海)有限公司;722N可见分光光度计 上海仪电分析仪器有限公司;BC/BD-200HEF冰箱 青岛海尔特种电冰柜有限公司;T18 basic均质机 德国IKA公司;HH-ZK2恒温水浴锅 巩义市予华仪器有限责任公司;实验室pH计 FE20 梅特勒-托利多仪器(上海)有限公司;3K15离心机 德国Sigma;CF15R高速低温离心机 日本日立;F-4600日立荧光光谱仪 日本岛津RF5301;L2-600 MPa/2 L超高压预处理机 天津华泰森淼生物工程技术股份有限公司;BS-210型电子天平 德国Sartorius Instruments有限公司;DZD-600/S2E真空包装机 燕城神州食品机械(北京)有限公司;BS91便携式电灶 佛山市顺德区金奇电器有限公司。
1.2 实验方法
1.2.1 样品预处理 在4 ℃的冷库中去除克氏原螯虾的触须、虾钳和虾脚,并将处理后的克氏原螯虾置于碎冰环境中放置备用。将处理后的克氏原螯虾随机分成3组(对照组、超高压组、热烫组),其中5尾/袋,分别进行如下预处理。对照组:克氏原螯虾直接用聚乙烯薄膜袋真空包装。热烫组:克氏原螯虾在沸水浴高温加热4 min后,置于冰水中,表面水用滤纸吸干后用聚乙烯薄膜袋真空包装;超高压组:克氏原螯虾用聚乙烯薄膜袋真空包装后,用超高压装置处理200 MPa、5 min。3组样品预处理后共135袋,45袋/组,将所有样品置于-18 ℃冰箱中贮藏,分别于0、4、8、12、24周测定各项指标。
1.2.2 测定方法
1.2.2.1 挥发性盐基氮(TVB-N)的测定 参照GB 5009.228-2016半微量定氮法进行[10]测定样品的TVB-N值。
1.2.2.2 硫代巴比妥酸(TBA)的测定 参考Salih等[11]的方法。称取10 g虾肉于凯氏蒸馏瓶中,加入20 mL去离子水搅匀,再加入2 mL盐酸和液体石蜡,采用水蒸气蒸馏,收集50 mL蒸馏液。取5 mL蒸馏液与5 mL TBA醋酸溶液于25 mL比色管中充分混匀,于100 ℃水浴35 min后冷却10 min,在535 nm处测吸光度(A)。以去离子水取代蒸馏液为空白样。
TBA(mg/g)=A×7.8×10-2
式(1)
1.2.2.3 pH测定 用pH标准校正缓冲液校正便携式pH计,然后用蒸馏水冲洗探头,用滤纸擦拭干净,将便携式pH计探头插入虾仁中,分别测定对照组、热烫组、超高压组样品的pH。
1.2.2.4 水分的测定 参照GB 5009.3-2016[12]直接测定法测定样品的水分含量
1.2.2.5 质构的测定 取克氏原螯虾肌肉,利用质构仪对其进行质地多面分析(Texture profile analysis,TPA),测定其硬度、弹性、咀嚼性和粘着性。并将虾仁置于质构仪P/36 R探头下选取穿刺剪切力模式对样品进行嫩度,虾仁的放置方向保持与探头方向垂直,测试条件为:测前速度:2 mm/s;测试速度:0.5 mm/s;测后速度:2 mm/s;测试深度(应变):5 mm;触发力:5 g;计算值为20。导出所测数据,所有测试均有至少12个平行样,取平均值。
1.2.2.6 色泽的测定 将虾壳剥去,取虾仁第一关节,用色差计测定样品的颜色,将探头垂直放在样本第一关节肌肉上,测量并记录L*、a*、b*值。
1.2.2.7 肌原纤维蛋白的提取 参考任丽娜[13]的方法,取3 g小龙虾肉(去壳后虾肉剁碎),加入10 倍体积以预冷过的Tris-马来酸缓冲液(50 mmol/L KCL-20 mmol Tris-马来酸,pH7.0),用均质机匀浆,低温离心(9000 r/min,10 min,4 ℃)取出后弃去上清液,重复洗涤2次。所得沉淀与Tris-马来酸缓冲液(0.6 mol/L KCl-20 mmol/L Tris-马来酸,pH7.0)用搅拌机匀浆,放入冰箱4 ℃提60 min,取出后低温离心(9000 r/min,30 min,4 ℃),所得上清液为肌原纤维蛋白溶液。每组至少三个平行,其中热烫组的肌原纤维蛋白提取未成功,故蛋白类指标只有对照组与超高压组比较。
1.2.2.8 肌原纤维蛋白浓度测定 采用双缩脲方法绘制蛋白浓度标准曲线:分别取6只试管,加入0、0.2、0.4、0.6、0.8、1.0 mL牛血清蛋溶液(10 mg/mL),用蒸馏水定容至1 mL,然后分别加入4 mL双缩脲试剂,于室温下放置30 min,在560 nm下测吸光度。分别以浓度和吸光度值为X和Y轴,建立回归方程y=0.2585x+0.0013(R2=0.9995)。
1.2.2.9 总巯基测定 参照董开成[14]方法,取1 mL肌原纤维蛋白样品溶液(0.4%),加入9 mL 0.2 mol/L Tris-HCl(其中含8 mol/L尿素,10 mmol/L EDTA,2% SDS,pH7.0)缓冲液,混匀后在室温下放置30 min,取4 mL,加入0.4 mL 0.1% DTNB(0.2 mol/L Tris-HCl,pH8.0);在40 ℃反应25 min后,测定412 nm处的吸光值,对照液用0.6 mol/L KCL-20 mmol/L Tris-马来酸溶液代替样品溶液外,其他试剂均一样。计算公式如下:
式(2)
式中:X-总巯基摩尔浓度,mol/g;C0-肌原纤维蛋白质浓度,mg/mL;A-412 nm处的吸光值;D-稀释倍数;ε-摩尔消光系数,13600 L/(mol·cm)。
1.2.2.10 活性巯基测定 取1 mL肌原纤维蛋白样品溶液(0.4%),加入9 mL 0.2 mol/L Tris-HCl(10 mmol/L EDTA,2% SDS,pH7.0)缓冲液,混匀后在室温下放置30 min,取4 mL,加入0.4 mL 0.1% DTNB(0.2 mol/L Tris-HCl,pH8.0);在40 ℃反应25 min后,测定412 nm处的吸光值,对照液用0.6 mol/L KCL-20 mmol/L Tris-马来酸溶液代替样品溶液外,其他试剂均一样。计算公式如下:
式(3)
式中:X-活性巯基摩尔浓度,mol/g;C0-蛋白质浓度,mg/mL;A-412 nm处的吸光值;D-稀释倍数;ε-摩尔消光系数,13600 L/(mol·cm)。
1.2.2.11 羰基化合物测定 羰基化合物含量测定参照 Estévez等[15]的方法并稍作修改。取0.5 mL肌原纤维蛋白溶液(0.4%)分装于离心管中,其中一管加入2 mL 2,4-二硝基苯肼(DNPH)溶液(10 mmol/L,用2 mol/L HCl溶解),另一管加入2 mL 2 mol/L HCl溶液作为对照组。室温条件下避光静置1 h(每10 min涡漩混匀)。随后加入2.5 mL 20%三氯乙酸沉淀蛋白,11000×g离心3 min,取沉淀用2 mL乙酸乙酯/乙醇(1∶1,v/v)洗涤3次,留沉淀。加入6 mL 6 mol·L-1的盐酸胍溶解沉淀,室温放置10 min后11000×g离心3 min,在370 nm波长下测定上清液的吸光度。蛋白质中的羰基含量(nmol/mg蛋白质)使用分子吸光系数22000 L·(mol·cm)-1计算。
式(4)
式中:X-羰基化合物摩尔浓度,mol/g;C0-肌原纤维蛋白质浓度,mg/mL;A-370 nm处的吸光值;D-稀释倍数;ε-摩尔消光系数,22000 L/(mol·cm)。
1.2.2.12 Ca2+-ATPase酶活测定 采用南京建成生物工程研究所提供的超微量Ca2+-ATPase酶测试盒测定。
1.2.2.13 表面疏水性的测定 参考李清正等[16]方法,略作修改。以1-苯奈氨-8-磺酸(8-anilino-1-naphthalenesulfonicacid,ANS)作为荧光探针,用pH7.0的0.6 mol/L KCl-10 mmol/L磷酸盐缓冲液将肌原纤维蛋白质量浓度分别调至0.1、0.2、0.3、0.5 mg/mL。4种质量浓度的蛋白溶液各取4 mL,加入20 μL pH7.0含8 mmol/L ANS的0.1 mol/L磷酸盐缓冲液,混匀后用荧光分光光度计测定,条件为:激发波长和发射波长分别为390和470 nm,宽均为5 nm。用荧光强度对蛋白质浓度的斜率表示蛋白质表面疏水性。
1.2.2.14 内源荧光光谱 参考朱姝冉等[17]方法,略作修改。取3 mL肌原纤维蛋白溶液(1 mg/mL),置于1 cm四通石英比色皿中,以280 nm为激发波长,在荧光分光光度计上记录270~450 nm波长范围内的荧光发射光谱。发射光谱的操作条件为:扫面范围270~450 nm,扫描速度2400 nm/min,激发狭缝和发射狭缝宽均为2.5 nm,响应时间为0.5 s,记录数据波长间隔为1 nm。
1.3 数据处理
蛋白变性相关实验每组至少三个平行,理化与感官实验每组至少6个平行。所有试验数据采用SPSS 20.0进行差异显著性分析,并用GraphPad Prism 5.0、OriginPro 2017 SR 2处理、作图。
2 结果与分析
2.1 不同预处理对克氏原螯虾挥发性盐基氮(TVB-N)含量的影响
TVB-N值是评价水产品新鲜度的重要指标之一,也是评价水产品新鲜度最常用方法[18]。克氏原螯虾在-18 ℃冻藏过程中,由于酶和微生物的作用,蛋白质被分解而产生氨类碱性含氮挥发性物质,其含量越高表明蛋白质被破坏程度越高。我国的水产品卫生标准TVB-N标准为20 mg/100 g。根据图1分析,整个冻藏周期中克氏原螯虾的TVB-N含量最高为17.14 mg/100 g,仍符合清水虾的一级鲜度标准(20 mg/100 g)[19]。不同预处理下,随着冻藏时间的推移,冻克氏原螯虾的TVB-N含量有显著差异(P<0.05)。热烫组前8周的TVB-N含量变化不大,8周后开始显著上升(P<0.05)。可能原因是,克氏原螯虾经热烫预处理后能够有效地杀死一定量微生物以及真空包装形成缺氧环境抑制微生物生长,进而减缓蛋白质被破坏速率。而超高压组与对照组TVB-N始终呈上升趋势,且超高压组TVB-N含量始终大于对照组。这一趋势可看出UHP预处理促进蛋白质氧化,可能原因是高压使蛋白质内部中的游离氨基酸暴露,且200 MPa的处理条件较弱,不能很好地杀死微生物。

图1 不同预处理对克氏原螯虾TVB-N含量的影响Fig.1 Effects of different pretreatment techniques on thecontent of volatile base nitrogen in Procambarus clarkii注:不同小写字母代表虾经同种预处理,不同贮藏时间存在显著差异(P<0.05);不同大写字母代表同一时间内,不同预处理样品间存在显著差异(P<0.05),图2~图10同。
2.2 不同预处理对克氏原螯虾硫代巴比妥酸(TBA)含量的影响
冻藏过程中克氏原螯虾TBA值的变化情况见图2。随着贮藏时间的延长,克氏原螯虾TBA值整体呈上升趋势。预处理组在贮藏前8 周,TBA值变化趋势基本一致,而对照组8周时显著上升(P<0.05),贮藏12周超高压组TBA值下降,可能原因是脂肪氧化产物丙二醛不稳定,与虾肉中其他成分反应未被检出,导致TBA值下降[20]。热烫组贮藏前12周变化不明显,24周时显著性增大(P<0.05)。对照组前4周TBA值变化不大,8周时显著上升(P<0.05)。可能由于-18 ℃贮藏中脂肪氧化降解生成醛、醇等次级产物,使TBA值显著上升(P<0.05),表明随着冻藏时间的延长,样品的氧化程度越高[21]。综上所述,表明前12周UHP处理能有效地延缓脂肪氧化,热烫效果次之。武华等[22]在研究鳙鱼片在冻藏过程中TBA值随贮存时间的延长先升高后下降;Abreu等[23]在研究大西洋比目鱼冻藏过程脂质规律时也得出类似结论,可能原因是鱼片的脂肪含量高于虾。

图2 不同预处理对克氏原螯虾TBA含量的影响Fig.2 Effects of different pretreatment techniques on thecontent of thiobarbituric acid in Procambarus clarkii
2.3 不同预处理对克氏原螯虾水分含量与pH的影响
pH作为检测肉类新鲜度的重要指标,水分含量是影响克氏原螯虾肉口感的重要因素之一[24]。由图3可知,不同预处理的克氏原螯虾的水分含量在整个-18 ℃冻藏过程中几乎不改变。其中热烫预处理组的克氏原螯虾的水分含量从初始值80.44%下降到76.79%,大约流失水分3.65%,对照组与超高压组冻藏的克氏原螯虾的水分含量分别保持在78.23%和78.9%左右。李杰的研究表明,不同温度下冻藏的南极磷虾水分含量在前90 d变化不显著(P>0.05),与本研究结果一致,其中热烫处理流失了3.65%水分,可能原因是冻藏过程产生的干耗,随着冻藏时间的延长,干耗问题也愈发显著[19]。
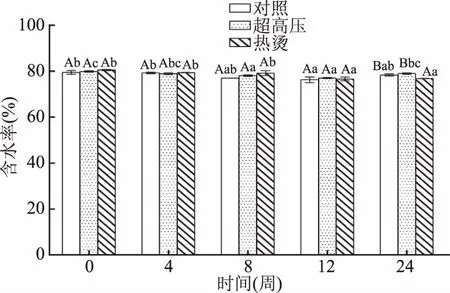
图3 不同预处理对克氏原螯虾水分含量的影响Fig.3 Effect of different pretreatment techniqueson moisture content of Procambarus clarkii
从数值上可以看出,超高压组在整个冻藏过程中克氏原螯虾pH呈现前期先下降,中期上升,后期下降的三段式趋势;而热烫组呈先上升后下降的趋势;对照组呈整体呈下降趋势,中期下降不显著。由图4可知,在冻藏-18℃条件下,24周时对照组pH显著性下降(P<0.05),超高压组0周至4周下降,第8周显著上升(P<0.05),8周后pH开始迅速减小。这可能是克氏原螯虾真空包装,使糖原的无氧酵解产生乳酸,以及ATP的分解产生磷酸根等,导致克氏原螯虾肉的pH发生快速下降[25-26]。热烫组0~4周缓慢上升,4周后开始缓慢下降。促使pH回升的原因可能与克氏原螯虾体内的酶及微生物有关。随着冻藏时间的推移,克氏原螯虾体内的蛋白质在微生物与酶的共同作用下分解,分解产物大多数呈现碱性,故使得肌肉pH缓慢回升。这与李学英等[27]研究结果一致。热烫组比超高压组克氏原螯虾pH高,这可能是虾经高温烫过后,虾表面的微生物大部分被灭杀以及酶的部分灭活,其中杀菌效果高温预处理优于本实验条件下UHP。因此,贮藏过程中热烫组pH稳定性较好[28]。

表1 不同预处理对克氏原螯虾肉质构的变化Table 1 Changes in texture of Procambarus clarkii by different pretreatment techniques
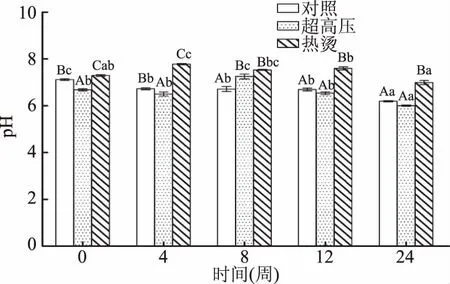
图4 不同预处理对克氏原螯虾pH的影响Fig.4 Effect of different pretreatment techniqueson pH value of Procambarus clarkii
2.4 不同预处理对克氏原螯虾肉质构的变化
TPA是模拟人的口腔,能够通过数值来直观地表述食品的各项感官指标[29]。表1为冻藏过程中克氏原螯虾的质构分析结果。随着冻藏时间的推移,克氏原螯虾样品硬度、黏性、咀嚼性等指标均呈现先上升后下降的趋势。其中,弹性值呈现出下降的趋势。硬度反映出样品达到一定程度的形变所需要的力,在评价虾的肉质时,硬度是一项重要指标[30]。咀嚼性表示食品的柔软度,主要指将固态食品咀嚼到可以吞咽时所做的功[31],咀嚼性越高,相应的嚼劲就越好,咀嚼性在数值上等于硬度和凝聚性以及弹性的乘积[14]。因此,咀嚼性数值的减小是肌肉硬度降低、弹性减小和细胞间结合力下降综合作用的结果。从表1可以看出热烫组硬度值最大,相应的咀嚼值也最大,UHP次之,表明硬度与咀嚼性呈正相关(r=0.984)。除超高压组的黏性呈前期下降,后期上升的趋势以外,克氏原螯虾肉的硬度、咀嚼性与黏性,随着冻藏时间的延长,呈现前期上升,后期下降的趋势。其中随着冻藏时间的推移,下降速率:热烫组>超高压组>对照组。

表2 不同预处理对克氏原螯虾色泽的变化Table 2 Changes in color of Procambarus clarkii by different pretreatment techniques
可能是热烫预处理使克氏原螯虾内的酶活性下降较快,蛋白质变性程度大,虾肉相应质构指标下降随之也快。而UHP可以较好地保护酶活性,故使克氏原螯虾的硬度下降较缓慢。弹性指食品在外力作用下导致食品形变,卸掉外力后形变恢复的程度。随着贮藏时间的推移,不同预处理条件下的克氏原螯虾的弹性均呈下降趋势。其中超高压组的弹性下降最为缓慢,其次是热烫组、对照组。虾肉的弹性主要由肌原纤维蛋白决定,且UHP处理对肌原纤维蛋白有修饰作用[32]。热烫预处理使虾肉肌原纤维蛋白发生变性,巯基氧化为二硫键,导致蛋白质之间更加紧密,使蛋白质形成结构复杂的凝胶,因此对克氏原螯虾肉弹性和粘着性有一定的提升效果,但温度过高或加热时间过长均会导致蛋白质凝胶出现劣化[33]。
2.5 不同预处理对克氏原螯虾肉色泽的变化
虾仁的色泽变化是表征虾腐败程度的重要参数。从表2中可以看出,对照组和预处理组样品相比,样品经UHP、热烫预处理后,随保藏期的延长,克氏原螯虾虾肉的颜色有明显变化。结果表明,超高压组与对照组,随着保藏期的延长其L*值呈现出三段式变化,先上升,再下降,最后上升。而热烫组的L*值变化不显著(P>0.05),即热烫预处理后,虾的亮度值基本固定在72左右。L*值从0~100表示黑暗色到明亮色,说明UHP处理有助于提高虾肉的亮度值,但提高效果不如热烫组。这与甘晓玲[34]在UHP预处理南美白对虾中发现的虾仁表面及内部L*随压力的升高逐步增大的结果一致。a*值由大到小代表红色到绿色。a*值在整个贮藏期中明显下降;其中三组样品在贮藏第4周时显著性下降(P<0.05),直至贮藏三个月后下降速率开始缓慢。这可能原因是随着贮藏期的推移,克氏原螯虾中微生物开始繁殖,从而导致虾肉从红色转变成绿色,而且不同预处理方式对细胞组织结构破坏程度不同,进而使虾肉中虾青素含量及其存在状态发生变化[35]。这与李高尚等[36]研究结果一致。b*值由大到小表示黄色到蓝色。贮藏末期,热烫组虾肉b*值最大,超高压组与对照组差别不大。结果表明:热烫处理对克氏原螯虾的L*与a*有护色作用,超高压组次之,对照组最差。
2.6 不同预处理对克氏原螯虾肌原纤维蛋白的影响
克氏原螯虾中的肌原纤维蛋白含量前期下降速率快,后期缓慢下降趋势。如图5所示,随着冻藏时间的增加,克氏原螯虾的肌原纤维蛋白溶出量呈现下降趋势。-18 ℃冻藏下,对照组12周时肌原纤维蛋白含量为16.92 mg/mL,已下降到新鲜量的89.67%,第12~24周,肌原纤维蛋白含量从新鲜量的89.67%下降到75.30%。超高压组第12周肌原纤维蛋白含量为15.34 mg/mL,已下降到新鲜量的62.03%,第12~24周,肌原纤维蛋白含量从新鲜量的62.03%下降到54.83%。超高压组肌原纤维蛋白含量下降原因可能是肌原纤维蛋白球状头部结构在压力的作用下,空间构象变化较显著[37]。图5可见,0周时超高压组肌原纤维蛋白含量远大于对照组,随着冻藏时间的增加,第8周后,超高压组蛋白含量显著下降(P<0.05)且对照组肌原纤维蛋白值大于超高压组。结果表明UHP预处理后的一定程度上促进肌原纤维蛋白溶出,但随着冻藏时间的增加,超高压组可很好的锁住肌原纤维蛋白的溶出。任丽娜[13]通过研究发现白鲢鱼肉的肌原纤维蛋白溶出量前期呈现快速下降,后期趋于平缓,这与本研究变化趋势基本一致。由于热烫预处理加热克氏原螯虾时间过长对蛋白质产生不可逆的负面影响,导致热烫组的肌原纤维蛋白提取未成功,所以热烫预处理的蛋白类指标均未测定,该实验现象已被王振宇等[38]解释。
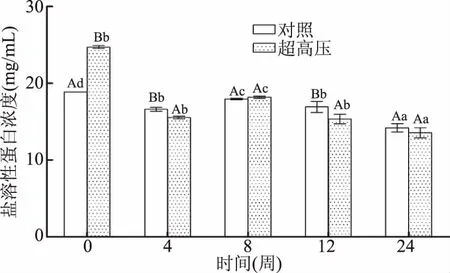
图5 不同预处理对克氏原螯虾肌原纤维蛋白含量的影响Fig.5 Effects of different pretreatment techniqueson myofibrillar protein content in Procambarus clarkii
2.7 不同预处理对克氏原螯虾巯基含量的影响
巯基的变化情况可以表征蛋白质的变性程度。如图6所示,在-18 ℃贮藏下,经过同一预处理,随着贮藏时间的延长,呈现出明显差异。不同预处理,同一时间内(除0周、8周外),对照组、超高压组有显著性差异(P<0.05)。总巯基包含活性巯基和分子内部的巯基,整个储藏过程中,活性巯基含量小于总巯基含量。-18 ℃冻藏下,对照组8 周时总巯基含量为3.65 μmol/g,已下降到新鲜的50.91%。超高压组的小龙虾第0周总巯基含量为7.67 μmol/g,经过4、8、24 周冻藏后,分别下降到新鲜量的46.54%、50.20%、47.33%。可能原因是UHP技术一定程度地改善了细胞膜通透性,巯基基团易暴露到分子表面,部分与空气中的氧化剂充分反应,形成二硫键,从而导致蛋白分子的疏水性增加。郭丽萍等[39]在UHP结合热预处理的猪肉蛋白过程中发现,冻藏过程中,UHP结合热处理使猪肉蛋白中的巯基暴露,被空气中氧气氧化,加快二硫键的形成,导致总巯基含量下降,与本研究趋势相似。

图6 不同预处理对克氏原螯虾巯基含量的影响Fig.6 Effects of different pretreatment techniques on thecontent of sulfhydryl groups in Procambarus clarkii
-18 ℃冻藏,对照组第12周活性巯基含量为3.6 μmol/g,已下降到新鲜量的72.29%,12~24周,活性巯基含量从新鲜量的72.29%下降到55.82%,前期快速下降,后期则变化比较缓慢。超高压组0周时活性巯基含量为4 μmol/g,经过4、12、24周冻藏后,分别下降到新鲜量的81.25%、84.50%、44.00%。随着冻藏时间的增加,肌原纤维蛋白样品的活性巯基含量明显降低,前期下降速率快、中期下降慢。这一现象原因可能是蛋白质的氧化变性形成蛋白质聚集体,会覆盖一些巯基,使能够检测到的游离巯基数量减少,也导致巯基含量下降[40]。其中克氏原螯虾的巯基含量均在前4周有较快的下降速率。研究发现巯基前期快速下降的可能原因是,蛋白质冻藏过程中,冻藏产生冰晶使蛋白质变性,使分子内活性巯基暴露,而活性巯基易于氧化成二硫键,造成总巯基含量的减少,进而导致活性巯基的减少[41]。
2.8 不同预处理对克氏原螯虾羰基含量的影响
如图7所示,贮藏4月后,羰基化合物含量显著性上升(P<0.05)。克氏原螯虾在冻藏过程中,羰基化合物是蛋白质氧化后较为显著的一个变化,故将其作为表征蛋白氧化的重要指标之一。对照组克氏原螯虾0周时羰基化合物含量为32.9 nmol/g,经4、12、24周冻藏后,分别上升到新鲜量的233%、572%、1296%。超高压组羰基化合物贮藏12周含量为182.6 nmol/g,上升到新鲜的287%,12~24周时,羰基化合物含量从新鲜量的287%上升到702%,呈显著性上升(P<0.05)。羰基化合物是自然氧化的主要产物,羰基化合物的显著上升表明克氏原螯虾在贮藏期间发生了明显的蛋白氧化[42]。其中4~12周超高压组的羰基值低于对照组。羰基物质主要是通过氨基酸的脱氨反应产生的,具体可通过多种途径产生[43]。冻藏中期,虾肉经UHP处理后,蛋白质的空间构象发生改变,肌原纤维蛋白发生折叠、聚集,游离氨基酸不易暴露蛋白表面,其表征为羰基化合物上升速率低于对照组。可能原因UHP能一定程度上延缓肌原纤维蛋白的氧化,这与巯基、Ca2+-ATPase酶活的趋势相互印证。

图7 不同预处理对克氏原螯虾羰基含量的影响Fig.7 Effects of different pretreatment techniqueson the carbonyl content of Procambarus clarkii
2.9 不同预处理对克氏原螯虾Ca2+-ATPase酶活含量的影响
肌原纤维蛋白是一类综合类蛋白,主要包括原肌球蛋白、肌球蛋白、肌原蛋白、肌动球蛋白等几类,其中影响Ca2+-ATPase酶活性的主要蛋白质是肌球蛋白,其活性与肌球蛋白的头部区域密切相关,尤其是肌球蛋白头部构象的变化及聚合,可作为判断冷冻储藏期间肌球蛋白头部结构变化的较为灵敏的指标[44]。如图8所示,克氏原螯虾在-18 ℃贮藏下,超高压组与对照组的Ca2+-ATPase酶活呈下降趋势。对照组12周时Ca2+-ATPase酶活含量为0.47 μmol Pi/mg prot/10 min,已下降到新鲜的69.12%,第12~24周,Ca2+-ATPase酶活含量从新鲜量的69.12%下降到29.41%,Ca2+-ATPase酶活前期下降速率比较缓慢,后期变化较快。超高压组的克氏原螯虾第0周Ca2+-ATPase酶活含量为0.54 μmol Pi/mg prot/10 min,经过12、24周冻藏后分别下降到新鲜量的85.19%、37.04%。不同预处理,冻藏期前8周超高压组Ca2+-ATPase酶活含量显著低于对照组,但在冻藏12周后两组之间差异不显著(P>0.05)。可能原因是UHP处理后使克氏原螯虾肌球蛋白非共价键被破坏,其头部区域更加聚集,引起肌球蛋白构象的改变。Ca2+-ATPase酶活含量与肌原纤维蛋白溶出量,巯基变化呈现正相关。其中引起冻藏过程中小龙虾肌原纤维蛋白质Ca2+-ATPase酶活性下降的原因有多种。闫春子等[37]认为巯基氧化形成二硫键导致的分子聚合是Ca2+-ATPase酶活性下降的主要原因。导致Ca2+-ATPase酶活性下降的原因可能是不同处理导致蛋白质之间的化学键发生变化,引起Ca2+-ATPase酶活的下降。

图8 不同预处理对克氏原螯虾Ca2+-ATPase酶活含量的影响Fig.8 Effects of different pretreatment techniqueson Ca2+-ATPase activity in Procambarus clarkii
2.10 不同预处理对克氏原螯虾表面疏水性的影响
蛋白质表面疏水性可作为表征蛋白质分子内部疏水基团的暴露程度。如图9所示,超高压组与对照组的表面疏水性含量呈显著性上升趋势(P<0.05)。对照组克氏原螯虾第0周表面疏水性值为26.36,经过4、12、24周冻藏后,分别为新鲜量的3.79、1.69、2.95倍。超高压组的表面疏水性含量第8周含量为47.28,上升到新鲜的139%,经12、24周冻藏后,表面疏水性含量分别上升到新鲜量的255%、199%。由此可见,经过同一预处理,贮藏前期与末期表面疏水性值呈现出显著性差异(P<0.05)。不同预处理,同一储藏期内,对照组与超高压组与有显著性差异(P<0.05)。在贮藏4周时,表面疏水性值显著性上升(P<0.05),之后骤降,随之缓慢上升。4周时,表面疏水性值增加幅度大的原因,可能是由于冻藏引起蛋白质的化学键被破坏,肌原纤维蛋白质分子空间结构打开并逐渐伸展,从而破坏原有的结晶的形成,使埋藏在分子内部的巯基暴露出来,进而被氧化成二硫键,导致巯基含量减少[45-46]。这与2.7巯基的变化趋势相对应。

图9 不同预处理对克氏原螯虾表面疏水性的影响Fig.9 Effects of different pretreatment techniqueson the surface hydrophobicity of Procambarus clarkii
2.11 不同预处理对克氏原螯虾内源荧光光谱的影响
克氏原螯虾的肉质鲜嫩,具有高蛋白、低脂肪、少量微量元素等优点,且蛋白中含有许多人体必需的氨基酸。组成蛋白质的氨基酸中,除含硫氨基酸外,仅有3种氨基酸在230~310 nm间有吸收,分别是色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe),其蛋白质中含有的芳香族氨基酸残基侧链基团具有吸收紫外入射光而发射荧光的特性,据该特点来研究变性过程中蛋白质的空间构象变化[47]。本实验通过内源性荧光光谱峰的最大荧光强度值,推测出蛋白质的变性情况。
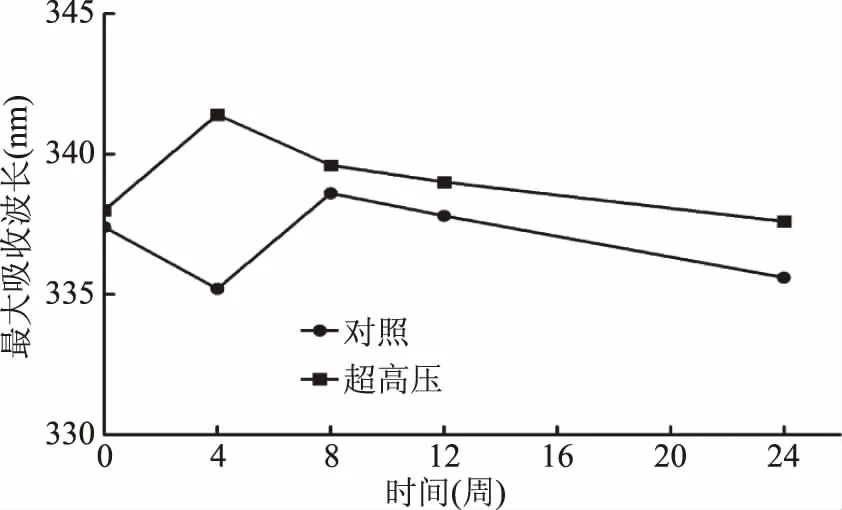
图10 不同预处理对克氏原螯虾内源荧光光谱的影响Fig.10 Effects of different pretreatment techniqueson endogenous fluorescence spectra of Procambarus clarkii
内源性荧光光谱是将激发波长设定为280 nm,观察蛋白分子中色氨酸残基的发射光谱,其最大发射波长λmax的变化反映了蛋白分子中色氨酸残基所处的微环境及暴露程度。荧光最大吸收峰红移表明色氨酸等荧光发射基团暴露于极性更大的微环境中,反之蓝移则表明发射基团周围的微环境极性减小,疏水性较大。UHP预处理克氏原螯虾,280 nm处激发时,最大吸收波长见图10,发射波长位移变化在342~337 nm。第0周时对照组样品的肌原纤维蛋白内源性荧光的最大发射波长约为337.40 nm,超高压组约为338 nm,随着冻藏时间的推移,超高压组的最大吸收峰发生先红移后蓝移的现象,超高压组肌原纤维蛋白的内源性荧光扫描最大吸收峰对应的波长λmax在第4周时到达最大,随后发生蓝移现象。而对照组样品的肌原纤维蛋白内源性荧光光谱的最大吸收峰在第8周达到最大,随后发生蓝移现象。随着冻藏时间的延长,肌原纤维蛋白的内源性荧光扫描最大吸收峰均产生蓝移现象,而超高组比对照组早4 周发生蓝移现象,可能原因是UHP技术对肌原纤维蛋白变性有一定程度的促进作用以及对色氨酸微环境影响较大。内源性荧光强度逐渐下降的原因可能是-18 ℃冻藏使虾肉中的水形成冰晶,进而破坏了肌原纤维蛋白天然的排列,蛋白展开变性使得原先位于内部的色氨酸残基暴露于表面,活性基团的暴露引起分子间作用增强,蛋白质分子的再聚集导致更多色氨酸残基被包裹于更加疏水的分子内部,从而引起肌原纤维蛋白的内源荧光强度下降[48]。
3 结论
之前研究表明,UHP技术作为当前一种热门技术,具有冷杀菌的效果,且UHP预处理有助于虾壳效率的增加[7]。课题组前期研究结果表明小龙虾经热烫处理后,虽然使虾壳上的虾青素一部分残留到虾肉上,但是虾肉却因高温变性进而与虾壳交联,不利于虾仁的完整性,不利于工业脱壳[49]。
对比不同预处理对贮藏克氏原螯虾品质的影响,超高压处理一定程度上对蛋白质的氧化起到促进作用,而热烫处理延缓蛋白质氧化。综合各个指标趋势变化,TBA、TVB-N显著上升(P<0.05)、pH整体呈下降的趋势、a*值显著下降(P<0.05),相关品质的变化说明热烫预处理有利于克氏原螯虾贮藏。且热烫预处理对虾仁的色泽具有一定的保护作用,同时获得较好的硬度、咀嚼性和弹性。
随冻藏时间的推移,水分含量变化不显著(P>0.05),肌原纤维蛋白、巯基、Ca2+-ATPase酶的显著下降(P<0.05),羰基、表面疏水性显著上升(P<0.05),肌原纤维蛋白内源荧光强度下降。与对照组相比,UHP预处理后蛋白氧化变性更严重,贮藏过程超高压预处理会加速蛋白质氧化速度。可能是由于本实验采用的UHP条件所导致。此外,UHP预处理对虾的色泽和质构等感官特性有适度的改善效果。
综上所述,本研究为UHP与热烫技术在水产品加工中的应用以及工业化生产克氏原螯虾冻藏产品提供参考。
