半纤维素基阿维菌素载药微囊的制备及性能
2020-08-17张林雅薛伟顾丽敏
张林雅,薛伟,顾丽敏
(河北科技大学化学与制药工程学院,河北石家庄050018)
在人类赖以生存的大自然中,植物木质纤维素是自然界中极为丰富的植物资源,植物木质纤维素主要由3 种成分组成,即木质素、纤维素和半纤维素。其中的半纤维素为无定形物质,聚合度低、吸水易润胀,组成半纤维素的结构单元主要有D-木糖基、D-甘露糖基、D-葡萄糖基、D-半乳糖基和D-阿拉伯糖基等[1-3]。半纤维素的聚合度一般为150~200,糖单元中除了葡萄糖分子,还可能有木糖、半乳糖、甘露糖、阿拉伯糖、葡萄糖醛酸和半乳糖醛酸等多种混杂形式存在[4]。这种多类型支链和不定形结构以及不同类型的多官能团,如醛基、羟基、羰基、甲氧基、醚键等,赋予了不同半纤维素复杂的化学结构和性质,同时拓展了不同半纤维素的应用空间[5]。半纤维素作为一种富饶的天然可降解植物资源,近年来,有关其改性及功能化的应用研究不断深入及拓展,成为可再生资源在绿色化工方面的一个重要方向[6-8]。
载药微囊是选择一定的基体为壁材,使药物在体系内维持一定的浓度,并且达到有效释放[9]。载药微囊具有保护药物、减少用药次数、延长持效期、提高药物利用率、减少环境污染等优点,在医药行业中已有非常广泛的应用[10-13]。载药微囊的制备方法包括界面聚合法[14]、原位聚合法[15-16]和凝聚法等[17-18]。其中原位聚合法较为简单易行,具有载药量高、成球性好、成本低、粒径和壁厚可控等优点。王镭等[19]以原位聚合法制备了脲醛树脂毒死蜱微囊,壳芯比为0.94,反应温度为40℃,制得的微囊载药量可达67.66%。彭涛[20]采用原位聚合法制备脲醛树脂环氧树脂微囊,芯壁比为1.2∶1,pH 为3.0,反应温度为70℃,载药量为62%,粒径分布较均匀,平均粒径约160μm。
阿维菌素是一种高毒性的十六元大环内酯类化合物,在国内外广泛应用于寄生虫、线虫和体外寄生虫的治疗,具有广谱高效、持效期长、安全性好等特点[21]。其缺点是光解性强、容易失效,而目前市面上广泛采用是阿维菌素乳油剂型,内含大量有机溶剂,对环境污染造成了极大影响[22]。将半纤维素作为微囊原料,制备半纤维素基阿维菌素载药微囊,可赋予载药微囊优异的降解性和生物相容性,达到环境友好和高效持久的目的,在药物载体和绿色化工领域具有非常重要的应用研究价值。
本研究以黏胶生产废液中提取的半纤维素、甲醛和尿素为原料,通过原位聚合法制备出半纤维素基阿维菌素载药微囊(HDCM),包覆过程如图1所示。探讨制备条件对HDCM 载药量的影响,利用电子显微镜、红外光谱、激光粒度分析仪分析表征HDCM 的分子结构和微观形貌,考察HDCM 的热降解和储存稳定性能,并研究其释放动力学,确定释放性能。
1 实验部分
1.1 主要试剂
半纤维素(HC,木糖75%~83%,甘露糖10%~12%,葡萄糖6%~11%,半乳糖0.9%~1.4%,葡萄糖酸醛<0.8%),工业品,唐山三友集团;无水氯化锂(LiCl)、N,N-二甲基甲酰胺(DMF)、聚乙烯醇(PVA)、间二苯酚、尿素、甲醛、乙腈、丙酮、甲醇、辛基苯酚聚氧乙烯醚(OP-10),化学纯,石家庄市现代试剂公司;阿维菌素原药,工业品,石家庄威远生物化工有限公司。
1.2 载药微囊的制备
1.2.1 阿维菌素乳液的制备
称取1g 阿维菌素原药加入到50mL 蒸馏水中,滴加0.06g 乳化剂OP-10,搅拌均匀,利用高速分散机乳化10min,得到阿维菌素乳液。
1.2.2 半纤维素载药微囊预聚体的制备
将1.0g LiCl 溶解于30mL DMF 中,加入1.0g HC 升高温度至85℃,抽真空使HC 完全溶解,然后分别加入25.0g 甲醛和8.0g 尿素,搅拌30min,随后加入0.5g PVA 和间二苯酚,待完全溶解后降至40℃,调节pH至9,反应1h制得预聚体。其中,PVA 与间二苯酚作为系统稳定剂防止微囊粘连聚沉在一起[23]。
1.2.3 载药微囊HDCM的制备
HDCM的制备如图2所示,将阿维菌素乳液与预聚体搅拌30min,混合均匀,体系温度升至65℃并调节pH 至3.5,反应3h 结束,体系降至室温,经离心、洗涤、烘干得微囊HDCM。

图2 载药微囊HDCM的制备
1.3 测试及表征
1.3.1 阿维菌素标准曲线建立
称取0.01g 阿维菌素原药溶于100mL 甲醇中,加入1000mL 蒸馏水稀释,超声分散10min,制备出100mg/L阿维菌素溶液,按照同样的方法分别制备1mg/L、5mg/L、10mg/L 和50mg/L 的阿维菌素溶液。以甲醇溶液作空白参照,利用紫外分光光度计对阿维菌素溶液在200~800nm 范围内进行全波段扫描,分别记录不同浓度的阿维菌素溶液在245nm处出现的吸光度数值[24]。阿维菌素的标准曲线和拟合方程如图3所示。

图3 阿维菌素的标准曲线
1.3.2 载药量测定
用电子天平精确称取m1=0.1g 的微囊,在研钵中充分磨碎,将磨碎的微囊加入到50mL 丙酮中浸泡并持续搅拌,使微囊的囊壁充分溶解,每隔24h过滤掉已溶解的囊壁并用丙酮多次洗涤,再倒入50mL 丙酮继续浸泡,重复上述操作两次,将3 次过滤得到的滤液进行干燥称重得m2,计算载药量X按式(1)计算[24]。

1.3.3 表征与形貌
利用溴化钾进行压片,采用Thermo Nicolet Nexus 670 红外光谱仪对HDCM 样品在频率区间500~4000cm-1的范围内进行扫描,得到HDCM的红外光谱图。称取0.1g HDCM 样品,将其分散于50mL 蒸馏水中,搅拌10min,得到HDCM 的分散液,吸取0.5mL分散液于表面皿上,利用100CX-2电子显微镜观察载药微囊的形貌。
1.3.4 粒径
将0.1g HDCM样品加入到50mL蒸馏水中,搅拌10min,得到均匀分散的HDCM溶液。设置激光粒度仪的折射率为1.33,超声时间60s,分散介质为水。样品池中滴加少量的HDCM分散液,采用WJL-602激光粒度分析仪测定其粒径以及粒度分布。
1.3.5 热失重(TGA)和恒温热稳定性
准确称取0.005g 载药微囊,采用STA 449C(NETZSCH)同步热分析仪测定热失重曲线,设置温度范围为0~300℃,升温速率为10℃/min。将0.05g样品置于55℃下测定恒温热稳定性,追踪测定样品质量的变化,时间间隔为2h,测量时间为10h。
1.3.6 储藏稳定性和释放动力学
称取0.1g HDCM 样品,分别以30mL 水、乙腈和乙腈水溶液为介质,常温搅拌均匀,采用TU-1810 紫外分光光度计测定样品在245nm 处的吸光度。释放动力学选取时间间隔为12h,测定介质中阿维菌素浓度的变化,计算累积释放量。储藏稳定性选取每隔7天测定水中阿维菌素浓度的变化,计算累积释放量。累积释放量的计算按式(2)进行[25]。

式中,Mt为t时间内阿维菌素的累积释放量,mg;Ct为t时刻测定的阿维菌素在释放介质中的浓度,mg/L;v为每次取出的释放介质体积,mL;V为释放介质的总体积,mL。
采用不同的释放模型方程拟合,释放模型方程如式(3)~式(6)所示[26-27]。
式中,Mt为t时刻的释放量;M∞为最终的恒定释 放 量, mg;k0、kH、km分 别 为Zero-order、Higuchi 和Makoid-Banakar 的 模 型系 数,mg/h;k1为First-order模型系数,h-1;n为扩散指数。
2 结果与讨论
2.1 载药微囊HDCM的最佳制备条件
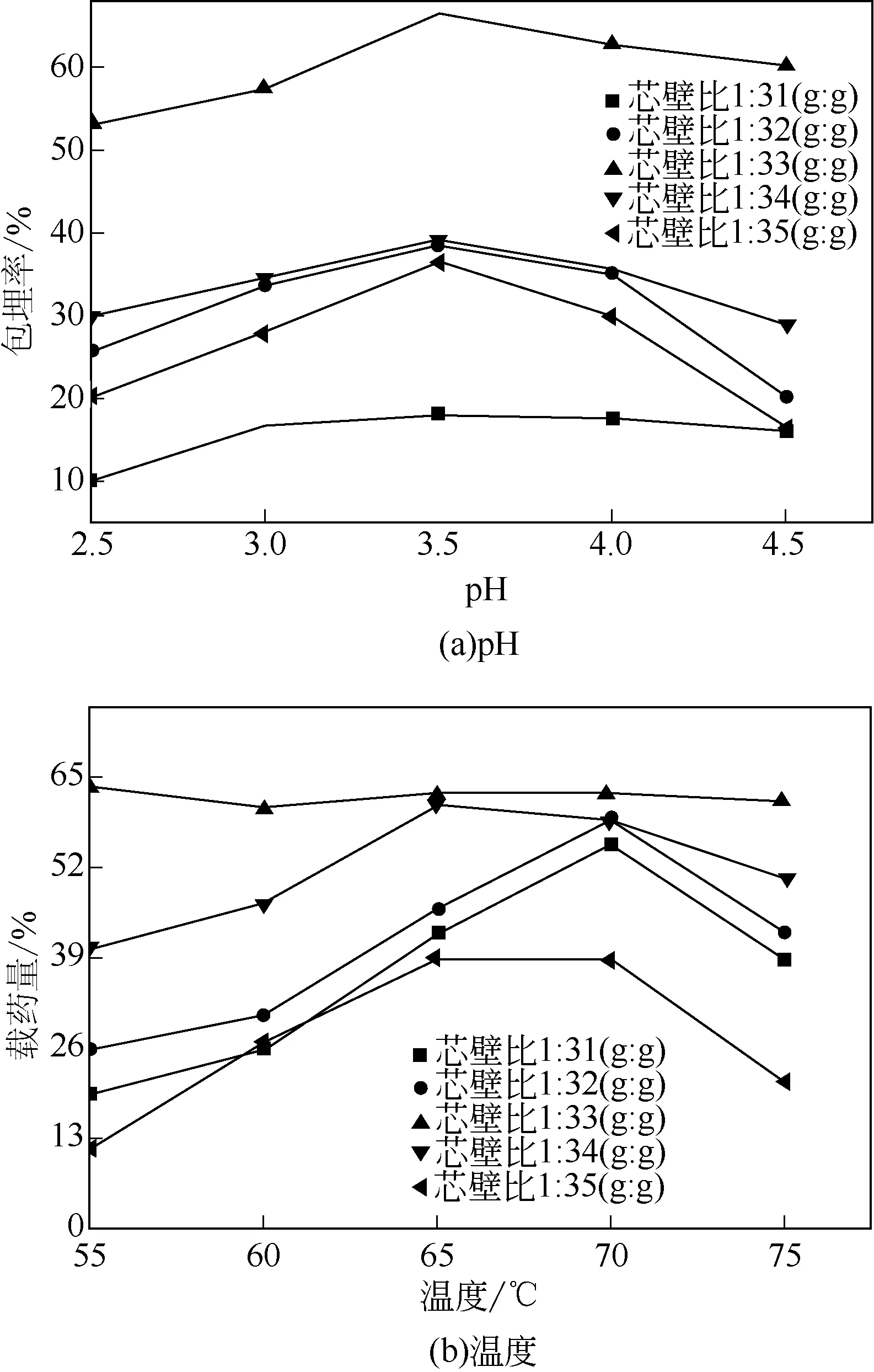
图4 制备条件对HDCM载药量的影响
芯壁质量比、pH 和温度对于载药微囊的载药量及粒径分布的影响如图4和图5所示,对粒径大小的影响如图6所示。当芯壁质量比较小时,不利于壁材完整包覆阿维菌素,HDCM 的载药量较低。随着壁材质量比例增大,载药量提高,同时HDCM的粒径逐渐变大。当芯壁质量比为1∶34时,微囊的载药量最大,粒径最小为38.2μm。但壁材含量过多时,容易造成壁材的彼此粘连,进而导致HDCM载药量的下降和粒径增大。酸性条件下有利于HDCM 的制备,当pH 较低时,预聚体发生聚合反应的速率较慢,载药量和粒径较小,而pH 较高时,易造成HDCM乳液的破乳絮凝,引起载药量下降。当pH=4 时,粒径最小为46.9μm。HDCM 载药量直接受制备温度的影响,当制备温度较低时,壁材预聚体的合成属于亲电取代反应,温度低导致电子云密度降低,不利于预聚体的形成,壁材聚合速度慢,载药量较小。而温度的上升可加快壁材聚合速度,提高载药量,但过高温度易引起HDCM乳液的破乳,同时诸多副反应发生造成壁材的相互团聚,引起载药量下降和粒径增加[28-29]。当反应温度为65℃时,微囊的载药量最大,粒径最小为38.8μm。探讨制备HDCM的适宜条件为芯壁质量比1∶34、pH=3.5、温度65℃左右,在此条件下HDCM的粒径较小,载药量可达到66.5%。
2.2 载药微囊HDCM的FTIR 表征
阿维菌素原药和HDCM 的红外谱图如图7 所示,阿维菌素表现出的特征峰包括3345cm-1处的—OH 吸收峰、1739cm-1处的—C==O 吸收峰、2953cm-1和1350cm-1处的—CH3和—CH 吸收峰、729cm-1和582cm-1处 的 苯 环 吸 收 峰、1152cm-1处的—C—O—C 吸 收 峰,而HDCM 在3318cm-1、1658cm-1和1553cm-1处出现新的特征吸收峰,归属于—NH—C==O 键,并且1152cm-1处—C—O—C 的吸收峰更加明显,表明完成了载药微囊的包覆过程。图6(b)中不同载药量载药微囊的红外谱图曲线高度重合,并且随载药量的增大,—NH—C==O 以及—C—O—C的特征吸收峰呈愈加明显的趋势。

图5 不同制备条件下HDCM的粒径分布

图6 不同的影响因素对HDCM粒径的影响

图7 阿维菌素、HDCM和不同载药量HDCM的FTIR谱图
2.3 载药微囊HDCM的形貌
载药量分别为19.4%和66.5%微囊的SEM图如图8所示。由图可知,低载药量微囊的包覆情况不理想,只有极少部分载药微囊出现,存在大量没有包覆的壁材或者包覆不完整的现象,粒径不均一并且出现微囊相互交联的状况。而高载药量的载药微囊分布均匀,分散性较好,包覆效果好且没有出现交联破囊的现象。
2.4 载药微囊HDCM的热分解性
阿维菌素原药和载药微囊HDCM 的热分解曲线如图9所示。从图中可以看出,阿维菌素原药的热分解主要分为3 个阶段:第一阶段在30~100℃,主要为溶剂挥发,质量损失在5%~10%;第二阶段在100~230℃,是阿维菌素末端羟基以及醚键的裂解阶段,损失质量为总质量的25%左右;第三阶段在230~300℃,是阿维菌素骨架断裂以及微囊炭化的阶段,损失质量为总质量的30%左右,该阶段的最大分解温度为261℃。HDCM 的热分解温度比阿维菌素原药有所提高,其最大分解温度为272℃,其主要原因是微囊囊壁形成积炭沉积在阿维菌素的表面,形成了一层隔绝氧气和传热的保护层,延缓了阿维菌素的进一步分解,宏观上表现为HDCM的热稳定性提高[30-31]。
2.5 载药微囊HDCM的恒温热稳定性
阿维菌素原药和HDCM 的恒温热稳定性对比如图10 所示,包覆后HDCM 的热稳定性明显优于阿维菌素,HDCM的热降解量要少于阿维菌素。阿维菌素原药的降解率在10h 后达到了12.1%,而载药量为66.5%的HDCM 降解率仅为5.2%。不同载药量的载药微囊在相同的温度下保持着类似的热稳定性,并且与之前的热降解性分析结果相符合。载药量的高低影响着降解量,载药量越高相对应的热降解量就越低。高载药量HDCM 的囊壁更加均匀,表现为其热降解量较小一些,恒温热稳定性有所提高,保护效果明显。
2.6 载药微囊HDCM的储存稳定性
不同温度下载药微囊HDCM 的储存稳定性对比如图11 所示,囊外浓度随储存时间及储存温度的增加呈缓慢增长趋势。HDCM交联网状的囊壁具有一定的韧性和强度,其药物释放性随着时间延长和温度升高逐渐表现出来。HDCM 在低温(0℃)的条件下28 天内没有明显变化,其囊外浓度仅从4.85mg/L增加到16.98mg/L,增长量仅为12.13mg/L,增长幅度较小。而在较高温度或较长时间之后,释放速度可迅速提高,温度为50℃时,其囊外浓度从10mg/L增长到32.5mg/L,增长明显,说明温度可以影响HDCM的药物可控性。
2.7 载药微囊HDCM的释放动力学
载药微囊HDCM 的释放动力学研究有助于深入了解HDCM的可控释放性。阿维菌素、HDCM在不同溶剂中的释放曲线图如图12 所示,其相关释放模型的动力学参数列于表1~表3 中。阿维菌素、HDCM在水中的累积释放率都呈现先快速增大然后缓慢增加的趋势。阿维菌素的累积释放率在12h之内即达到了83.8%,而HDCM 的累积释放率在24h之后才逐渐增大,12h 时其释放率仅为33.7%,表明HDCM 具有极好的缓释性能。表1 中,阿维菌素、HDCM在水中Makoid-Banakar模型的拟合参数R2分别为0.799 和0.723,较之其他模型更接近1,表明其释放过程更好地满足了Makoid-Banakar 模型机理。同理,表2 和表3 中,阿维菌素、HDCM在乙腈和乙腈水溶液中的Makoid-Banakar 模型拟合参数R2均达到0.9 以上,满足Makoid-Banakar 模型释放机理。
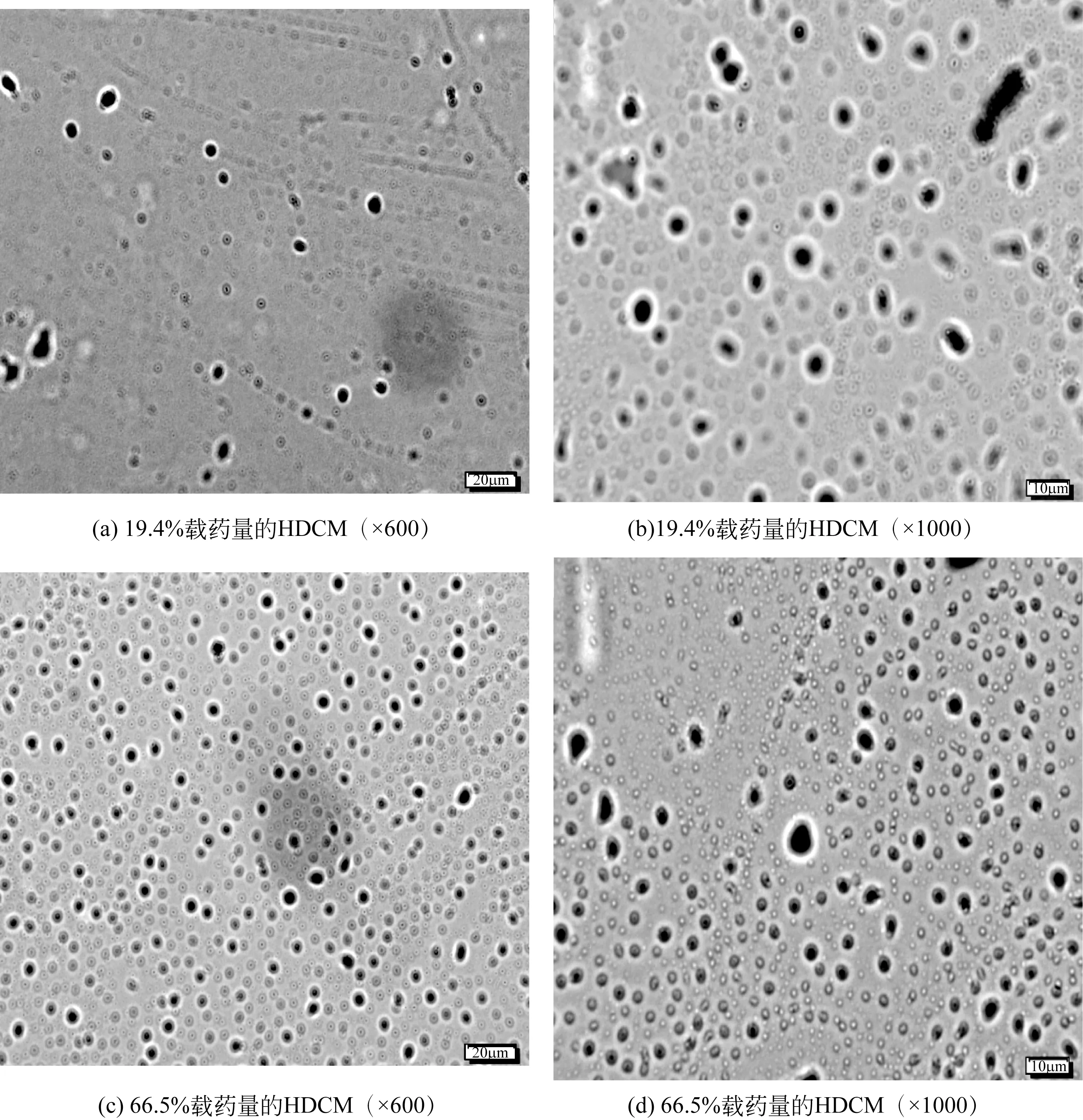
图8 不同载药量的HDCM的SEM图

图9 阿维菌素和HDCM的TGA/DTG曲线图

图10 不同载药量载药微囊HDCM的恒温热失重
在Makoid-Banakar 模型的释放机理中,当扩散指数n<0.45 时,药物的释放机制为Fick 扩散;当0.45<n<0.89 时,药物的释放机制为non-Fick;当n>0.89 时,药物的释放机制属于骨架溶蚀。表1~表3中的数据表明,阿维菌素和HDCM在水、乙腈和乙腈水溶液中,Makoid-Banakar模型的扩散指数均满足n<0.45,其释放机理属于Fick扩散。阿维菌素从HDCM 中释放出来的速率主要受扩散速率的影响,随着外界温度、酸碱性、水流运动等环境因素的变化,HDCM的稳定性随之改变,进而引起水分进入HDCM 内部,阿维菌素从HDCM 内部释放出来[32-33]。
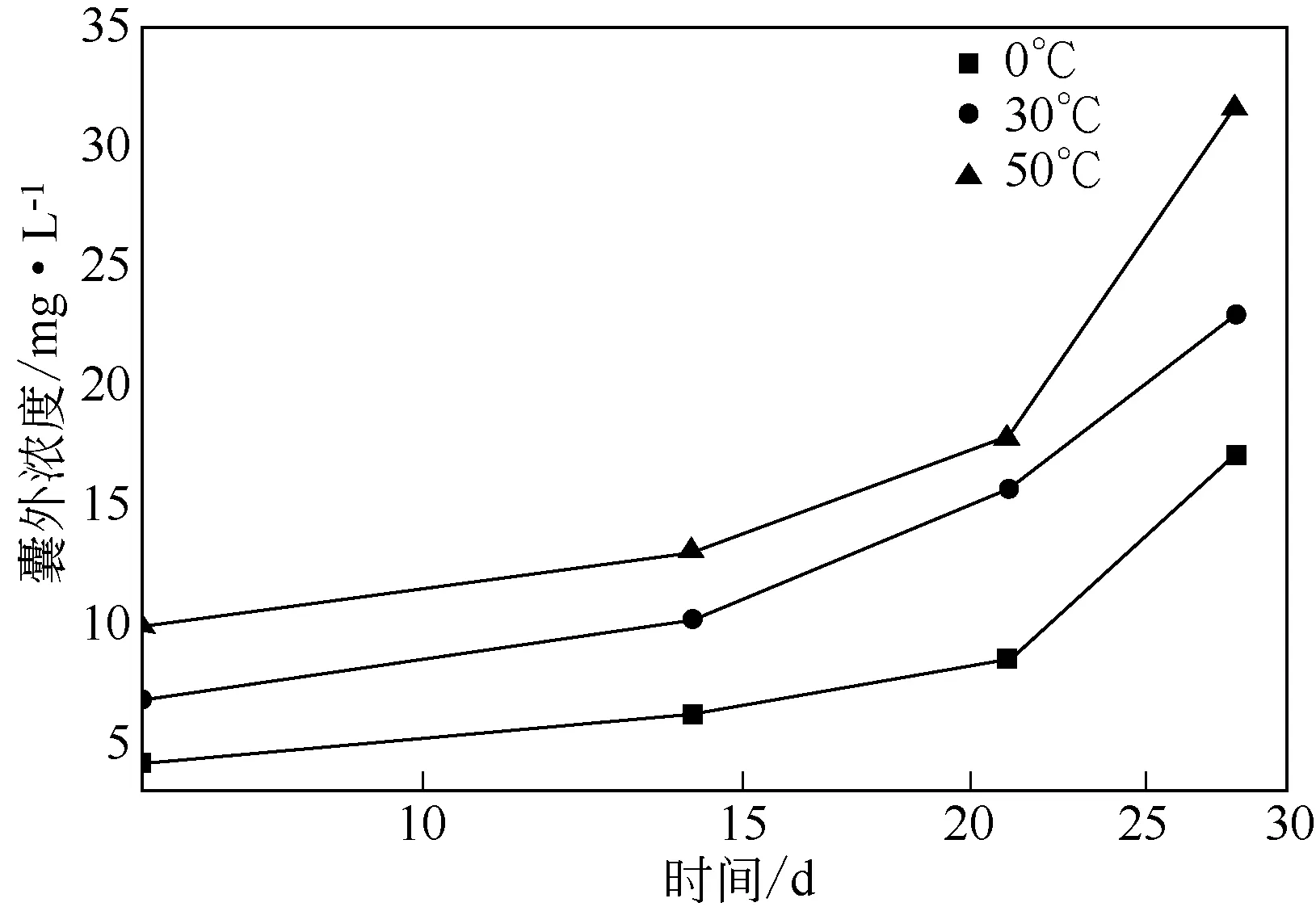
图11 不同温度下载药微囊HDCM的储存稳定性
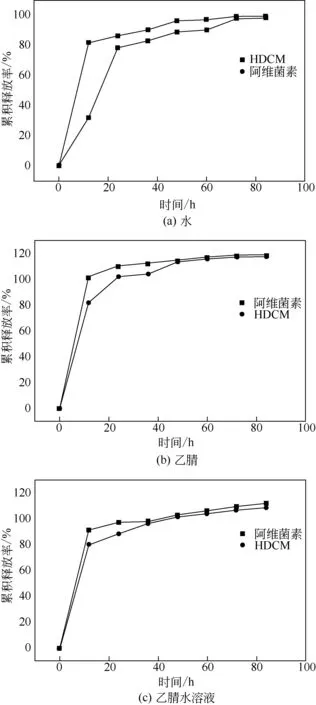
图12 阿维菌素、HDCM在不同溶剂中的释放曲线

表1 阿维菌素、HDCM在水中的释放模型拟合

表2 阿维菌素、HDCM在乙腈中的释放模型拟合
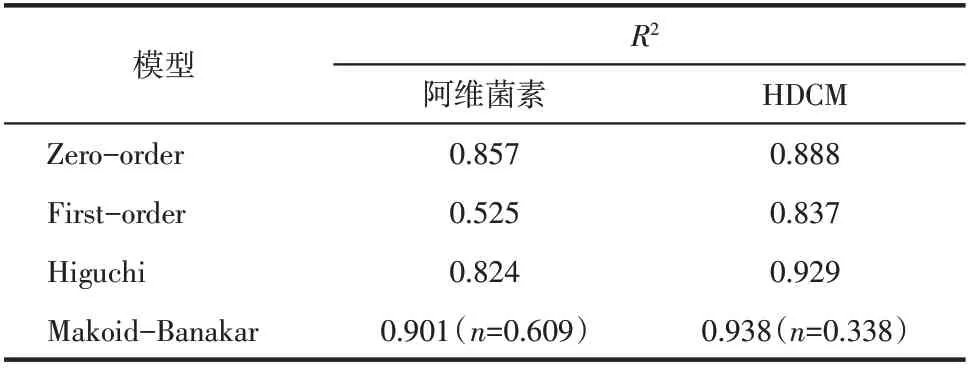
表3 阿维菌素、HDCM在乙腈水溶液中的释放模型拟合
3 结论
以半纤维素为基体,利用原位聚合法制备了阿维菌素载药微囊HDCM,通过制备条件、热降解性、储存稳定性和释放动力学研究,确定了HDCM的载药量、热分解性及释放性能,得到以下结论。
(1)HDCM的载药量和粒径受芯壁比、温度和pH等影响较大,较低或较高的芯壁比、温度和pH会造成HDCM 相互粘连从而影响载药量以及粒径。控制芯壁比、温度和pH 等影响因素在合适的范围内,可制备出载药量较高、粒径较小且均一稳定的HDCM。
(2)HDCM的热降解性能和储存稳定性能较阿维菌素原药有所提高,表明HDCM 的囊壁起到提高热稳定性以及对外界环境的隔离作用。
(3)阿维菌素原药在水中的累积释放率在12h之内达到83.8%,而HDCM 的累积释放率在24h 后才有所增大,12h 时其释放率仅为33.7%,表明HDCM具有极好的缓释性能,可将其应用于医疗药物载体开发。
