急性胰腺炎并发胰腺假性囊肿危险因素分析
2020-08-17杨子云张海蓉何佳薇张景丽李若畅
杨子云,张海蓉,何佳薇,张景丽,李若畅
急性胰腺炎(AP)是消化系统常见的疾病,该病发病急,病情危重,且近年来人们生活水平明显提高,生活饮食习惯发生了很大改变,较以往摄入的高蛋白高脂肪食物多,导致胰腺炎的发生率明显上升,研究报道,近年来我国AP住院发病率从0.28%上升至0.72%,增加了2.57倍[1]。因此AP,得到相关人士高度重视。AP根据其病情的严重程度以及病程可以进行分类,在2012版的亚特兰大国际共识中已经明确[2]。这一共识得到了全球同行之间的认可。随后在2014年以及2015年AP诊治的相关指南中均对上述意见进行延续,并对AP的局部并发症进行了重新定义,主要包括胰腺假性囊肿(PPC)、胰周液体积聚、急性包裹性坏死以及坏死性积聚[3-4]。
PPC是AP的常见并发症。随着胰腺炎的发生率明显升高,其继发的PPC发生率亦明显升高。根据国内外的文献报道,AP并发PPC的发病率为2.0%~18.5%[5-7],封光华[8]报道,AP继发PPC的发病率甚至可高达50%。而根据病因的不同,其发病率亦有不同,最高者为乙醇性(56%~78%),其后依次为胆源性(6%~36%)、特发性(6%~20%)、术后或创伤性(3%~8%),而高脂血症性胰腺炎并发PPC者则鲜有报道[9]。国外的一项回顾性分析亦显示,乙醇性引起的AP是PPC形成的最常见病因[6]。目前AP并发PPC的危险因素在国内外尚无统一定论。DICULESCU等[10]回顾性研究中,提出以乙醇性为病因的AP是PPC形成的危险因素,同时低碱性磷酸酶(ALP)可作为AP并发PPC的预测因素。CUI等[7]的一项多中心前瞻性研究则表明,高乳酸脱氢酶血症是PPC形成的独立危险因素。而我国高道键等[11]研究则发现,低蛋白血症及CT严重指数(MCTSI)是PPC形成的独立危险因素。其他因素亦有研究,如腹部包块、低钙血症等亦是PPC形成的危险因素[12-13]。PPC一旦发生,容易继发感染、出血、消化道瘘以及腹腔积液等并发症,进一步加重患者病情,增加患者痛苦,甚至增加患者死亡率。因此,早期预测PPC的形成,对于制定个体化治疗方案,早发现,早治疗,积极改善患者预后具有重要意义。
1 资料与方法
1.1 临床资料 选取2016—2018年昆明医科大学第一附属医院消化内科接受治疗的AP患者571例为研究对象。纳入标准:(1)参考AP诊断标准[3]明确诊断;(2)病历资料完整可进行AP常用临床评分计算[14-15]。排除标准:(1)因胰腺创伤、手术等因素诱发的AP,以及慢性胰腺炎急性发作;(2)发病时间>48 h后入院;(3)妊娠期及哺乳期妇女;(4)放弃治疗者;(5)病历资料不完整。
本文价值:
随着目前我国生活水平的提高,急性胰腺炎(AP)等胰腺疾病的发病率逐年上升,胰腺假性囊肿(PPC)作为AP常见的局部并发症,其发病率亦较以往升高。PPC可能会并发感染、出血、消化道瘘以及腹腔积液等症状,进一步加重患者病情,甚至可能威胁患者生命。本研究通过回顾性研究,发现BMI、饮酒史、既往胰腺炎病史、糖尿病病史、D-二聚体是AP并发PPC的独立危险因素,其中BMI、饮酒史、糖尿病病史与相关文献报道相一致。但既往胰腺炎病史、D-二聚体目前尚未见相关文献报道,且发病机制尚不明确,可行进一步研究。同时,对于具有上述危险因素的AP患者,应密切随访,警惕PPC的形成,早诊断,早治疗。
1.2 诊断标准及严重程度分级 AP的诊断标准参考《急性胰腺炎诊治指南(2014)》[3]。符合以下三项特征中的两项,即可诊断为AP:(1)患者具有典型的上腹部疼痛症状;(2)查血液淀粉酶明显升高,高至参考范围上限3倍以上;(3)行上腹部CT/磁共振成像(MRI)或腹部超声检查,提示影像学呈现AP样改变。AP严重程度分级:轻度AP(MAP),指AP患者未发生相关并发症,不存在其他器官功能衰竭;中度AP(MSAP),指伴有短时间一过性的器官功能障碍;重度AP(SAP),指患者合并长时间的器官功能衰竭,一般超过48 h[3]。
PPC的诊断主要依靠患者病史、临床表现、血及尿淀粉酶及影像学检查,明确囊肿的部位、大小、厚度及胰管形态改变等[16]。
1.3 观察指标
1.3.1 一般资料 收集患者的一般资料,主要包括性别、年龄(根据2013年世界卫生组织最新年龄分段[17],年龄以45岁为分界线,<45岁为青年,≥45岁为中老年)、严重程度分级、病因(饮食因素、乙醇性、胆源性、高脂血症性、药物性、自身免疫性、原因不明者)、体质指数(BMI)(根据中国肥胖问题工作组数据汇总分析协作组[18]的建议,BMI以28 kg/m2为标准,分为BMI<28 kg/m2及BMI≥28 kg/m2)、吸烟史(个人史中有吸烟史,不论是否戒烟)、饮酒史(个人史中有饮酒史,不论是否戒酒)、既往胰腺炎病史、有无糖尿病病史等。
1.3.2 实验室检查指标 整理患者入院后相关实验室检查指标,包括白细胞计数(WBC)、中性粒细胞分数(NEU)、总胆红素(TBil)、直接胆红素(DBil)、清蛋白(ALB)、总胆固醇(TC)、三酰甘油(TG)、尿素氮(BUN)、血肌酐(Scr)、血糖、血钙、纤维蛋白原(FIB)、C反应蛋白(CRP)、淀粉酶(AMY)、脂肪酶(LIP)、D-二聚体。
1.3.3 急性生理学及慢性健康状况评分系统Ⅱ(APACHEⅡ)[3]收集患者入院48 h内APACHEⅡ评分,包括急性生理学评分、年龄评分及慢性健康状况评分3部分,理论分值最高为71分,分值越高,病情越重。
1.3.4 Ranson评分[15]包括入院时的5项临床指标和入院后48 h的6项指标。入院时的5项指标为:年龄>55岁、WBC>16×109/L、血糖>11.1 mmol/L、乳酸脱氢酶(LDH)>350 U/L、天冬氨酸氨基转移酶(AST)>250 U/L;入院后48 h的6项指标为:血钙<2.0 mmol/L、血氧分压(PaO2)<8 kPa(60 mm Hg)、碱剩余(BE)>4 mmol/L、BUN增加>1.79 mmol/L、血细胞比容(HCT)减少10%以上、体液丧失>6 L。以上各项1分,共计11分,Ranson评分≥3分考虑为MSAP或SAP。
1.3.5 MCTSI评分[3]包括胰腺炎症反应评分、胰腺坏死评分和胰外并发症,胰腺炎症反应评分分为,正常胰腺计0分,胰腺和/或胰周炎性改变计2分,单发或多个积液区或胰周脂肪坏死计4分;胰腺坏死评分分为,无胰腺坏死计0分,坏死范围≤30%计2分,坏死范围>30%计4分;胰外并发症,包括胸腔积液、腹腔积液、血管或胃肠道受累等计2分。MCTSI评分满分10分,≥4分考虑为MSAP或SAP。
1.3.6 急性胰腺炎严重程度床边指数(BISAP)评分[15]入 院 24 h内 血 BUN>25 mg/dl( 即 8.93 mmol/L)、意识状态Glasgow评分<15分、全身炎症反应综合征(SIRS)、年龄>60岁、有胸膜渗出等5项,有则各计1分,无计0分。BISAP评分满分5分,≥3分考虑为MSAP或SAP。
1.3.7 并发症 入院48 h后影像学检查证实是否存在腹腔积液、胸腔积液等。
1.3.8 住院天数、住院费用 住院费用包括护理费、床位费、检查费、治疗费、材料费、注射费、药物费等。
1.4 分组 AP患者根据是否并发PPC,分为病例组78例和对照组493例。
1.5 统计学方法 采用SPSS 24.0统计学软件进行数据处理。计量资料符合正态分布以(±s)表示,两组间比较采用独立样本t检验;计数资料组间比较采用χ2检验;AP并发PPC的影响因素采用多因素Logistic回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 纳入的571例AP患者中,男396例(69.4%),女175例(30.6%);年龄14~79岁,平均年龄(44.6±13.4)岁,青年287例(50.3%),中老年284例(49.7%);MAP 255例(44.7%)、MSAP 92例(16.1%)、SAP 224例(39.2%);病因:饮食因素238例(41.7%),乙醇性84例(14.7%),胆源性6例(1.1%),高脂血症性2例(0.4%),药物性2例(0.4%),自身免疫性2例(0.4%),原因不明171例(29.9%),两种及以上因素66例(11.5%)。AP并发PPC 78例(13.7%),其中单发性PPC 64例(82.1%),多发性PPC 14例(17.9%);单发PPC位于胰头部17例(26.6%),胰颈部2例(3.1%),胰体部16例(25.0%),胰体尾部10例(15.6%),胰尾部19例(29.7%)。
2.2 两组患者临床资料比较 两组患者性别、WBC、NEU、TBil、DBil、TC、TG、BUN、Scr、血糖、血钙、FIB、CRP、AMY、住院天数、住院费用比较,差异均无统计学意义(P>0.05);两组患者年龄、严重程度分级、病因、BMI、吸烟史、饮酒史、既往胰腺炎病史、糖尿病病史、ALB、LIP、D-二聚体、APACHEⅡ评分、Ranson评分、MCTSI评分、BISAP评分、腹腔积液、胸腔积液发生率比较,差异均有统计学意义(P<0.05,见表 1~3)。
2.3 AP并发PPC影响因素的多因素Logistic回归分析以AP是否并发PPC为因变量(赋值:否=0,是=1),以单因素分析差异有统计学意义的变量年龄(赋值:青年=1,中老年=2)、严重程度分级(赋值:MAP=1,MSAP=2,SAP=3)、病因(赋值:饮食因素=1,乙醇性=2,胆源性=3,高脂血症性=4,药物性=5,自身免疫性=6,原因不明=7,两种及以上因素=8)、BMI(赋值:<28 kg/m2=1,≥28 kg/m2=2)、吸烟史(赋值:否=0,是=1)、饮酒史(赋值:否=0,是=1)、既往胰腺炎病史(赋值:否=0,是=1)、糖尿病病史(赋值:否=0,是=1)、ALB(赋值:连续变量)、LIP(赋值:连续变量)、D-二聚体(赋值:连续变量)、APACHEⅡ评分(赋值:连续变量)、Ranson评分(赋值:连续变量)、MCTSI评分(赋值:连续变量)、BISAP评分(赋值:连续变量)、腹腔积液(赋值:否=0,是=1)、胸腔积液(赋值:否=0,是=1)为自变量,纳入多因素Logistic回归分析,结果显示,BMI、饮酒史、既往有胰腺炎病史、糖尿病病史、LIP、D-二聚体是AP并发PPC的独立影响因素(P<0.05,见表4)。

表1 两组患者一般资料比较Table 1 Comparison of general data between control group and case group
表2 两组患者实验室检查指标比较(±s)Table 2 Comparison of laboratory examination indices between control group and case group

表2 两组患者实验室检查指标比较(±s)Table 2 Comparison of laboratory examination indices between control group and case group
注:WBC=白细胞计数,NEU=中性粒细胞分数,TBiL=总胆红素,DBiL=直接胆红素,ALB=清蛋白,TC=总胆固醇,TG=三酰甘油,BUN=尿素氮,Scr=血肌酐,FIB=纤维蛋白原,CRP=C反应蛋白,AMY=淀粉酶,LIP=脂肪酶
BUN(mmol/L)对照组 493 21±7 0.82±0.03 22.1±1.4 9.9±1.2 37.2±0.4 5.8±1.3 5.8±2.9 5.13±0.14病例组 78 12±1 0.78±0.02 18.1±1.9 8.5±1.3 35.0±1.2 4.0±0.2 2.0±0.2 5.49±0.56 t值 0.835 1.135 1.860 0.752 2.792 0.901 0.857 -1.015 P值 0.404 0.257 0.063 0.453 0.006 0.368 0.392 0.313组别 例数 WBC(×109/L)NEUTBiL(μmmol/L)DBiL(μmol/L)ALB(g/L)TC(mmol/L)TG(mmol/L)D-二聚体(mg/L)对照组 86±5 8.4±0.3 2.23±0.09 5.4±0.4 93±7 638±79 3 774±411 1.81±0.16病例组 81±5 8.3±0.8 2.08±0.05 5.1±0.3 98±16 516±119 2 249±477 4.39±0.55 t值 0.662 0.190 1.055 0.571 -0.468 0.977 2.388 -7.461 P值 0.508 0.849 0.292 0.568 0.640 0.329 0.017 <0.001组别 Scr(μmol/L)血糖(mmol/L)血钙(mmol/L)FIB(g/L)CRP(mg/L)AMY(U/L)LIP(U/L)

表3 两组患者各评分、住院时间及住院费用比较Table 3 Comparison of mean APACHE Ⅱ score,Ranson score,CTSI,BISAP score,length of stay and cost of hospitalization between the control group and the case group
3 讨论
AP以胰腺局部炎性反应为主要特点,可同时伴或不伴其他器官功能的改变,是临床上消化内科常见的一种急危重症。AP在病情进展过程中,会合并一些并发症,其中PPC是较为常见的一种,发病率较高。本研究中PPC发病率为13.7%,与国内外相关文献的报道相一致[5-7]。
3.1 乙醇性病因及饮酒史 乙醇性所致AP是西方国家最常见的病因,随着我国经济的发展,目前乙醇性AP的发病率已在逐年上升,甚至在内地成为首要病因[19-20]。国外的部分相关文献报道中,乙醇是AP并发PPC的独立危险因素[6]。亦有部分国内外研究表明,乙醇性AP与PPC的发生无相关性[13,21]。本研究中,病例组乙醇性AP所占比例〔33.3%(26/78)〕高于对照组〔11.8%(58/493)〕。单因素分析提示病因是AP并发PPC的相关因素,但经过多因素Logistic回归分析后,提示病因并不是PPC形成的独立危险因素。同时,本研究统计了纳入患者的饮酒史,单因素分析提示病例组与对照组饮酒史比例有差异,多因素Logistic回归分析显示饮酒史是AP并发PPC的独立危险因素。其发病机制为乙醇直接及间接作用于胰腺管,如促进缩胆囊素分泌,造成胰液分泌增多,引起胰管压力上升,同时乙醇会促使胰酶在胰腺胰泡细胞中提前活化,造成弥漫性损伤,在AP发生时,瀑布式爆发的炎性反应进一步加重了胰管的损伤,导致破裂及胰液渗漏,形成急性液体积聚,可进一步形成PPC。本研究中,以男性患者为主,男性较女性饮酒较多,考虑该结果可能与此有关,但多因素Logistic回归分析显示,性别与PPC无相关性,因此,饮酒史是否为独立危险因素,仍需进一步研究分析,阐明其机制。
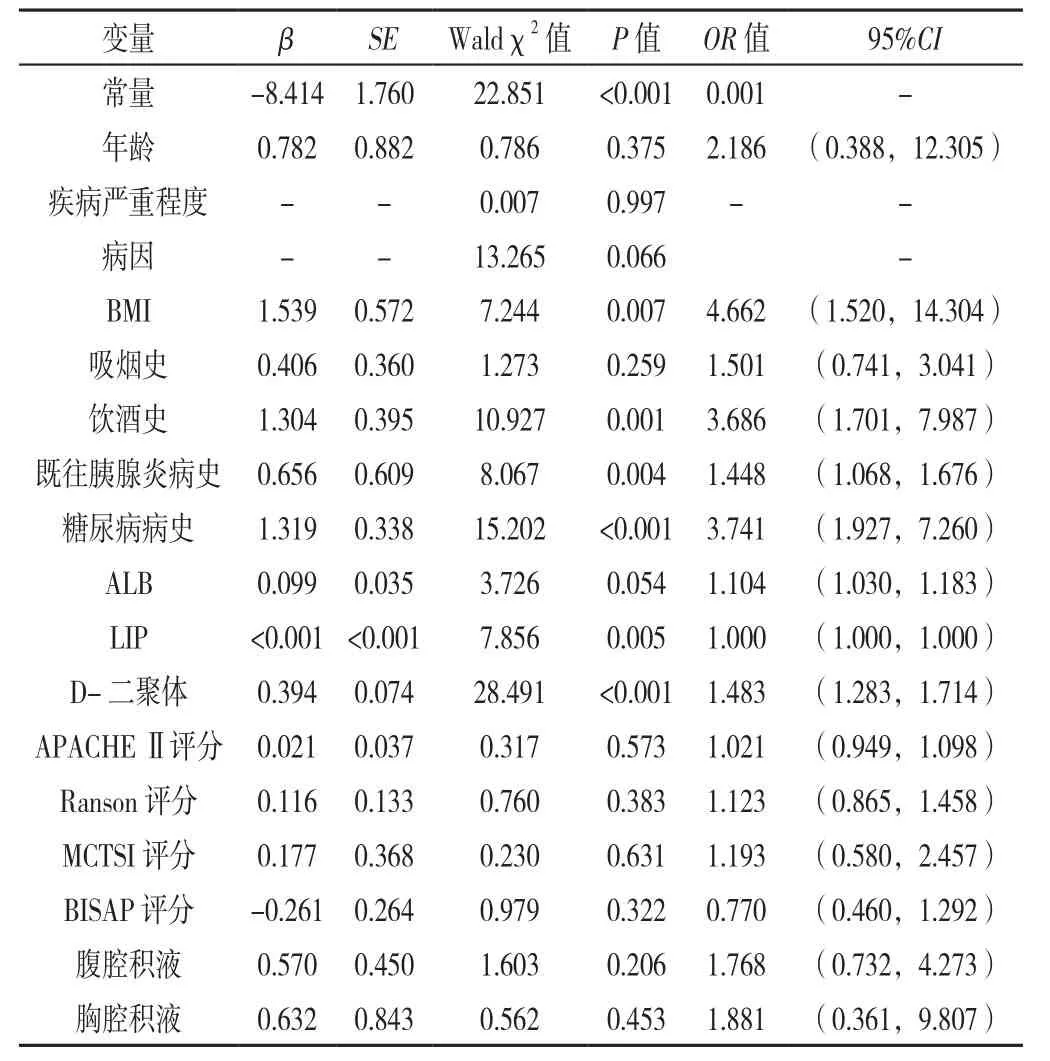
表4 AP并发PPC影响因素的多因素Logistic回归分析Table 4 Multivariate Logistic regression analysis of influencing factors of AP complicated with PPC
3.2 糖尿病病史 目前已有研究表明,糖尿病病史及血糖情况与AP的严重程度具有相关性[22-26],糖尿病患者若血糖控制不佳,可导致全身微血管出现粥样硬化,导致血管管腔变窄,组织器官微循环灌注不足。而胰岛素作为人体唯一降糖激素,由胰腺β细胞分泌。AP发生时,胰腺组织发生水肿、缺血甚至进一步坏死等,可导致胰岛素分泌不足及排出道受阻,进一步影响患者血糖水平[27];同时机体因SIRS出现糖异生增多,血糖进一步升高,反作用于胰腺组织,加重炎性反应,继而形成恶性循环,导致病情加重,出现并发症的风险亦随之升高。相关研究指出,患有糖尿病的AP患者有更高的并发症发生率[28]。本研究结果亦提示糖尿病病史是AP并发PPC的独立危险因素。
3.3 既往胰腺炎病史 本研究单因素分析显示,病例组与对照组既往胰腺炎病史所占比例有差异,多因素Logistic回归分析显示,既往胰腺炎病史是AP并发PPC的独立危险因素。蒋丽丽等[29]研究表明,复发性急性胰腺(RAP)会增加PPC的发病率,考虑为AP反复发生,破坏胰腺组织,改变胰腺正常解剖结构,增加积液积聚发生的可能性,从而导致PPC发病率的提高。但具体发病机制目前尚不明确,亦无相关文献报道,且复发次数与PPC等并发症的发病率是否存在相关性,仍需进一步研究。
3.4 BMI BMI是AP患者评估病情严重程度的重要指标[3,30-32],根据中国肥胖问题工作组数据汇总分析协作组的建议[18],BMI≥28 kg/m2为肥胖。多项研究表明,肥胖的AP患者更易发生PPC等局部并发症[22,33-34],其发病机制为:(1)肥胖患者具有更多的脂肪组织,在AP发生时,胰腺周围脂肪液化、坏死及发生皂化反应,进一步加重胰腺炎性反应;(2)脂肪组织分解释放游离脂肪酸,对胰腺腺泡细胞造成直接损伤,进而导致胰腺循环障碍;(3)上述反应发生时,脂肪组织的大量炎性因子得以释放,胰蛋白酶原进一步激活,造成胰腺周围组织继续液化、坏死,导致积液积聚,继而发展成为PPC。本研究结果提示,BMI是AP并发PPC的独立影响因素,且呈正相关,与相关文献报道[32-33]一致。
3.5 D-二聚体 已有研究证明,AP患者会发生凝血功能异常,早期表现为高凝状态。随着病程的进展,凝血因子大量消耗,继发纤溶系统激活。血液从高凝状态发展成为低凝状态,导致凝血功能指标出现异常[35]。D-二聚体是反映人体凝血及纤溶系统的重要指标及敏感指标之一。多项研究表明,D-二聚体在预测AP患者发生多器官功能衰竭(MODS)中具有重要价值[36-38]。同时其与MCTSI评分呈正相关[39]。AP患者的MCTSI评分越高,局部并发症如PPC的发生率随之上升,是AP患者局部并发症的较好预测方法,准确度高[40-41]。本研究提示,D-二聚体是AP并发PPC的独立危险因素,其发病机制目前尚不明确,可能与AP发病早期胰腺组织微循环障碍,凝血功能异常,微循环形成所致有关。尚需进一步研究,阐明机制。
本研究结果显示,病例组与对照组MCTSI评分有差异,但多因素Logistic回归分析显示,MCTSI评分并不是AP并发PPC的独立危险因素。与目前相关文献报道[41]存在差异,可能由于本研究中部分AP患者因临床资料不全而未入组导致的结果偏倚所致。
3.6 其他 本研究中,年龄、严重程度分级、病因、吸烟史、ALB、APACHEⅡ评分、Ranson评分、MCTSI评分、BISAP评分、腹腔积液、胸腔积液发生率等行单因素分析时,两组间有差异。但经多因素Logistic回归分析发现,均不是AP并发PPC的独立危险因素。
在AP的发病过程中,可能出现了如下过程[42]:(1)胰腺炎瀑布式炎性反应的激活,导致SIRS,毛细血管内皮细胞损伤,血管通透性增加,导致系统性毛细血管渗漏综合征,大量血管内液体外渗,第三间质液形成,有效血容量减少;(2)由于毛细血管损伤、微血栓形成,导致血管内大量液体外溢、血液浓度升高、内源性凝血系统活化;(3)毛细血管内皮细胞损伤,释放大量一氧化氮(NO)自由基,造成组织和细胞损伤;(4)继发感染,包括肺部感染、腹腔感染等;(5)血浆清蛋白丢失,可导致机体修复能力及抵抗力下降。国内外相关文献报道,浆膜腔积液及低蛋白血症是AP形成PPC的危险因素[43-44],然而本研究发现,浆膜腔积液(腹腔积液、胸腔积液)及低蛋白血症均不是AP并发PPC的独立危险因素,可能由于本研究病例组样本量限制及部分AP并发PPC患者因临床资料缺失而未入组所致。
本研究将年龄以45岁为分界线,分为青年(<45岁)和中老年(≥45岁),病例组中中老年比例更高,可能与我国目前已进入老龄化社会,饮食生活习惯改变且中老年人群中肥胖率更高有关,然而行多因素Logistic回归分析后,年龄并不是AP并发PPC的独立危险因素。
已有文献报道,吸烟是胰腺炎发病的独立危险因素,吸烟程度与胰腺疾病的发病存在直接关系[45]。但目前其发病机制尚不清楚,多考虑与香烟中尼古丁等成分对胰腺的直接损伤作用有关。尽管本研究病例组患者吸烟史所占比例高于对照组。但多因素Logistic回归分析提示,吸烟史并非AP并发PPC的危险因素,仍需进一步行相关研究阐明发病机制及增大样本量证实该结果。
目前已知LIP与胰腺炎严重程度并非呈正相关,但在AP发病过程中,胰腺组织水肿或坏死,胰液大量渗出,其中的LIP进入血液及组织间隙,在PPC的形成过程中,其内的液体积聚即可能包含大量释放出的LIP[46]。本研究提示,病例组LIP水平低于对照组,可能与纳入研究患者中LIP检查时间不统一,导致升高水平不一致所致,还需进行多项研究加大样本量来证实该结果。
Ranson评分、BISAP评分为评估胰腺炎严重程度的常用评分系统。APACHEⅡ评分则侧重于反映全身炎性反应情况,其准确性和有效性已得到证实和广泛认可,与AP严重程度呈正相关[47-49]。本研究提示,上述几种评分与AP并发PPC具有相关性,但均非AP并发PPC的独立影响因素,可能与上述评分中部分项目因评估医师的主观性而造成不同,形成信息偏倚所致。
3.7 本研究的局限性 (1)部分患者实验室检查资料不全而没有纳入本研究,导致可能存在选择偏倚或信息偏倚;(2)部分病因病例如胆源性AP例数过少,对病因相关性的统计分析存在影响。
综上所述,AP并发PPC的发生率为13.7%,其发生位置最常见于胰尾部。并发PPC的AP患者在年龄、严重程度分级、病因、BMI、吸烟史、饮酒史、既往胰腺炎病史、糖尿病病史、ALB、LIP、D-二聚体、APACHEⅡ评分、Ranson评分、MCTSI评分、BISAP评分、腹腔积液、胸腔积液发生率方面均与未并发PPC的AP患者存在差异。AP并发PPC与性别、住院时间、住院费用等无关。BMI、饮酒史、既往有胰腺炎病史、糖尿病病史、LIP、D-二聚体是AP并发PPC的独立危险因素,对存在上述因素的患者,应密切随访。入院患者应常规完善胸腹部影像学检查,以CT为最重要影像学检查,必要时动态复查,对AP并发或者未并发PPC的患者的可控因素进行早期干预,降低其发展为MSAP或SAP的概率,减少住院时间,改善预后,定期随诊,早发现,早治疗。普及各项评分在临床中的应用,对AP严重程度的评估及预测具有重要意义。
作者贡献:杨子云进行文章的构思与设计,研究的实施与可行性分析,进行统计学处理,结果的分析与解释,撰写论文,论文的修订,对文章整体负责,监督管理;杨子云、何佳薇、张景丽、李若畅进行数据收集、整理;张海蓉负责文章的质量控制及审校。
本文无利益冲突。
