新冠恢复期血浆拟捐献者健康评估及抗体水平分析*
2020-08-13谢毓滨邹彬彬陈东阳智芬谭智文王清旷开其晏永和
谢毓滨 邹彬彬 陈东 阳智芬 谭智文 王清 旷开其 晏永和
自2019年12月下旬以来,新型冠状病毒(2019-nCoV)在全球蔓延。为抗击新冠病毒肺炎,提高治愈率,降低死亡率,国家卫生健康委办公厅于2020年2月14日发布的《新型冠状病毒肺炎重症、危重型病例诊疗方案(试行第二版)》[1]中,将输注恢复期血浆作为一种特异性治疗方案并加以推广。此外,还出台了国卫办医函[2020] 185号文件[2],对恢复期血浆捐献者的抗体水平进行了要求。为积极探索长沙地区的新冠肺炎重症、危重症患者的恢复期血浆治疗方案,长沙血液中心与临床集中救治医院密切配合,共同开展恢复期血浆捐献者的招募与采集工作。为保障血浆捐献者的安全,避免采集不符合治疗要求的血浆,进行采集前健康评估和相应的抗体检测,选择合适的捐献者,对于保证恢复期血浆治疗的效果尤为重要。现将2020年2月7日~3月8日长沙市拟参加恢复期血浆捐献的新冠肺炎康复者一般健康状况和抗体检测情况报告如下。
材料与方法
1 研究对象 收集2020年2月7日~3月8日长沙市有意愿参加新冠肺炎康复者恢复期血浆捐献的40名康复者体检数据进行评估,筛选出15名健康评估合格者作为拟捐献者。新冠肺炎患者康复出院标准由集中救治医院参照《新型冠状病毒感染的肺炎诊疗方案(试行第五版修正版)》等文件规定的标准执行。
2 方法
2.1 评估方法:集中救治医院临床医师根据有捐献意愿的新冠肺炎康复者出院时的临床状况,对于其是否适合捐浆进行健康评估,要求捐献者既往体健,无重大基础性疾病,除新冠肺炎外,其它项目均符合《单采血浆站操作技术规程(2011版)》、《血站技术操作规程2019版》等文件中规定的无偿献血健康体检标准。
2.2 样本采集与处理方法:每位拟捐献者静脉采集EDTA抗凝全血5 mL,分离红细胞与血浆,血浆样本检测前采用56℃ 30 min进行病毒灭活处理。
2.3 检测方法:采用ELISA方法检测新型冠状病毒IgM、IgG抗体及总抗体,固相红细胞粘附法筛查血小板抗体,凝集法检测红细胞直接抗体及不规则抗体。样本检测依据试剂盒操作说明进行。
2.4 新型冠状病毒抗体滴度测定方法:检测前采用样本稀释液对血浆样本进行倍比稀释,共设置9个稀释梯度,分别为1∶10、1∶20、1∶40、1∶80、1∶160、1∶320、1∶640、1∶1 280、1∶2 560,吸取稀释后样本各100 μL分别进行检测。以可检测到阳性的最高稀释倍数为滴度,其中,1∶10为试剂盒IgM抗体和IgG抗体阳性检出限,1∶1为总抗体阳性检出限。
2.5 生物安全防护:工作人员按照二级生物安全防护标准执行。
3 主要试剂 2019-nCoV 核酸检测试剂盒(圣湘生物,批号008)、2019-nCoVIgM检测试剂盒(万泰生物,批号NC0M20200205B)、2019-nCoVIgG检测试剂盒(万泰生物,批号NC0G20200203B)、2019-nCoV总抗体检测试剂盒(万泰生物,批号NC0A20200204B)、血小板抗体试剂盒(长春博德,批号20191005)、筛选红细胞(上海血液生物,批号20207004)、抗人球蛋白试剂(上海血液生物,批号20195001)。其中,新冠病毒抗体检测试剂为科研试用试剂。
4 主要设备 ESCO生物安全柜、EPOCH酶标仪、TECAN洗板机、久保田KA-2200离心机、久保田PlateSpinⅡ平板离心机、上海圣科水浴箱、杭州奥盛恒温金属浴仪。
结 果
1 新冠肺炎恢复期血浆拟捐献者一般健康状况 15名拟捐献者中男性13名,女性2名,平均年龄32岁,平均住院时长16.5 d,血样采集距出院平均时长17.9 d。15名拟捐献者均为轻症患者,出院时康复状况较好,血常规、心肝肾功能等生化指标基本正常,仅3名出院时ALT略微偏高,可能与治疗期间大量用药导致的肝脏负荷相关,需采集血液样本进行复查,详见表1。后续复查结果显示,15名拟捐献者ALT结果均低于40 U/L,符合血液捐献的标准,说明出院后居家隔离期间肝脏功能修复良好。15名拟捐献者出院时的一般健康体检显示,心率、呼吸、血压、体温、血氧饱和度等均正常,CT检查显示肺部均有明显吸收,详见表2。
2 新冠肺炎恢复期血浆拟捐献者经血液传播疾病传染因子、血型及血型抗体检测情况 所有拟捐献者血液中新冠病毒核酸检测均呈阴性。HBV、HCV、HIV、梅毒等经血液传播疾病常规检测结果显示,有1名康复者HBsAg及HBV核酸检测均呈阳性,追溯住院时的检测结果发现其HBV等输血前四项检测结果呈阴性,且采用了灵敏度较高的化学发光法,该患者住院时间为14 d,医院检测距本次检测时间为23 d,其既往无相应感染史,考虑其住院期间可能处于窗口期未检出。进一步提示新冠恢复期血浆捐献将相关检测关口前移的必要性。
15名拟捐献者中,A型占40%(6/15),B型占40%(6/15),AB型占13.33%(6/15),O型占6.67%(1/15),直抗检测、不规则抗体筛查均呈阴性,血小板抗体筛查均呈强阳性,详见表3。由于捐献者血小板计数均正常,无出血等临床相关症状,排除试剂及人为操作因素,考虑为非特异性阳性反应。
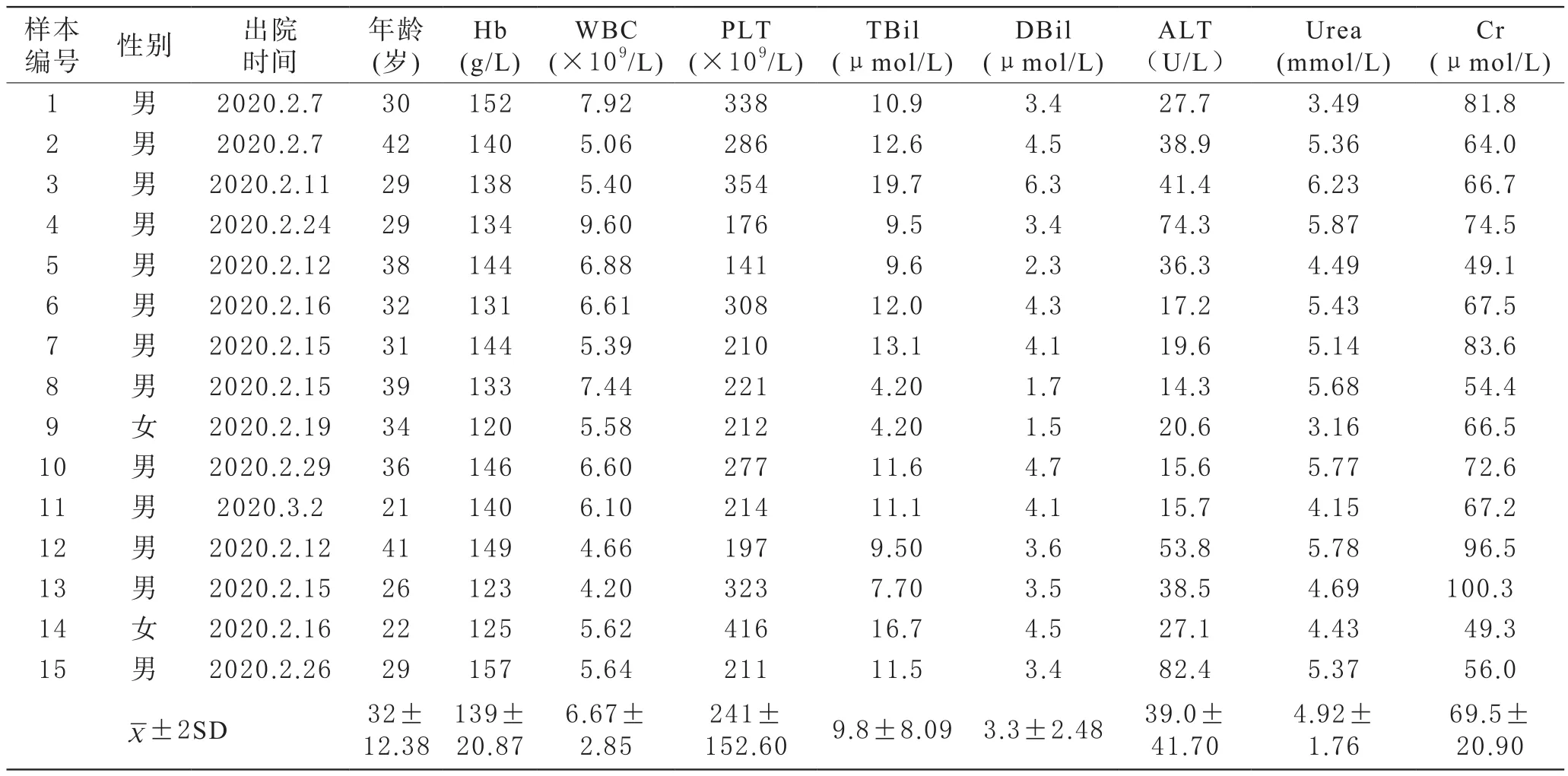
表1 15名新冠肺炎恢复期血浆拟捐献者出院时血常规及生化指标
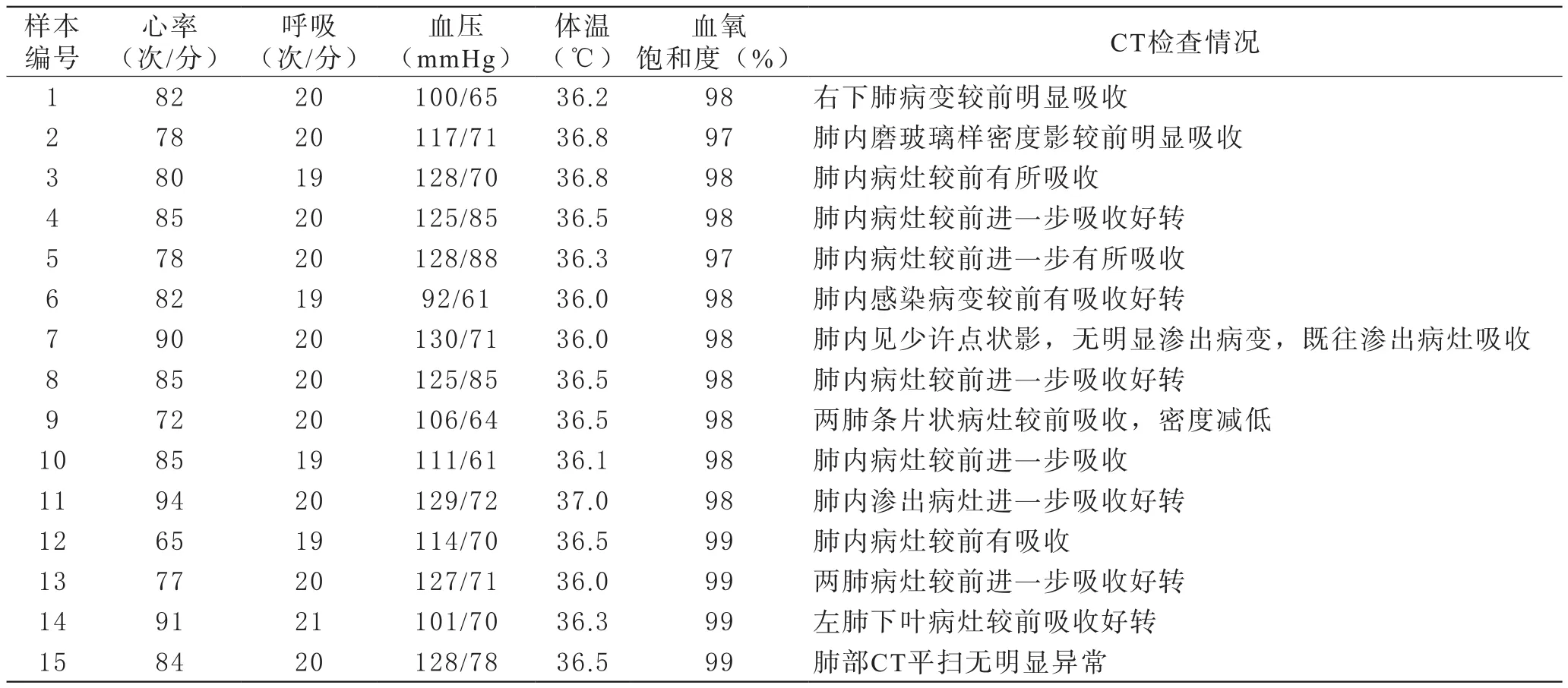
表2 15名新冠肺炎恢复期血浆拟捐献者出院时一般健康状况
3 新冠肺炎恢复期血浆拟捐献者新冠病毒抗体检测情况 15名拟捐献者中,其中20%(3/15)为IgM阴性,53.33%(8/15)IgG抗体滴度大于160,60%(9/15)总抗体滴度大于320,46.67%(7/15)同时满足IgG抗体滴度大于160及总抗体滴度大于320,详见表4。IgM抗体滴度中位数1280(0~2 560),IgG抗体滴度中位数160(40~640),总抗体滴度中位数320(80~2 560)。IgM、IgG、总抗体滴度水平与住院起至样本采集总天数的分布见图1。不同滴度的新冠病毒抗体水平与住院平均天数、血液采集至出院时间平均天数及平均总天数详见表5。
讨 论
新冠肺炎康复者恢复期血浆治疗是一种被动免疫疗法,血浆中高滴度的病毒特异性抗体可与患者体内的病毒中和,达到破坏病毒、清除病毒的作用。该治疗方式在SARS[3,4]、MERS、禽流感等疫情爆发期间得到了应用,取得了一定的治疗效果。临床上治疗新冠肺炎的方式主要以对症治疗,纠正或缓解临床症状为主,在缺乏疫苗和特效药的情况下,恢复期血浆治疗是目前唯一一种特异性临床治疗方式。
本研究中,15名拟捐献者既往体健,无重大基础性疾病,无经血液传播疾病,无过敏史,出院时身体恢复情况理想,其中有多人参加过无偿献血,是恢复期血浆捐献的理想人群。红细胞直抗检测、不规则抗体筛选试验均呈阴性,但血小板抗体筛查实验全部呈强阳性。15位拟捐献者均无输血史,其中13名为男性,由于输血或妊娠等免疫性因素导致特异性抗体产生的可能性不大。所有人员血小板计数均正常,无血小板破坏的实验室证据,无出血、皮下淤血、紫癜等相应临床症状。从实验来看,阳性对照、阴性对照、非感染者阴性对照等结果正常,同样的试剂盒用于常规临床血小板抗体筛查及配型等实验均正常,可排除试剂及人员操作问题。有研究表明,SARS冠状病毒可侵犯造血细胞,通过生成自身抗体或免疫复合物等免疫介导造成细胞损害,血小板和其他具有相似抗原的血细胞也可能被抗血小板抗体和免疫复合物结合,引发免疫损伤[5]。奎宁、万古霉素、哌拉西林他唑巴坦等药物,可产生药源性血小板抗体,药物依赖性血小板抗体主要针对血小板糖蛋白GPⅡb/Ⅲa 和GPⅠb/Ⅸ等,导致血小板减少[6-8],血小板在停用致敏药物之后1周左右可恢复至正常[8]。经过对药物史的调查发现,我市新冠肺炎患者住院期间大多接受过氯喹或哌拉西林他唑巴坦等药物的治疗,但并未发生血小板的减少或相应的临床症状,且康复者出院均为10 d以上。因此考虑血小板抗体呈非特异性阳性反应,但该非特异性阳性反应是否与新冠病毒感染导致的自身抗体或免疫复合物相关,或者是否与新冠肺炎治疗所使用的药物相关,后续还需进一步研究。一方面将加大样本量,另一方面将持续追踪观察本次研究对象,并增加血小板抗体特异性检测以区分HLA抗体或HPA抗体。
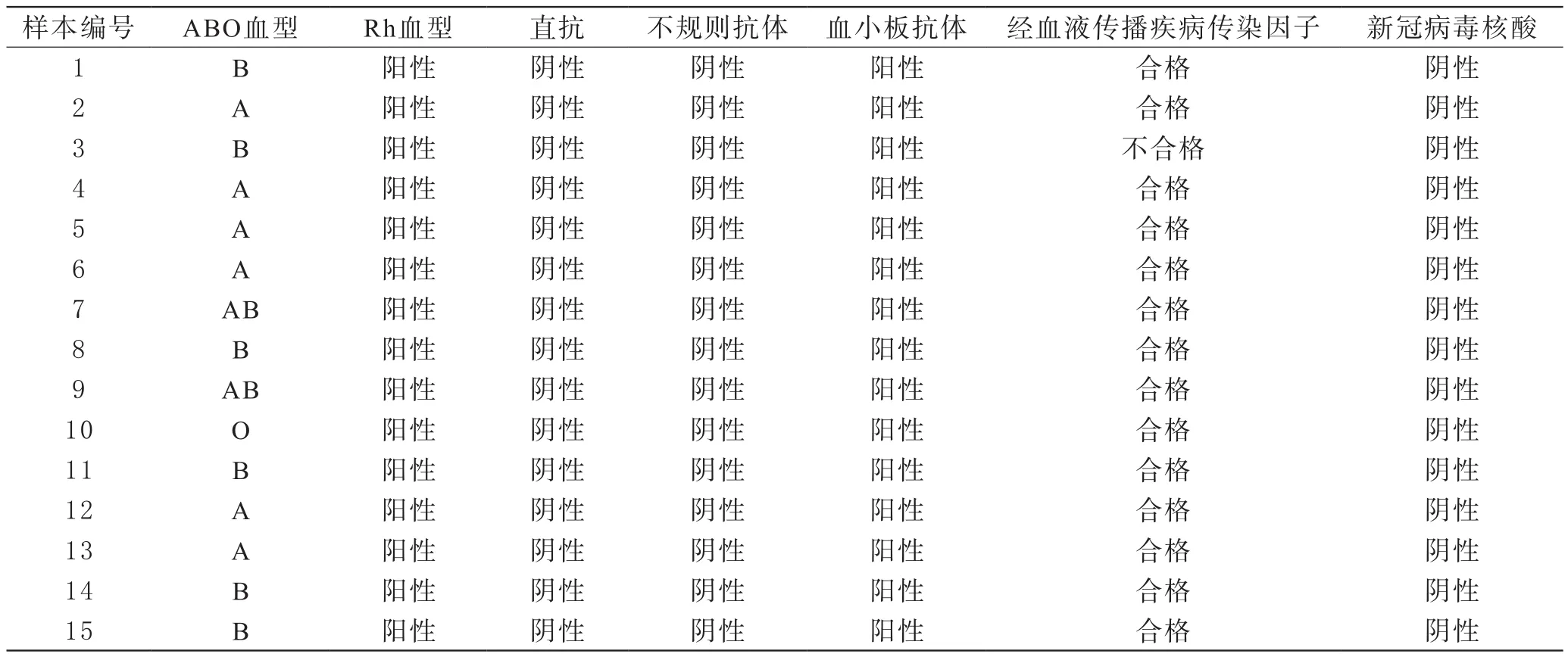
表3 15名新冠肺炎恢复期血浆拟捐献者传染因子、血型及抗体检测情况

表4 15名新冠肺炎恢复期血浆拟捐献者新冠病毒及抗体检测情况
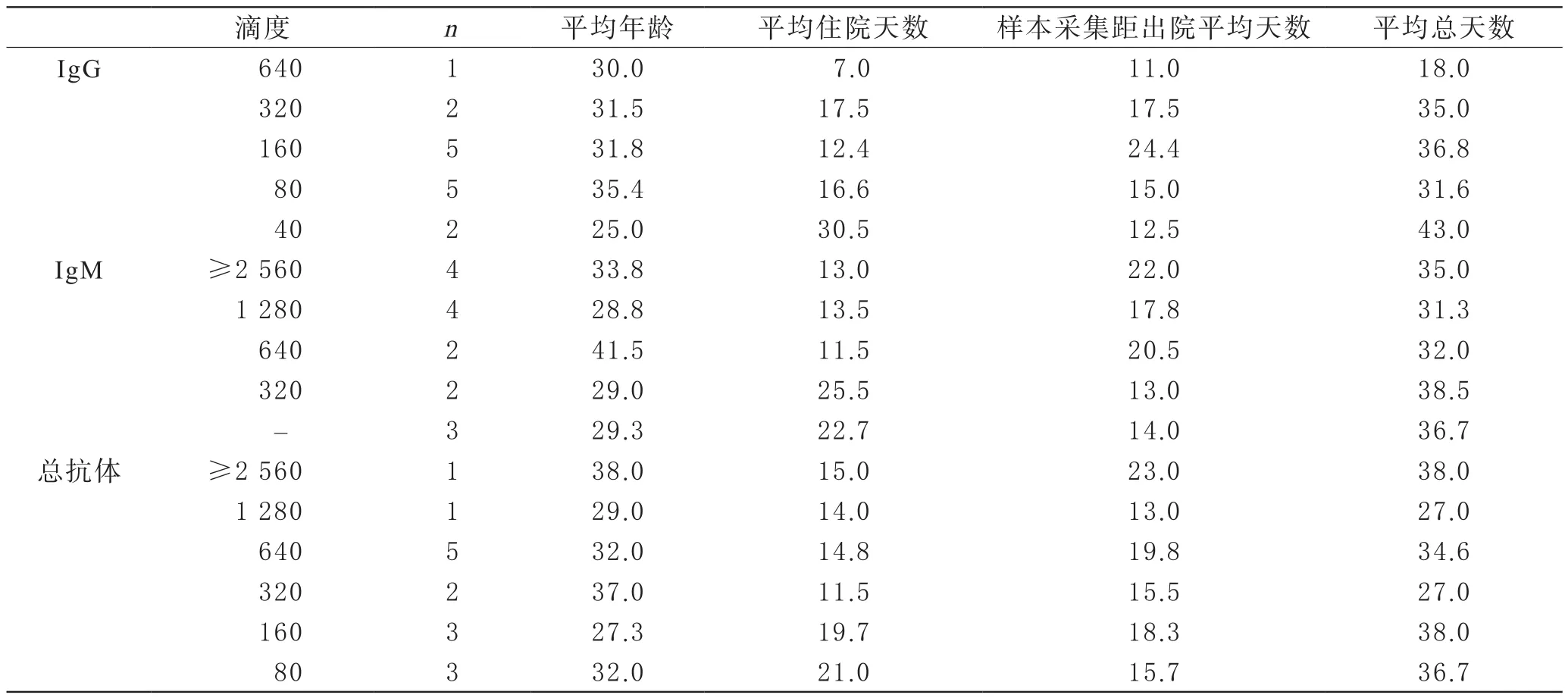
表5 15名新冠肺炎恢复期血浆拟捐献者新冠病毒抗体水平与住院及采样时间
机体在感染病毒后会发生免疫防御反应并产生IgM、IgG、IgA等特异性抗体。其中,IgM 抗体是急性期感染的诊断指标,IgG抗体则提示感染中后期或既往感染。因此,IgM和IgG抗体的水平通常被作为急性感染期或恢复期的辅助判断依据。P.-R. Hsueh等的研究表明,SARS病毒的抗体在起病9~10 d左右开始出现,15 d左右达到第一次高峰,IgM抗体3~4周左右开始下降,在12周左右仍能保持低水平状态存在,效价维持在40~80[3]。ZHOU P.等的研究表明,新冠病毒感染人体后,其IgM 抗体约在5~7 d产生,而IgG 抗体可在10~15 d产生[9]。本次研究中的15位拟捐献者平均住院16.5 d(7~33 d),康复出院到血液采集平均17.9 d(10~29 d),从住院到血液采集平均为34.4 d(18~43 d),起病时间一般为住院前1~2 d,即从起病到血液样本采集平均5周左右,但其抗体滴度水平与病程、性别、年龄、实验室等其他检查结果之间并无明显相关性,抗体水平在一定的范围内波动,个体之间有较大差异。由于我市新冠肺炎患者住院期间,并未接受过新冠病毒抗体相关检测,缺乏纵向对照,无法进行前后比对分析。由于无连续监测结果,并不能判断新冠抗体目前是否达到峰值,还是已经处于下降状态。因此,对新冠肺炎患者住院收治期间,除常规进行新冠病毒核酸检测之外,同步进行新冠病毒抗体的检测也十分必要。
15名拟捐献者的IgG抗体和总抗体的滴度水平基本一致,总抗体滴度水平较IgG抗体水平高或者持平。本次观察到IgG抗体滴度最高为640,该康复者从住院到样本采集总天数为18 d,起病三周左右,与既往研究结果IgG抗体2~3周达到峰值一致[3];而滴度80、160、320的康复者,平均总天数分别为31.6 d、36.8 d、35 d,无明显随病程天数的增加呈上升或下降趋势;但IgG抗体滴度40者,平均总天数43 d,明显较滴度80以上者起病时间更长。IgM抗体滴度中位值为1 280,66.67%(10/15)的拟捐献者IgM抗体滴度普遍大于640,说明IgM抗体在5周左右甚至更长的时间内仍然有较高水平,提示新冠病毒IgM抗体的表达特点和其他病毒抗体可能并不相同。3名IgM抗体呈阴性的康复者,IgG抗体和总抗体的滴度也同样偏低,IgG抗体滴度均≤80,总抗体滴度均≤160,其平均年龄与平均起病总天数与其他组差别不大,可能他们的抗体水平已经过了峰值呈衰减状态,或者其抗体本身表达就处于较低水平;还有4名IgG抗体滴度≤80,但IgM呈阳性,且滴度水平不等(320~2 560)。也就是说,根据康复者自身免疫应答状况的不同,抗体水平不一。因此,要了解康复者在康复期内新冠病毒抗体表达水平、特点及变化趋势,也需要加大样本量进一步追踪。
《新冠肺炎康复者恢复期血浆临床治疗方案(试行第二版)》[2]在试行第一版的基础之上,对于新冠病毒抗体滴度的要求进行了相应的修改,对IgM抗体是否呈反应性不再做要求,同时也增加了总抗体滴度的标准,要求IgG抗体滴度大于160或总抗体滴度大于320。依据第二版方案,15名拟捐献者中仅有7~9名符合方案中所规定的抗体滴度水平。新冠肺炎康复者系特殊的血液捐献者,身体状况并不等同于一般无偿献血者,虽然心肝肾等功能指标正常,但免疫功能不同程度受损,需要逐步恢复。血浆中是否含有高滴度的抗体,是保证血浆治疗效果的重要因素,而且新冠病毒抗体滴度的水平与康复出院后的时间节点也因人而异,恢复期血浆的最佳采集时机并无确定的标准,并非所有意愿捐献者的抗体滴度水平均符合恢复期血浆捐献的要求。
综上所述,采集前进行新冠肺炎康复者健康评估和抗体水平的检测,对于选择合适的捐献者,保障捐献者的安全,尽可能用好宝贵的恢复期血浆,保障治疗效果,具有重要意义。
利益冲突所有作者均声明不存在利益冲突
