80例新型冠状病毒感染肺炎患者相关血液检测指标分析
2020-08-13王云赵长城谷妍姚余有刘杨岳莉石玉如查晓丹戚应杰
王云 赵长城 谷妍 姚余有 刘杨 岳莉 石玉如 查晓丹 戚应杰
2019年12月,湖北省武汉市发现多例不明原因的肺炎患者,2020年1月12日其致病病原体被命名为:新型冠状病毒(SARS-CoV-2)。经过研究发现:该病毒属于β属冠状病毒,其基因组和蝙蝠SARS样冠状病毒(bat-SL-CoVZC45)同源性高达85%以上[1,2],具有极强的传染性,其传播方式是通过经呼吸道飞沫(咳嗽、喷嚏)和接触传播,人群普遍易感。感染后人体可出现发热、干咳、乏力、胸闷等症状,多数预后良好,部分起病症状轻微,无明显发热症状;严重者可出现呼吸窘迫综合征、伴发脓毒血症等,最终多脏器功能衰竭而导致患者死亡,严重威胁患者的生命安全[3]。当下新型冠状病毒已感染中国多省地区,安徽省疫情也十分严峻。为了探讨实验室检测参数对新冠肺炎患者诊疗中的价值,本文收集了80例新型冠状病毒感染肺炎患者的相关血液检测指标,现报道如下。
对象与方法
1 研究对象 采用回顾性研究方法,参照《新型冠状病毒感染的肺炎诊疗方案》第六版[3]。疑似组:选取本院于2020年1月~2020年3月收治的40例新冠肺炎疑似患者,其中男性18例,女性22例,年龄18~73岁,中位年龄38.67岁。确诊组:选取本院于2020年1月~2020年3月收治新冠肺炎确诊病例80例,其中男性45例,女性35例,年龄4~91岁,中位年龄45.33岁。健康对照组:来自本院健康体检人员40例,其中男性25例,女性15例,年龄14~83岁,中位年龄46岁。三组患者的性别、年龄等一般资料的比较,差异无统计学意义(P>0.05),具有可比性。
入选标准:确诊组和疑似组都具有明确的流行病学接触史及COVID-19临床症状和(或)肺部影像学特征。确诊病例还具备以下病原学证据之一:(1)呼吸道标本或血液标本实时荧光定量聚合酶链式反应(qRT-PCR)检测新型冠状病毒核酸阳性;(2)呼吸道标本或血液标本病毒基因测序,与已知的新型冠状病毒高度同源[3]。疑似病例:连续两次新型冠状病毒核酸检测阴性(采样时间至少间隔24 h)后,结合临床与影像学综合评估后排除新冠病毒感染。
2 方法
2.1 试剂与仪器:血常规类项目采用迈瑞BC-6900五分类血细胞分析仪,配套试剂由深圳迈瑞公司提供。T 淋巴细胞亚群免疫分型采用美国BD Caliur流式细胞仪,配套试剂由BD公司提供。生化类项目采用日立5800生化分析仪、广州万孚免疫荧光干式定量检测仪,配套试剂由长征公司、万孚公司提供。
2.2 观察指标:抽取研究对象早晨空腹外周血,含抗凝剂(EDTA-K2)的静脉血2 mL。使用血细胞分析仪测定外周血白细胞计数(WBC)、中性粒细胞百分比(G %)、淋巴细胞百分比(L %)、红细胞计数(RBC)、血红蛋白(HGB)、血小板计数(PLT)、超敏C反应蛋白(hs-CRP)。
使用流式细胞仪测定外周血 T 淋巴细胞亚群免疫分型:CD3+绝对计数、CD4+绝对计数、 CD8+绝对计数、CD4+/ CD8+。
抽取研究对象早晨空腹静脉血(3~5)mL,3 000 r/min,离心10 min分离血清,使用生化分析仪测定生化指标:谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TB)、直接胆红素(DB)、尿素氮(BUN)、肌酐(CR)、尿酸(UA)、胱抑素C (CYC)、血淀粉样蛋白A(SAA)、乳酸脱氢酶(LDH)、肌酸激酶同工酶(CK-MB)、肌红蛋白(MYO)、肌酸激酶(CK)。
使用免疫荧光干式定量检测仪检测降钙素原(PCT) 、肌钙蛋白I(TnI)。所有项目均严格按照仪器和试剂说明书操作规程操作。所有实验项目室内、室间质控结果均正常在控。为确保人员、实验室以及样本的生物安全,以上所有样本采集、运输、实验室操作均严格参照《新型冠状病毒感染的肺炎诊疗方案》(第六版)执行[3]。
3 统计学处理 应用SPSS24.0软件进行统计分析,计量数据如满足正态分布,则以均数±标准差表示,三组人群数据之间的差异比较采用单因素方差分析;非正态分布数据采用lg数据转换之后符合正态分布且方差齐性一致再进行单因素方差分析。经过单因素分析后,筛选具有统计学意义的变量(P<0.05)纳入二元logistic回归分析,探讨新冠肺炎发病之后临床检查的独立敏感指标,及其相对敏感度(OR值)和95%CI。P<0.05表示差异有统计学意义。绘图软件采用GraphPad Prism 8.0.2 制作森林图。
结 果
1 三组血常规检查结果比较 B组L(%)、RBC、HGB均低于A组,差异有统计学意义(P<0.05);B组G(%)、hs-CRP 均高于A组,差异有统计学意义(P<0.05); C组WBC、L(%)、RBC、HGB均低于A组,差异有统计学意义(P<0.05);C组G(%)、hs-CRP 均高于A组,差异有统计学意义(P<0.05);C组与B组间比较结果,差异均无统计学意义(P>0.05);三组之间PLT差异均无统计学意义(P>0.05)。详细见表1。
2 三组人群T淋巴细胞亚群免疫分型检查结果比较 B组CD3+、CD4+、CD8+、均低于A组,差异有统计学意义(P<0.05);C组CD3+、CD4+、CD8+、均低于A组,差异有统计学意义(P<0.05);C组CD4+低于B组,差异有统计学意义(P<0.05);三组之间CD4+/ CD8+差异均无统计学意义(P>0.05)。详细见表2。
表1 三组人群血常规结果对比 (±s)

表1 三组人群血常规结果对比 (±s)
a:B组与A组比较,P<0.05,b:C组与A组比较,P<0.05
项目 健康组A组 疑似组B组 确诊组C组 F值 P值WBC(×109/L) 7.09±1.95 6.62±4.14 5.93±3.31b 3.49 <0.05 G(%) 59.83±8.85 64.96±15.61a 68.03±15.44b 9.30 <0.05 L(%) 37.68±6.47 26.28±13.51a 23.64±13.72b 17.83 <0.05 RBC(×1012/L) 5.19±0.41 4.44±0.60a 4.54±0.60b 45.16 <0.05 HGB(g/L) 153.19±8.19 134.0±18.96a 134.60±20.08b 39.98 <0.05 PLT(×109/L) 190.31±57.68 197.41±67.70 181.37±62.45 0.884 >0.05 hs-CRP(mg/L) 3.72±2.27 25.48±41.09a 28.87±37.32b 7.954 <0.05
3 三组人群生化项目检查结果比较 B组ALT、AST、TB、DB、 SAA均高于A组,差异有统计学意义(P<0.05);B组BUN、UA均低于A组,差异有统计学意义(P<0.05);C组ALT、AST、TB、DB、SAA均高于A组,差异有统计学意义(P<0.05);C组BUN、UA均低于A组,差异有统计学意义(P<0.05);C组AST、SAA均高于B组,差异有统计学意义(P<0.05);三组之间CR、 CYC 、PCT差异均无统计学意义(P>0.05)。详细见表3。
4 三组人群心肌酶谱检查结果比较 B组CK-MB、TnI 均高于A组,差异有统计学意义(P<0.05);C组LDH、CK-MB 均高于A组,差异有统计学意义(P<0.05);C组LDH、CK-MB均高于B组,差异有统计学意义(P<0.05);C组 TnI 低于B组,差异有统计学意义(P<0.05);三组之间MYO、CK差异均无统计学意义(P>0.05)。详细见表4。

表2 三组人群T淋巴细胞亚群免疫分型结果对比( ±s)
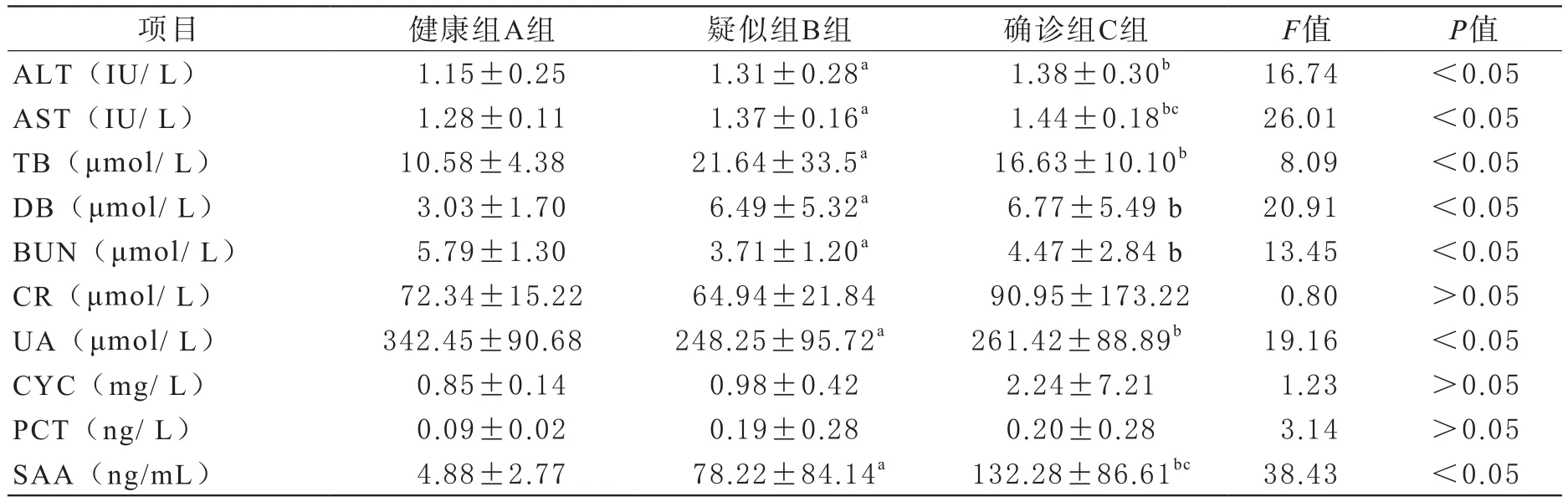
表3 三组人群生化项目结果比较( ±s)

表4 三组人群心肌酶谱结果比较( ±s)
5 新冠肺炎患者血液指标数据的多因素logistic回归分析以单因素分析中差异有统计学意义(P<0.05)的血常规、T淋巴细胞亚群免疫分型、生化指标为自变量,以是否患有新冠肺炎为因变量(0=未患有新冠肺炎,1=患有新冠肺炎),采用多因素二元logistic逐步回归分析影响新冠肺炎发生的危险因素。结果显示:SAA 、LDH 、CK-MB、AST、TB、DB越高,患新冠肺炎的危险性越大;WBC、L%、HGB、BUN、UA、CD4+、CD8+越低,患新冠肺炎的危险性也越大。详见表5、图1、图2。
讨 论
新型冠状病毒感染引起的COVID-19疫情发展迅速,严重威胁到了人民群众的生命安全与身心健康[4,5]。新冠病毒核酸检测阳性是确诊病例诊断的“金标准”,特异性较高。但核酸检测实验会受到采样、试剂、人员操作等多种因素的影响,可能出现“假阴性”。需要多次多部位采样检测,且耗时较长。因此,临床迫切需要快速有效的实验室指标来综合辅助诊断。本研究选取了80例COVID-19确诊病例,通过检测患者的血常规、T 淋巴细胞亚群免疫分型、生化等指标的表达水平,分析比较这些指标在不同人群中的表达差异,旨在探讨这些实验室指标在COVID-19辅助诊疗中的应用价值。
COVID-19确诊患者在发病早期,入院初诊时外周血WBC、L% 均不同程度的下降,明显低于健康人群(P<0.05),这与刘映霞的报道也是一致的[6]。淋巴细胞降低的原因可能与新冠病毒会直接或间接杀死淋巴细胞、或抑制淋巴细胞生成有关,将导致患者免疫功能低下[7]。Beswick EJ 曾研究表明:CD4+T淋巴细胞可以反映机体的免疫水平,较低的CD4+水平预示着患者的免疫水平较差[8]。本次研究对比的三组人群:确诊组、疑似组相比健康组的CD4+T 淋巴细胞均不同程度降低,确诊组降低的更加明显,这与朱明超的报道也是一致的[9]。由于新冠病毒与SARS-CoV同属于冠状病毒,且其基因组序列与SARS-CoV 具有极高相似度[10],而何忠平在研究SARS-CoV时也曾发现:SARS患者外周血CD3+、CD4+、CD8+水平在发病时显著降低,但CD4+/ CD8+则无明显变化[11],因而推测感染了新冠病毒的患者,与感染其他冠状病毒类似,机体的免疫系统可能会遭到新冠病毒破坏。目前,针对COVID-19患者外周血CD4+T 淋巴细胞降低的机制尚不清楚,分析可能有如下3种原因:(1)新冠病毒直接损伤CD4+T 淋巴细胞,但并不入侵CD4+T淋巴细胞。(2)新冠病毒直接入侵CD4+T 淋巴细胞,把CD4+T淋巴细胞当成宿主细胞。(3)COVID-19患者出现脓毒血症,并启动炎症风暴效应,CD4+T淋巴细胞大量分泌细胞因子,导致CD4+T 淋巴细胞消耗过多,或抑制了CD4+T 淋巴细胞的分化与生成[12]。这有待于进一步研究证实。提示在日后的诊疗中,若患者外周血T淋巴细胞持续较低水平,则很有可能机体会丧失对抗原刺激的免疫作用,最终导致病情进行性加重,甚至出现死亡。此外,通过对比治疗前后 T细胞亚群计数的变化,可以为患者的预后以及疗效评估提供一个新的思路。

表5 新冠肺炎患者血液指标数据的多因素二元logistic回归分析
肝细胞含有大量的ALT和AST,当肝细胞受损时,ALT、AST等反映肝脏功能的指标就会升高。本次研究结果显示:ALT、AST等指标升高,提示COVID-19除肺部发生病变之外,还可引起肝脏损害。而黄傲也报道了新冠病毒可能直接与胆管细胞结合,通过直接损伤或进一步诱发炎症反应而导致胆管细胞功能障碍,进而引起肝损伤[13]。
动态监测心肌酶谱是临床判断COVID-19患者是否并发心脏损害的重要依据[14]。本研究结果显示:部分COVID-19患者发病初期LDH、CK-MB升高,这与朱明超、陈实的报道也是一致的[9,15]。而陈国伟、Mugosa B等在研究甲型H1N1流感时也曾发现:患者血清AST、CK-MB、LDH水平在发病初期显著升高[16,17],推测其原因可能是:患 COVID-19时随着疾病的进展心脏缺氧加重,造成心肌细胞不同程度的损伤,细胞膜通透性增加,逸出心肌酶活性增高。提示临床在治疗时应特别注意保护COVID-19患者的心脏功能。
SAA在健康人体中含量甚少。当机体发生病毒感染时48 h内会显著升高,并在疾病的恢复期又迅速下降[18],其浓度变化是病毒感染早期诊断的依据,还可以作为动态监测病情疗效的敏感指标,而hs-CRP则在细菌性感染时较敏感。本次研究发现:在COVID-19确诊患者中,SAA的变化幅度大于hs-CRP,表现出明显升高。提示在以后的诊疗中,可以将SAA、hs-CRP联合检测,作为诊断病毒感染合并细菌感染强有力的证据。
本次检测反映肾功能的指标UA降低,尚未检索到相关报道,推测原因可能是部分重症患者无法健康进食,嘌呤摄入量有限导致UA降低。由于目前收集的标本量有限,有待于日后扩大样本量,进行进一步的探讨。
多因素二元logistic逐步回归分析COVID-19发生的因素结果显示:ALT 、AST 、TB 、DB 、SAA、LDH、CK-MB越高,感染COVID-19的危险性越大;WBC、L%、HGB、BUN、UA、CD4+、CD8+越低,感染COVID-19的危险性也越大,提示这些项目可作为早期辅助诊断COVID-19的重要指标。
综上所述,临床医生在接诊发热患者,特别是疑似感染COVID-19患者,如血液学检测指标符合上述变化特点,并结合流行病学史及肺部影像学结果,应高度怀疑COVID-19的可能,及时建议患者做进一步的核酸项目检查,以免漏诊或误诊,及时控制传染源避免引发更多的接触感染。由于COVID-19目前尚无有效的疫苗可供使用,且传染性强,因此提高疾病的综合诊断水平对提升疑似患者的诊断阳性率、降低病死率显得尤为重要。综上所述,血常规、T 淋巴细胞亚群免疫分型、生化等项目的检测对于COVID-19的诊断具有重要临床意义,应予以重视。
利益冲突所有作者均声明不存在利益冲突
