腹腔镜脾脏部分切除术治疗脾良性肿瘤的体会
2020-08-12郝龙沙洪存
郝龙,沙洪存
(宁波市鄞州区第二医院 肝胆外科,浙江 宁波 315000)
脾脏是人体最大的淋巴器官,在维持机体免疫平衡方面有着重要作用,部分脾脏切除术作为一种保脾术式被越来越多地应用于临床。随着腹腔镜手术经验的积累以及手术技巧的提高,腹腔镜脾脏完全切除已有较广泛的应用,但腹腔镜脾脏部分切除由于手术难度较大,报道较少。本研究探讨了腹腔镜下脾脏部分切除术的临床体会,现报道如下。
1 资料和方法
1.1 一般资料
将2014年3月至2019年3月在宁波鄞州第二医院普外科行腹腔镜部分脾脏切除术14例脾脏良性占位病变患者纳入回顾性分析。本组女4例,男10例,平均年龄(45.3±14.9)岁。脾脏肿物平均直径(5.24±2.37)cm,所有患者术前血常规检查均在正常范围内。术前均行CT及CTA检查以明确:(1)脾脏肿块位置、大小及与脾脏周围组织的关系;(2)脾门血管的分支类型。
1.2 手术方法
患者采取全身麻醉,取头高右倾位,主刀站在患者右侧。取脐上1 cm处作10 mm长纵行切口,Veress针刺入腹腔建立人工气腹,置入10 mm Trocar建立观察孔。在左腋前线平脐部水平处做一约12 mm主操作孔,剑突下及剑突与脐中点处各做一约5 mm辅助孔,均置入相应大小Trocar。打开左侧部分胃结肠韧带,在胰腺上缘从右往左游离出脾动脉主干,并离断部分脾胃韧带,显露脾门,逐一处理拟切除侧脾脏的血管及韧带。大致原则是:根据脾脏肿瘤位置拟定保留脾上部或者下部,若病灶位于脾下部而保留脾上部者应保留脾上极血管及胃短血管;反之则应保留脾下极血管和脾胃韧带下段。根据术前患者腹部CTA提供的脾门血管特征,采用二级脾蒂离断法[1]与脾门血管逐束离断法[2]处理(图1)脾门血管,采用Hem-o-lok夹闭病灶对应的血管(图2),超声刀离断血管后观察脾脏缺血线拟定切脾范围(图3),用超声刀在靠近缺血线以内约0.5 cm左右离断脾脏。观察残余脾断面颜色,创面出血可以电凝止血、Prolene线缝合、覆盖止血纱等方法处理(图4)。将标本装袋,延长脐部纵行切口约3 cm长,将标本从该切口取出。

图1 脾脏占位位于上极

图2 脾脏上极血管分离夹闭

图3 可见明确缺血线
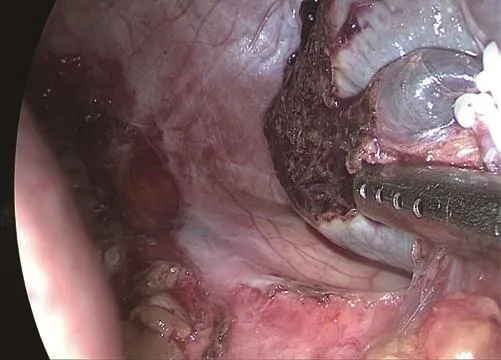
图4 脾脏断面
2 结果
14例患者均顺利完成腹腔镜部分脾脏切除术,无中转开腹。手术时间为(2.5±0.4)h;术中出血量为(180±40)mL。术中无胰腺损失、大出血等并发症,术后患者恢复良好。术后第1天均可下床活动,患者住院时间为(5.3±1.6)d,硅胶引流管放置时间为(3.2±1.5)d。术后无腹腔感染、胰瘘、出血等并发症发生。14例患者术后病理结果提示脾脏血管瘤7例,脾脏假性囊肿5例,脾脏真性上皮性囊肿2 例。术后均未见门静脉血栓形成。
3 讨论
脾脏肿瘤发病率低,但随着B超、CT等影像学检查的逐渐普及,脾脏占位性病变特别是无症状的脾脏良性肿瘤的检出逐渐增多,其中以血管瘤最为多见,其次为脾囊肿。脾脏良性肿瘤早期多无症状,但随着肿瘤增大,可引起压迫症状,亦有破裂可能。脾血管瘤破裂出血的发生率为25%~30%[3]。因此,一旦明确诊断为原发性脾脏良性肿瘤一般应行脾切除术,而对较小的或位于上下两极的病变,特别是年轻患者,可行脾脏部分切除或脾脏切除后正常脾片自体移植[4]。姜洪池等[5]总结了脾脏部分切除必须满足以下条件:(1)肿瘤部位在脾上极或下极处,并远离脾门;(2)肿瘤大小不超过脾脏的1/2;(3)患者凝血功能正常。
腹腔镜术式具有放大视野的效果,有助于精细的手术操作,本组病例术中均无因大出血而输血治疗,术后引流液生化均提示无胰瘘表现。腹腔镜手术对患者创伤小,术后切口疼痛轻,本组病例术后第1天均可下床活动,有助于快速康复,并缩短患者住院时间。14例术后均未发生腹腔感染,脾脏部分切除术在治疗脾脏疾病的同时又保留脾脏的免疫功能。有文献指出残余脾脏内的记忆性B细胞可以分泌IgM,有助于避免爆发性感染的发生[6]。门静脉系统血栓形成是脾切除术后最常见的并发症之一,发生率高达10%~50%[7]。而保留部分脾脏,则可以维持血小板的数量及功能的稳定,从而减少血栓发生的风险[8]。同时,我们在临床工作中及时监测了患者脾脏切除或者脾脏部分切除术后血小板的数值,如果发现血小板升高,则予口服阿司匹林肠溶片,可以起到预防门静脉血栓作用。
腹腔镜脾脏部分切除术的操作,笔者体会如下。(1)术前完善CTA检查,通过CTA充分了解脾门血管分支类型,并结合脾脏占位情况拟定切脾范围。(2)脾门血管的处理是关键,打开胃结肠韧带后首先在胰腺上缘解剖出脾动脉主干,并在脾动脉主干处放置预阻断带,如果脾门游离时发生大出血,可以将阻断带收紧,有利于术中止血。(3)紧靠脾门精细解剖脾门部血管,脾动脉在脾门处分支类型以二支型和三支型最常见,占95%以上,分出的脾叶血管又可分出1~3支脾段血管。而相邻脾叶段之间形成“相对无血管区”,沿着此区分离可减少术中出血[9]。(4)采用二级脾蒂离断法与脾门血管逐束离断法处理脾蒂,打开脾门部包膜,精细解剖出脾叶分支,并夹闭离断肿物对应的脾叶血管。(5)游离脾蒂动脉时不要求完全“骨骼化”,操作应轻柔,以免损伤脾动脉、静脉而引起大出血[10]。(6)除了脾蒂血管供应脾脏外,脾上极可由胃短动脉、脾上极血管供血;脾下极可由胃网膜左动脉、脾结肠韧蒂内侧支血管供血。所以保留脾上极时,应注意不能切断脾胃韧带上部,避免破坏胃短血管和脾上极血供;保留脾下极时,应注意保护脾胃韧带下部, 避免破坏胃网膜左血管和脾下极血供[11]。(7)脾叶动脉夹闭后,脾脏表面很快形成明显的缺血线,此时应靠近缺血线以内约0.5 cm左右离断脾脏,这样既不易损伤正常的脾脏组织,又不会因保留过多的缺血脾组织而引起术后坏死性发热[12]。(8)部分患者脾动脉及分支在脾门处走行迂曲,如果结扎了病变部位对应的脾叶血管,相应脾脏颜色仍有部分未发生缺血变化,则证明仍可能存在血管供血,应继续解剖、寻找其他血管。(9)脾实质横断面止血方式较多,Godiris-Petit等[13]报道了使用超吸刀和氩离子凝固刀离断脾实质,莫锋等[14]则采用超声刀联合双极电凝离断脾实质,吴宝强等[15]使用LigaSure离断脾实质。我们在临床中采用的方式是超声刀游离脾实质,出血点可采用单极电凝止血或Prolene线缝扎止血,术后断面使用止血纱覆盖止血。