腹腔镜胰十二指肠切除术经验初探
2020-08-12冯伟汪启乐王盛陈政马垚侍继东林斌
冯伟,汪启乐,王盛,陈政,马垚,侍继东,林斌
(徐州医科大学附属宿迁医院 肝胆胰外科,江苏 宿迁 223800)
目前微创技术方兴未艾,在外科领域已彻底改变了传统手术方式并广泛应用于临床。腹腔镜胰十二指肠切除术(laparoscopic pancreaticoduodenectomy,LPD)是目前公认的难度最大、风险最高的腹部外科微创手术。以往因其较长的学习曲线和对手术设备、手术团队较高的技术要求,故而难以广泛推广普及。随着腔镜下器械的不断发展和规范化操作技术的不断进步,近年来LPD的报道逐渐增多。尤其在国内腹腔镜胰十二指肠切除手术专家共识和操作指南的基础上,随着LPD手术操作技术的流程化,围术期管理的精准化,使其在国内呈现出快速发展的趋势。和国内其他地区级基层医院一样,我院近两年也开始LPD的尝试,开展初期慎重起见,必然存在病例的选择、技术的稳定、患者的安全等问题。本文结合文献和笔者团队的经验,探讨应用初期开展LPD的一些经验技巧和安全性评价。
1 资料和方法
1.1 一般资料
回顾性分析2018年8月至2019年8月徐州医科大学附属宿迁医院肝胆胰外科收治的LPD患者临床资料。纳入标准:(1)患者一般状态良好,心肺功能良好,能够耐受较长时间腹腔镜手术;(2)壶腹周围癌及胰头部良性或恶性肿瘤,其中胰头恶性肿瘤最大直径<3 cm;(3)术前影像学检查无重要血管侵犯;(4)无明确远处转移。最终纳入10例,体重指数(body mass index,BMI) (24.0±4.0)kg/m2。其中男8例,女2例;平均年龄(62.2±12.5)岁。术前黄疸9例,均未做引流治疗。所有患者均签署由医院伦理委员会批准的患者知情同意书,符合医学伦理学规定。
1.2 手术方法
采用5孔法,人字形体位,头侧抬高约15°,脐下10 mm套管放置腹腔镜,主刀右侧站位,“V”型分布操作套管:右侧腹直肌外缘脐水平线以上约1~2 cm放置12 mm Trocar作为主操作孔,左侧对应位置同样放置10 mm Trocar作为辅助孔,左右侧腋前线肋缘下2 cm分别放置5 mm套管。具体操作步骤如下:(1)探查腹腔盆腔排除腹膜种植转移。(2)打开胃结肠韧带,悬吊肝左外叶,游离结肠肝曲,充分下降横结肠。(3)探查显露胰腺,在胰腺下缘解剖显露肠系膜上静脉,同时显露Henle干并离断(图1)。利用腔镜优势沿肠系膜上静脉向头侧充分分离胰后隧道。(4)直线切割吻合器断胃(图2)。(5)解剖胰腺上区,定位肝总动脉后解剖并悬吊,分别解剖出肝总动脉、肝固有动脉和胃十二指肠动脉(图3),距胃十二指肠动脉根部约1 cm处离断,同时显露胰腺上缘门静脉,贯通胰后隧道,一并清扫淋巴结缔组织。然后向左侧解剖腹腔干及其分支,向第一肝门推进并解剖离断胃右动脉,清扫相应淋巴结缔组织(图4)。(6)Kocher切口充分游离十二指肠,显露下腔静脉、左肾静脉及肠系膜上动脉起始部(图5),解剖离断Treitz韧带并离断空肠,超声刀离断胰腺颈部(图6)。近端空肠经肠系膜上血管后牵向右侧,沿SMA右侧由脚侧向头侧采用“系膜钩突薄层化”策略逐步离断胰腺钩突(图7)。最后离断胆管,移除标本。(7)消化道重建采用Child式按胰肠、胆肠和胃肠顺序完成。胰肠吻合常规采取支架置入的“胰管-空肠黏膜”吻合,其中胰腺断端与空肠对系膜缘侧壁浆膜层采取4-0 Prolene缝线间断“U”型贯穿缝合3针,待胰管吻合完成后再以贯穿缝线完成前壁胰腺残端与空肠侧壁吻合(图8)。4-0倒刺缝线行连续胆肠端侧吻合。最后使用直线切割吻合器行胃肠侧侧吻合。(8)胰肠吻合口以网膜垫包裹后,胰肠吻合口前方及胆肠吻合口后方分别放置引流管。
1.3 观察指标
观察患者全程手术时间、术中出血量、术中输血情况、术后住院时间、术后活动时间及术后病理情况、术后复发情况。所有患者随访至2019年12月31日。

图1 显露Henle干

图2 断胃

图3 解剖清扫肝总动脉周围

图4 清扫离断胃十二指肠动脉

图5 Kocher切口游离

图6 离断胰腺

图7 薄层化离断胰腺钩突

图8 胰肠吻合
1.4 统计学分析
2 结果
10例患者手术均顺利完成,手术时间300~635 min,平均(437.0±87.0)min。术中出血量为50~400 mL,平均(171.0±106.0)mL。术中无输血病例。术后首次下床活动时间1~3 d,平均(2.0±1.1)d。术后住院时间11~62 d,平均(19.5±15.1)d。术后总体并发症发生率为40%(4/10):其中A级胰瘘2例,B级胰瘘1例,无C级胰瘘,均经禁饮食、积极药物治疗及穿刺引流后治愈;上消化道出血1例,经急诊介入栓塞治疗痊愈。
术后病理情况(图9~12):壶腹癌3例;胆总管下段腺癌3例;胰头癌3例,其中胰头钩突癌1例;胰腺实性假乳头状瘤1例。所有患者手术标本切缘均阴性。恶性肿瘤患者术中清扫淋巴结数6~30枚,平均(14.5±9.0)枚,其中8例患者有不同程度淋巴结转移。术后随访2~14个月,期间无患者死亡,1例胰头癌患者术后6个月肿瘤复发。
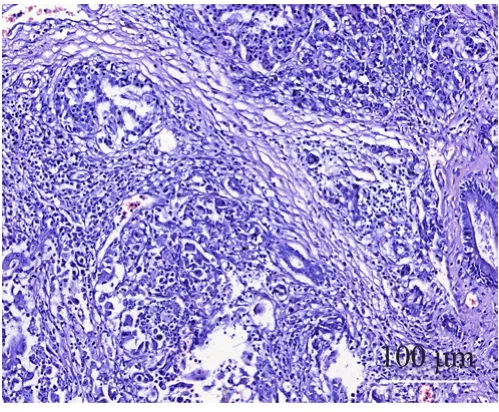
图9 胆管下段癌(HE,×200)
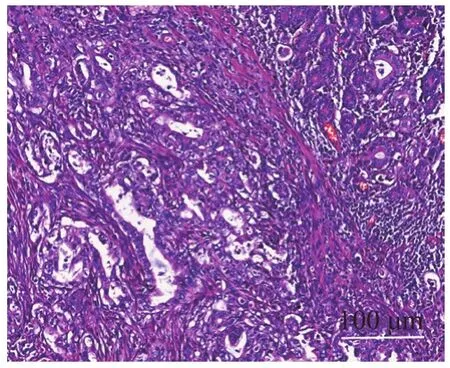
图10 壶腹部癌(HE,×200)
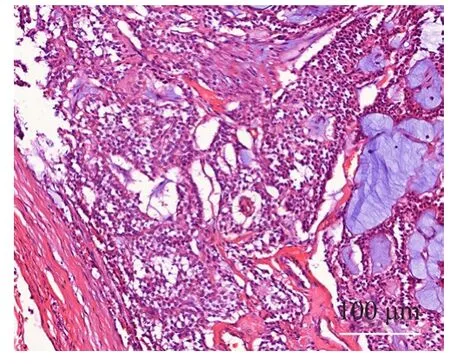
图11 胰腺实性假乳头状瘤(HE,×200)

图12 胰头癌(HE,×200)
3 讨论
腹腔镜胰十二指肠切除术(laparoscopic pancreaticoduodenectomy,LPD)是目前公认的腹腔镜手术中最为复杂的,虽然早在1994年Gagner就完成了世界首例LPD[1],但随后发展缓慢,远远落后于腹腔镜下其他手术。直到随着腔镜设备、器械以及技术的进步,该项技术才逐步得到广大学者的认可[2]。国内外关于LPD的大宗病例报道不断增加,尤其近五年在国内多个胰腺中心的引领下,LPD逐渐趋于成熟,并在国内诸多医疗单位相继开展[3-4]。随着国内LPD专家共识和腹腔镜肝胆胰手术操作指南的颁布[5-6],LPD的发展更是达到了一个崭新的高度,大样本的文献分析也使得LPD的安全性和有效性得到进一步确认[7-8]。
LPD作为肝胆胰外科最大的手术之一,涉及组织器官解剖结构复杂、手术难度大、术后并发症多,在基层医院开展必然要慎之又慎。我们在开展LPD的初期从患者安全角度出发严格把握手术适应证,尽可能避免腹腔内脂肪较多患者,选择合适的病例对手术的成功实施及减少术后并发症有着重要的意义。胰头钩突部良性肿瘤一般不侵犯血管,且无需行术中淋巴结清扫,因此是我们初始开展LPD的理想选择。胆管下段癌、壶腹癌以及十二指肠乳头癌由于出现黄疸较早,发现时较少发生肠系膜血管侵犯,同样比较适合早期阶段实施。我们在技术和流程逐步成熟后,在团队配合下开始开展一些体型偏瘦、病灶较小、无血管侵犯的胰头钩突恶性肿瘤。
在开展LPD初期,我们取得成功的经验在于形成一个具有统一思路的团队。术者要求具备丰富的开腹胰十二指肠切除手术经验,具备通过其他肝胆胰腔镜手术积累的娴熟操作技能。第一助手要求具备腔镜下各种缝合打结技能,且与术者在同一胰腺中心完成步骤训练,学习曲线一致。而第二助手能够清楚理解LPD过程中重要的局部解剖结构,能够根据术者需要掌握好解剖角度和层次[9]。手术团队基本固定,按照既定手术模块化循序渐进进行,这样就可以明显缩短学习曲线。有研究表明LPD前11例为学习曲线初期,并发症的发生率相对较高[10]。国内多中心的研究显示1 029例LPD并发症发生率在完成40例后与OPD相当[11]。谭煜炜等[12]的单中心研究表明LPD学习曲线的第一阶段病例数在45例左右。但腹腔镜术中术野显露好,解剖结构直观清晰,整个手术过程可实时学习,并且可反复回放学习总结经验教训。Liao等[13]指出分段训练可有效缩短手术时间,帮助初学者快速完成学习曲线。Sharpe等[14]则认为10例是LPD最短的学习曲线期。我们团队在腔镜手术的视角下按照从左到右、从足端到头端、从前到后的手术切除步骤和区域将手术过程分解,建立流程化操作模块,充分发挥腔镜优势,反复共同分析每一操作步骤,减少不必要的重复术野暴露和操作,能够缩短手术时间,使得手术完成平均时间控制在(437.0±87.0)min。与金巍巍等[15]单中心所行233例LPD平均手术时间(368.0±57.4)min,刘学青等[16]早期100例LPD手术时间(395.2±62.9)min仍有差距,主要与腔镜下缝合重建耗时较长有关,相信随着手术例数的增加手术时间会逐渐缩短。
手术我们采用右侧单一主操作孔的5孔法操作。术中采用以门静脉-肠系膜上血管为轴,从左到右、从足端到头端、从前到后的“No Back”路径[17]。以胰腺为中心顺时针分区操作,贯通胰颈后隧道,胰腺钩突采用“系膜薄层化”[18]策略处理,消化道重建采取胰肠吻合、4-0倒刺缝线连续胆肠吻合,最后以直线切割吻合器行胃肠吻合,可以降低术后胃排空延迟的发生率。通过术前分析CT及MRI影像学资料,团队共同辨别确认血管无侵犯及变异等情况,按照既定模块化操作步骤确定手术层次及层面,减少术中意外出血可能,降低手术风险。其中模块化步骤中最难确定的风险在于胰头钩突区的切除及胰肠吻合的处理。胰头钩突的处理我们是在离断Treitz韧带并离断空肠后将近端空肠通过肠系膜血管下方翻转向右侧,第一助手向左侧牵开SMV,在其背侧显露SMA,紧贴SMA以超声刀小口由足侧向头侧、由浅入深“薄层化”处理钩突系膜组织,谨慎暴露离断胰十二指肠下后动脉,特别注意胰十二指肠动脉弓和胰背动脉右支来源的钩突动脉环形成的交通支变异,避免损伤空肠第一支动脉。此时还要避免助手牵张过度,防止胰十二指肠下静脉及胰十二指肠上后静脉撕裂出血。对于行胰肠吻合,我们选择的患者胰腺往往偏软,甚至有的胰管扩张不明显,而有研究表明软胰是LPD术后的独立危险因素,29.41%的软胰患者最终发展为临床胰瘘,可能与软胰断面缝线不易收紧或针眼渗漏有关[19]。2016年国际胰瘘研究小组(International Study Group on Pancreatic Fistula,ISGPF)的胰瘘共识[20]表明胰腺手术后胰瘘发生率为3%~45%。虽然洪德飞等[21]报道的“洪氏一针法”,刘建华等[22]报道的双针胰肠吻合法,都对胰肠吻合方式进行了优化,降低了缝合难度,节省手术时间,且术后胰瘘发生率低。但我们手术初期还是选择自己熟悉的方式,常规采取支架置入的“胰管-空肠黏膜”吻合,胰腺断端与空肠对系膜缘侧壁浆膜层采取4-0 Prolene缝线间断“U”型贯穿缝合3针,胰管与空肠黏膜6-0可吸收缝线间断缝合4~6针并固定支架管,吻合完成后再以贯穿缝线完成前壁胰腺残端与空肠侧壁吻合。可以避免无触感下线结剪切作用切割胰腺,同时减少缝合次数避免胰腺残端缺血。术后总体并发症发生率为40%,其中A级胰瘘2例,B级胰瘘1例,无C级胰瘘,上消化道出血1例,无其他严重并发症发生,也和相关并发症报道基本相近[23],均在可接受范围内。
我们在应用初期谨慎开展LPD,虽然存在学习曲线和手术时间较长、花费较高等缺点,但腹腔镜独特的视角优势和解剖清晰特点,使得LPD在切除重建、淋巴结清扫等方面已基本达到与OPD同样的手术效果。而且其具有手术创伤小、操作精准、出血少、术后疼痛小、下地活动早等优势,符合快速康复理念。初期开展LPD时通过选择合适的病例,严控适应证,循序渐进度过学习曲线,由具有丰富腔镜经验的肝胆胰外科医师操作是安全可行的。
