miR-702-3p对心肌细胞缺氧复氧损伤后凋亡的影响
2020-08-12宫能静姜玉玉李小雨高娇娇程向阳
宫能静,姜玉玉,李小雨,高娇娇,程向阳
(蚌埠医学院第一附属医院麻醉科,蚌埠 233030;*通讯作者,E-mail:yxhyhr@163.com)
急性心肌梗死是世界范围内常见的心血管疾病[1]。梗死后血流量的恢复加重了组织和器官的损伤,称为缺血/再灌注(ischemia/reperfusion,I/R)损伤[2]。体内和体外的研究显示,I/R损伤的潜在机制包括氧化应激、线粒体功能受损,自由基产生过多,最终导致细胞凋亡[3-5]。到目前为止,尚无有效的预防心肌I/R损伤的治疗方法。因此,充分理解I/R损伤的复杂分子机制,寻找有效的克服I/R损伤后细胞凋亡的方法仍需要很大的努力。
miRNAs是一类高度保守的非编码RNA,通过在转录后水平抑制基因的表达,参与了几乎所有细胞过程[6]。越来越多的证据表明,miRNA表达失调与多种人类心血管疾病有关,包括心肌I/R损伤[7]。例如,miR-873通过Egln3而抑制H/R心肌细胞凋亡[8];过表达miR-124-3p可下调RIPK1表达,减轻心肌细胞H/R损伤,从而发挥心肌保护作用[9]。这些miRNA可能成为缺血性心脏病治疗的潜在靶点。有研究表明,在肺动脉高压大鼠的左右心室组织中,miR-702-3p表达升高[10],然而miR-702-3p在心肌梗死中的作用却未见报道。
乙醛脱氢酶2(aldehyde dehydrogenase 2,ALDH2)是线粒体中重要的ALDH家族成员,其对心脏的保护作用已在各种模型中得到证实,包括心肌急性缺血/再灌注损伤[11,12]。通过靶基因预测网站Targetscan,预测ALDH2可能是miR-702-3p的靶基因。前期的研究表明,心肌细胞转染miR-702-3p inhibitor后ALDH2蛋白的表达升高,然而,miR-702-3p是否通过ALDH2调控心肌梗死后细胞凋亡仍不清楚。在本研究通过构建缺氧/复氧(H/R)心肌细胞体外模型研究miR-702-3p在心肌I/R损伤过程中的抗凋亡作用,并探讨其机制。
1 材料与方法
1.1 实验动物与主要试剂
1-3日龄雄性SD大鼠乳鼠,SPF级,购于蚌埠医学院实验动物中心,合格证号:20180004002485。Ⅱ型胶原酶购自北京solarbio公司;Lipofectamin 2000转染试剂、Trizol试剂购自美国Invitrogen公司;聚偏二氟乙烯膜(PVDF)购自美国Milipore公司;miR-702-3p抑制物(inhibitor),miR-702-3p引物购自上海吉玛公司;RNA反转录试剂盒及荧光定量试剂盒均购自广州GeneCopoeia公司;双荧光素酶报告基因质粒载体购自美国Promega公司;Annexin Ⅴ-FITC细胞凋亡检测试剂盒购自碧云天生物公司;兔多克隆抗ALDH2抗体购自美国Abcam公司;兔多克隆抗Bcl-2、Bax、cleaved Caspase-3、GAPDH抗体购自美国Affinity公司;辣根过氧化物酶标记的羊抗兔二抗购自Biosharp公司。
1.2 细胞培养
将1-3日龄乳鼠置于75%酒精浸泡消毒2 min,无菌取心尖组织,以预冷PBS清洗3次,剪成约1 mm3大小的碎块,经含0.08%胰蛋白酶和1%Ⅱ型胶原酶的混合酶37 ℃消化5 min,轻轻吹打后收集细胞悬液;同法反复消化4-5次,取各次的细胞悬液与等体积含20%胎牛血清的DMEM/F12培养基混匀终止消化,以900 r/min离心5 min,弃掉上清,将沉淀与含10%胎牛血清的DMEM/F12培养基混合,用200目滤网过滤后将悬液转移至培养瓶,于37 ℃、5%CO2培养90 min进行差速贴壁后,吸取细胞悬液,以密度为5×105接种于6孔板,同时加入0.1 mmol/L Brdu(抑制心肌成纤维细胞生长),置于5%CO2、37 ℃培养箱中培养,每隔24 h换液,待细胞密度达到70%时,进行后续实验。
1.3 心肌细胞缺氧/复氧模型的建立
待细胞密度为70%左右时,建立缺氧/复氧模型。吸弃6孔板中的培养基,PBS冲洗2次,换无糖DMEM培养基,置入含1%O2和5%CO2的缺氧培养箱,在37 ℃条件下缺氧3 h,然后将6孔板取出,置换DMEM/F12完全培养液,并于5% CO2,37 ℃培养箱中培养4 h进行复氧处理[13]。
1.4 细胞转染及分组
取对数生长期心肌细胞,将细胞随机分为正常对照组(CON)、缺氧复氧组(H/R)、H/R+miR-702-3p inhibitor NC转染组(H/R+inhibitor NC)、H/R+miR-702-3p inhibitor转染组(H/R+inhibitor)。参照Lipofectamine2000转染试剂说明书向心肌细胞分别转染miR-702-3pinhibitor NC及miR-702-3pinhibitor,转染6 h后将培养基更换为含有10%胎牛血清的DMEM/F12培养基,继续培养24 h进行H/R处理。H/R处理完成后即可进行后续实验。
1.5 CCK-8实验检测心肌细胞活力
将原代培养心肌细胞用胰蛋白酶消化并重悬,将细胞以5×103个细胞/孔接种于96孔板,放入5% CO2,37 ℃培养箱中培养过夜。各组进行转染及H/R处理后,每孔加入10 μl CCK-8溶液,37 ℃避光孵育2 h,酶标仪检测450 nm处吸光度(OD)值。
1.6 流式细胞术检测细胞凋亡
转染及建立缺氧/复氧损伤模型后,收集各组心肌细胞,加入195 μl Annexin Ⅴ-FITC结合液重悬细胞,调整细胞密度(1×106个/ml),吸取1 ml细胞悬液加入5 μl Annexin Ⅴ-FITC,混匀后加入10 μl碘化丙啶染色液,轻轻混匀,20-25 ℃避光孵育20 min,流式细胞仪检测凋亡率。
1.7 qRT-PCR检测细胞中miR-702-3p表达水平
转染及建立缺氧/复氧损伤模型后,收集各组心肌细胞,利用Trizol提取细胞总RNA,定量后吸取1 μg总RNA产物,按照广州GeneCopoeia公司miRNA First-Strand cDNA Synthesis Kit进行逆转录合成cDNA。以cDNA为模板,按照广州GeneCopoeia公司miRNA qPCR kit说明书进行qRT-PCR反应,反应体系共20 μl,反应条件如下:95 ℃预热10 min(循环1次);95 ℃变性10 s,59 ℃退火20 s,72 ℃延伸10 s(循环40次)。以U6为内参,采用2-ΔΔCt法计算miR-702-3p的相对表达水平。
引物序列如下:miR-702-3p Forward:GCCGAGTGCCCACCCTTAC,Reverse:CTCAACTGGTGTCGTGGA;U6 Forward:GCTTCGGCAGCACATATACTAAAAT,Reverse:CGCTTCACGAATTTGCGTGTCAT。
1.8 Western blot检测ALDH2、Bcl-2、Bax,cleaved Caspase-3蛋白的表达
转染及H/R造模后,收集各组心肌细胞,加入RIPA裂解液提取细胞总蛋白,BCA法测定蛋白浓度。取30 μg总蛋白SDS-PAGE分离、转膜、5%脱脂牛奶封闭,孵育一抗,包括兔源ALDH2(1 ∶1 000)、兔源Bcl-2(1 ∶1 000)、兔源Bax(1 ∶1 000)和兔源GAPDH(1 ∶3 000),4 ℃孵育过夜,加入辣根过氧化物酶标记的羊抗兔二抗(1 ∶10 000)孵育1 h。ECL显影,放入Western blot成像系统曝光,显影。Image J软件用来分析蛋白的相对表达水平,GAPDH作为内参。
1.9 双荧光素酶报告基因实验
利用Targetscan分析miR-702-3p与ALDH2的3′UTR可能的结合位点,将含有miR-702-3p结合位点野生型(wild type,WT)和突变型(mutant type,MUT)的ALDH2 3′UTR基因序列插入pGL3荧光素酶报告基因载体,分别构建野生型(WT-ALDH2)与突变型(MUT-ALDH2)的ALDH2 3′UTR荧光素酶报告质粒载体,将WT-ALDH2、MUT-ALDH2分别与miR-702-3p mimics、miR-NC共转染48 h收集细胞,采用双荧光素酶报告基因检测试剂盒检测荧光素酶活性。
1.10 统计学方法
采用SPSS 18.0统计软件进行数据处理。数据以均数±标准差表示。两组间比较采用t检验,两组以上比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 H/R处理对心肌细胞中miR-702-3p表达的影响
采用qRT-PCR检测miR-702-3p在H/R处理后的表达情况。与对照组相比,H/R组miR-702-3p的表达水平显著升高(P<0.01,见图1)。
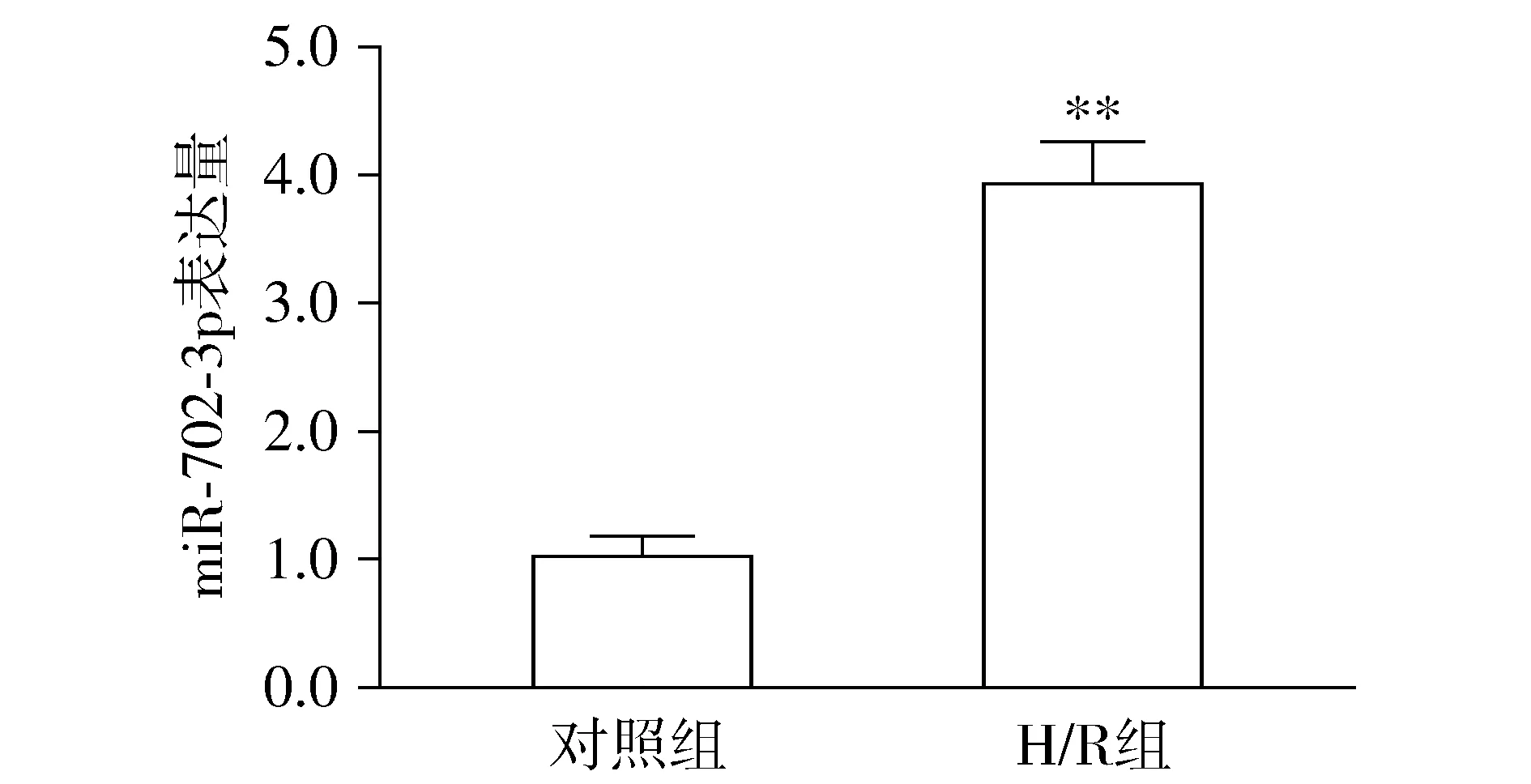
与对照组相比,* * P <0.01图1 H/R处理后心肌细胞中miR-702-3p的相对表达Figure 1 Relative expression of miR-702-3p in cardiomyocytes after H/R treatment
2.2 miR-702-3p对心肌细胞活力、细胞凋亡的影响
为了确定miR-702-3p在细胞活力和凋亡中的作用,通过转染miR-702-3p inhibitor,使miR-702-3p表达下调。结果显示,miR-702-3p inhibitor转染显著降低了心肌细胞中miR-702-3p的表达水平(P<0.01,见图2A)。CCK-8实验检测miR-702-3p下调对细胞活力的影响,结果表明,miR-702-3p下调可以显著减轻H/R处理对细胞活力的影响(P<0.05,见图2B),而转染miR-702-3p NC对H/R处理心肌细胞的生存能力并没有影响。此外,利用流式细胞术检测miR-702-3p下调后心肌细胞的凋亡率,结果表明,缺氧显著升高了心肌细胞的凋亡,而转染miR-702-3p inhibitor后,心肌细胞凋亡率显著下降;转染miR-702-3p NC对细胞凋亡并没有影响(见图3)。

图2 miR-702-3p对心肌细胞活力、细胞凋亡的影响Figure 2 The effect of miR-702-3p on cardiomyocyte viability and apoptosis
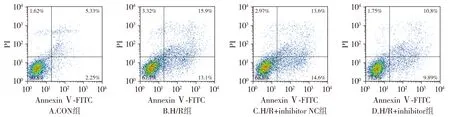
图3 miR-702-3p inhibitor对H/R处理心肌细胞凋亡的影响Figure 3 Effect of miR-702-3p inhibitor on apoptosis of cardiomyocytes after H/R treatment
2.3 miR-702-3p对心肌细胞凋亡相关蛋白和ALDH2蛋白表达的影响
Western blot结果显示,心肌细胞在H/R处理后,Bax和cleaved Caspase-3表达升高,Bcl-2表达下降,ALDH2表达降低。在H/R刺激的心肌细胞中,miR-702-3p inhibitor转染显著逆转了H/R刺激引起的变化(见图4)。

图4 Western blot检测心肌细胞中凋亡相关蛋白和ALDH2蛋白的表达Figure 4 Expression of apoptosis-related proteins and ALDH2 in cardiomyocytes after different treatment by Western blot
2.4 miR-702-3p与ALDH2 3′UTR的作用关系
通过TargetScan预测ALDH2为miR-702-3p的靶基因(见图5A)。双荧光素酶报告基因实验结果显示,共转染miR-702-3p mimics、WT-ALDH2组的荧光素酶活性明显降低(P<0.01);而共转染miR-702-3p、MUT-ALDH2组的荧光素酶活性无明显变化(P>0.05,见图5B)。
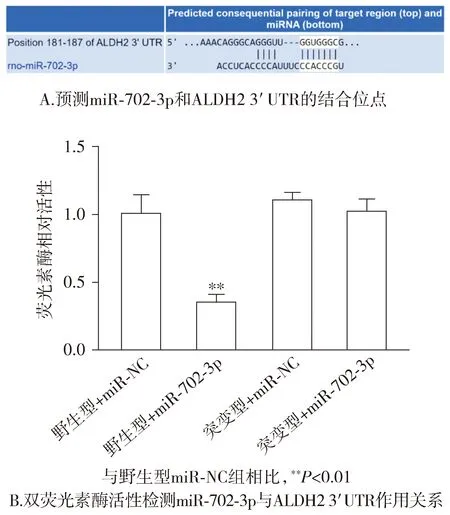
图5 ALDH2是miR-702-3p的靶基因Figure 5 ALDH2 is a target gene of miR-702-3p
3 讨论
心肌缺血后血流量的恢复加重了组织和器官的损伤,称为心肌缺血再灌注(I/R)损伤[2]。凋亡被认为是心肌I/R损伤的主要病理生理机制之一,并被认为是导致心肌I/R损伤后细胞死亡的主要因素[14]。调节细胞凋亡被认为是一种很有前途的心血管疾病治疗策略。心肌细胞为终末分化细胞,其凋亡后导致的心肌损伤是不可逆的。本研究证实了在H/R条件下,细胞凋亡明显增加。
miRNA已经成为多种心血管疾病过程中的重要介质,可能成为心血管疾病的治疗靶点[15]。许多miRNA,如miR-26a-5p[16]和miR-30b-5p[17]都与心肌I/R损伤有关。据报道,miR-702-3p在丙泊酚麻醉的脑组织以及在肺动脉高压的大鼠心肌组织中表达升高[10,18]。因此,我们推测miR-702-3p可能在心肌I/R损伤中发挥作用。本实验重点研究了H/R条件下miR-702-3p在心肌细胞中的作用。将心肌细胞进行H/R处理模拟心肌I/R损伤,结果显示,在H/R条件下miR-702-3p表达显著升高。下调miR-702-3p可以减轻缺氧诱导的细胞损伤,细胞活力增加,凋亡率降低,提示下调miR-702-3p在H/R诱导的心肌细胞损伤中具有保护作用。
识别靶基因对揭示miR-702-3p功能的分子机制具有重要意义。本研究表明,下调miR-702-3p后ALDH2蛋白表达相应升高。ALDH2是一种抗凋亡酶[11],据报道,ALDH2广泛表达于心脏,对心肌I/R损伤具有心脏保护作用[11,19]。在本研究中,H/R处理的心肌细胞ALDH2表达下降,与先前的结果一致。降低miR-702-3p表达时ALDH2表达升高,并且可以显著减弱H/R诱导的心肌细胞凋亡,提高细胞活力。此外,双荧光素酶报告基因实验结果显示,ALDH2是miR-702-3p的靶基因。这更证实了我们的想法。然而,本实验的缺陷在于,需要进一步进行回复实验,来验证miR-702-3p降表达后同时降表达ALDH2,能否逆转miR-702-3p的心肌保护作用。我们将在后续实验中进行验证。
总之,本研究表明,ALDH2是miR-702-3p的靶基因,降低miR-702-3p后ALDH2表达升高,心肌细胞凋亡率降低。因此,调控miR-702-3p表达可以在一定程度上为缺血再灌注损伤提供治疗策略。
