响应面法优化紫花地丁总酚酸的提取工艺及其抗氧化活性研究
2020-08-12段建荣严贵亮
段建荣,严贵亮,杨 辉
(1 张家口市沙岭子医院药剂科,张家口 075000;2 河北北方学院药学系;*通讯作者,E-mail:yangkcer@163.com)
紫花地丁(Violaphilippica)为堇菜科多年生草本植物,又名野堇菜、光瓣堇菜等[1],味苦、性寒,具有清热解毒的功效,是一种药食同源的植物,在民间用药历史悠久。现代药理学研究表明,紫花地丁具有抗炎、抑菌、抗病毒和抗肿瘤等多种功效[2]。文献报道紫花地丁含有丰富的有机酸类成分[3]。酚酸是有机酸中一类具有多重药理活性的天然多酚类化合物,近年来可见较多针对植物总酚酸药理作用的报道,发现其具有多方面的药理活性[4-6],但目前对于紫花地丁中总酚酸的研究报道较少。
本研究采用Box-Behnken法研究紫花地丁总酚酸的提取工艺,清除DPPH自由基法测定紫花地丁总酚酸抗氧化活性,以期为紫花地丁在临床上的应用及开发提供理论参考。
1 材料与仪器
1.1 材料
紫花地丁(河北崇礼,经张家口学院韩博老师鉴定为紫花地丁Violaphilippica全草);没食子酸对照品(天津市光复精细化工研究所);1,1-二苯基-2-苦基肼[1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl) hydrazyl,DPPH,纯度≥98%,上海赛抑生物科技有限公司];其余试剂为分析纯。
1.2 仪器
Alpha-1900双光束扫描型紫外可见分光光度计(上海谱元仪器有限公司);万分之一电子分析天平(赛多利斯公司);PHS-3C数字酸度计(上海大普仪器有限公司);QL-901涡旋混合器(海门其林贝尔仪器制造有限公司)。
2 方法与结果
2.1 紫花地丁总酚酸供试液的制备
取紫花地丁全草适量,60 ℃干燥至恒重。精密称取干燥后的紫花地丁粗粉1 g,加入65%乙醇,液料比(ml/g)为10 ∶1,浸泡30 min,加热回流2次,每次1 h,合并两次提取液,过滤,取滤液,置50 ml量瓶中,加65%乙醇定容即得[7]。
2.2 对照品贮备液的制备
精密称取没食子酸对照品0.011 g,置100 ml棕色量瓶中,加65%乙醇溶解并定容,得没食子酸贮备液(0.110 0 mg/ml)。
2.3 紫外吸收波长的测定
分别吸取没食子酸对照品贮备液、紫花地丁总酚酸提取溶液各1ml,于25 ml容量瓶中,加无水乙醇4 ml,加2 ml 0.3%十二烷基磺酸钠(SDS),加2 ml 1% FeCl3-0.5%铁氰化钾(1 ∶1)混合液,避光静置5 min,加0.1 mol/ml HCl至刻度,混匀,避光反应。20 min后以66%乙醇加显色剂为参比液进行基线校正,于波长200-800 nm处扫描[8]。结果发现在754 nm处样品和与对照品均有最大吸收,且显色前,两者在该波长下无吸收,提示紫花地丁提取物溶液所含成分不会干扰总酚酸的含量测定,故确定754 nm为测定波长。
2.4 标准曲线的制备
分别取对照品贮备液0,0.4,0.8,1.2,1.6,2.0 ml于25 ml容量瓶中,按“2.3紫外吸收波长的测定”项下方法显色,并测定吸光度。以没食子酸的浓度(C)为横坐标,以吸光度(A)为纵坐标,得到标准曲线方程为:A=101.34C+0.002 1,R2=0.999 4,结果表明,没食子酸在0-0.008 8 mg/ml范围内线性关系良好。
2.5 精密度试验
取对照品溶液适量,按“2.4标准曲线的制备”项下方法测定吸光度,重复测定5次,结果吸光度RSD为2.56%(n=5)。表明精密度良好。
2.6 稳定性试验
取供试品溶液适量,每隔25 min测定一次,结果吸光度RSD为3.74%(n=5)。表明样品溶液显色后在100 min内稳定。
2.7 重复性试验
精密称取紫花地丁粗粉6份,各1 g,按“2.1紫花地丁总酚酸的供试液的制备”项下方法制备供试品溶液,按“2.4标准曲线的制备”项下方法测定吸光度,结果吸光度RSD为2.82%(n=6)。表明重复性试验良好。
2.8 加样回收率试验
精密称取已知含量的紫花地丁粗粉3份,各0.500 g,分别精密加入没食子酸贮备液0.5 ml,按“2.1紫花地丁总酚酸的供试液的制备”项下方法制备供试品溶液,按“2.4标准曲线的制备”项下方法测定吸光度,结果平均回收率为100.81%,RSD为2.97%。
2.9 单因素实验
分别对乙醇浓度、回流时间和液料比进行单因素实验,确定各因素的适宜取值范围,从而选择响应面的设计试验的因素水平范围[9]。
2.9.1 乙醇浓度的考察 按2.1方法提取紫花地丁总酚酸,固定提取时间为1 h,回流提取2次,液料比(ml/g)为10 ∶1,选择35%,45%,55%,65%,75%,85%,95%乙醇,每个浓度重复3次实验,考察乙醇浓度对提取液吸光度的影响。图1结果显示,提取液平均吸光度随乙醇浓度增加先增大后减小,当乙醇浓度为65%时,所得提取液吸光度最大[10]。
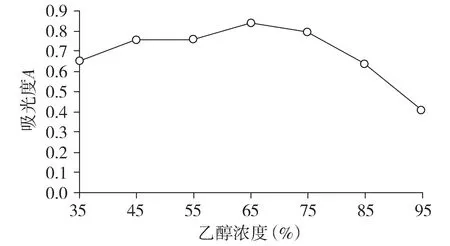
图1 乙醇浓度对提取液吸光度的影响Figure 1 Effect of the ethanol concentration on the absorbance of exteaction solition
2.9.2 回流时间的考察 以60%乙醇为溶剂,液料比(ml/g)为10 ∶1,回流提取2次,分别选择1 h,1.5 h,2 h,2.5 h,3 h,3.5 h作为提取时间,每个提取时间重复3次实验,考察提取时间对提取液吸光度的影响。结果可见提取液平均吸光度随回流时间的延长而增大,当回流时间为2 h时,所得提取液吸光度最大(见图2)[11]。

图2 回流时间对提取液吸光度的影响Figure 2 Effect of the reflux time on the absorbance of exteaction solition
2.9.3 液料比的考察 以浓度为65%的乙醇溶剂,液料比(ml/g)分别为10 ∶1,20 ∶1,30 ∶1,40 ∶1,50 ∶1,回流提取2次,每个液料比重复3次实验,考察不同液料比对提取液吸光度的影响。结果可见提取液平均吸光度随提取溶剂比例的增加先增大后减小,当液料比为30 ∶1时,所得提取液吸光度最大(见图3)[12]。
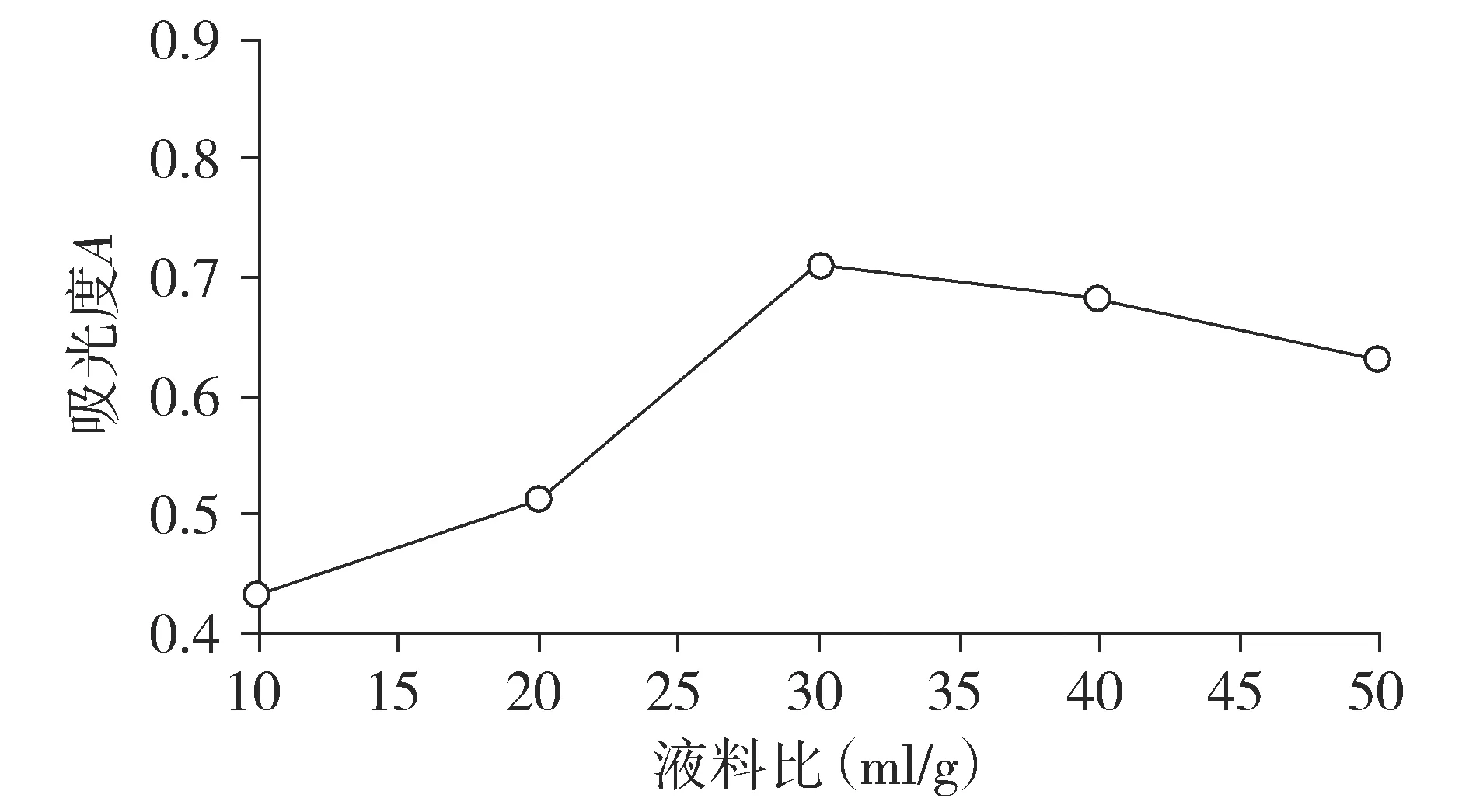
图3 液料比对提取液吸光度的影响Figure 3 Effect of the ratio of liquid to material on the absorbance of exteaction solition
2.9.4 提取率的计算 将测得的吸光值代入回归方程中计算总酚酸质量浓度,再计算出总酚酸的提取率[13]。总酚酸得率公式:R1=C×V×N/W×100%。
式中:R1表示紫花地丁总酚酸的提取率(mg/g);C表示由回归方程计算出的样液中总酚酸浓度(mg/ml);V表示提取液体积(ml);N表示稀释倍数;W表示紫花地丁的质量(g)。
2.10 Box-Behnken试验设计及响应面分析
在单因素试验的基础上,采用Box-Behnken设计方案,以乙醇浓度A、提取时间B、液料比C为考察因素,以紫花地丁总酚酸提取率为响应值,利用Design-Expert v8.0.6软件优化紫花地丁总酚酸提取工艺。试验因素、水平编码见表1。设计方案及结果见表2,拟合二次多项式模型的方差分析见表3。

表1 实验因素与水平Table 1 Factors and levels in response surface design
对表2中的数据进行多元回归拟合,获得紫花地丁总酚酸提取率对自变量乙醇浓度A、提取时间B、液料比C的二次多项回归方程为:

表2 Box-Behnken试验设计方案与结果Table 2 Response surface design arrangement and experimental results
R1=+0.70+0.024A+0.016B-0.020C-0.041AB+6.500×10-3AC-0.015BC-0.087A2-0.054B2-0.091C2。

由表3中的P值可以知道,方程中A、B、C、AB、BC、A2、B2、C2对Y值的影响显著,表明实验因子对响应值不是简单的线性关系。由回归方程可知因素A与B,A与C及B与C均有交互作用。其回归方程响应面及等高线见图4-6,各交互因素的响应面存在最高点,即在所选的范围内存在极值,说明各因素考察范围较为适当。

图4 乙醇浓度和提取时间对紫花地丁总酚酸提取率的响应面图Figure 4 The contour map and response surface graph of effect of ethanol concentration and reflux time on extraction yield of total phenolic acids
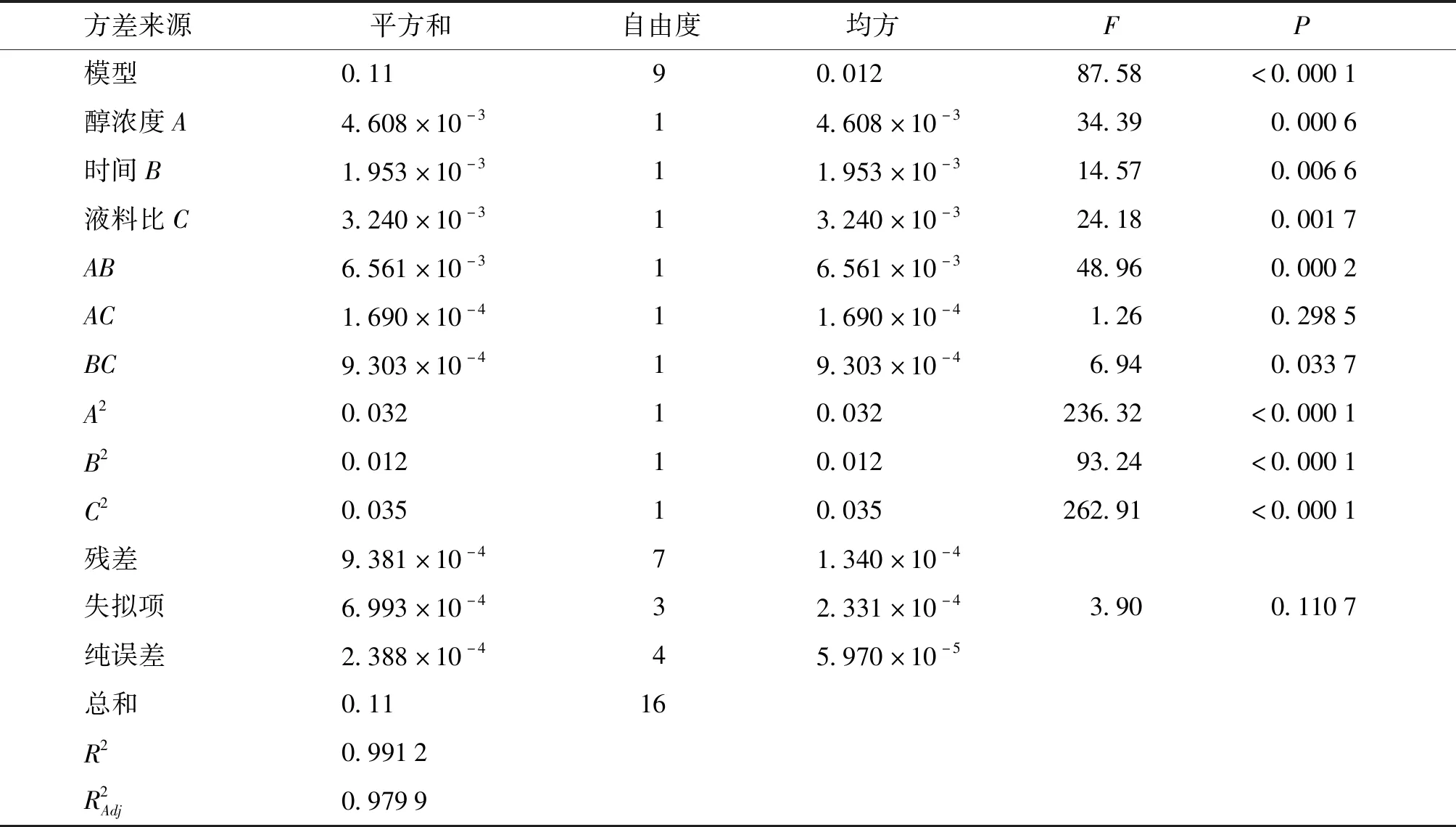
表3 拟合二次多项式模型的方差分析Table 3 ANOVA for the fitted quadratic polynomial model
实验结果表明,紫花地丁总酚酸的最佳提取工艺为:乙醇浓度66.06%,液料比33.84 ml/g,回流提取两次,每次时间122.40 min,在此条件下预测紫花地丁总酚酸的提取率为7.04 mg/g药材。为实验方便,最终确定,紫花地丁总酚酸提取工艺为乙醇浓度66%,液料比34 ml/g,回流提取两次,每次时间120 min。
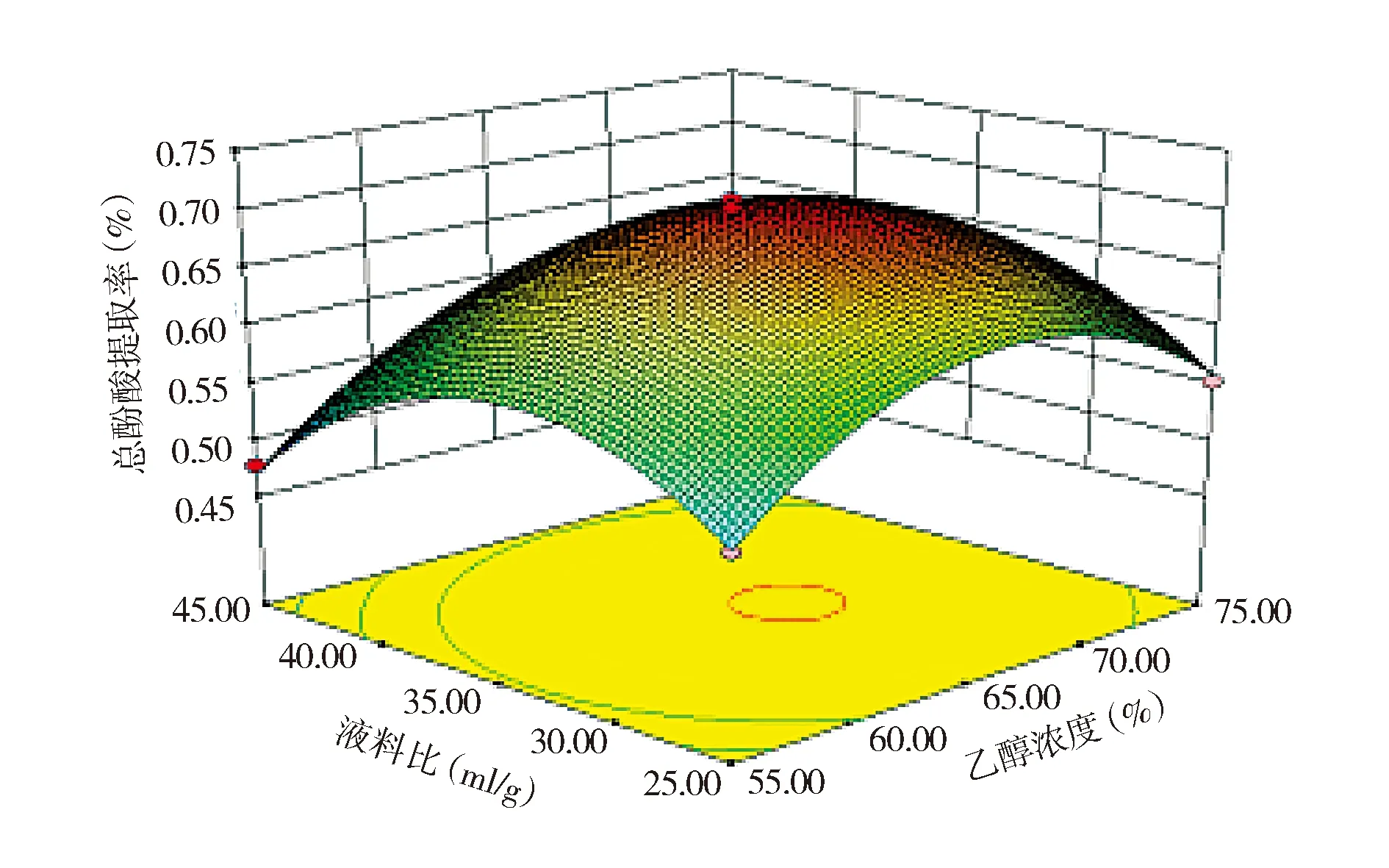
图5 液料比和乙醇浓度对紫花地丁总酚酸提取率的响应面图Figure 5 The contour map and response surface graph of effect ratio of liquid to material and ethanol concentration on extraction yield of total phenolic acids

图6 液料比和提取时间对紫花地丁总酚酸提取率的响应面图Figure 6 The contour map and response surface graph of effect of ratio of liquid to material and reflux time on extraction yield of total phenolic acids
2.11 样品的测定
精密称取脱脂紫花地丁粗粉6份,各1 g,按照响应面法优化的提取工艺,制备提取液,显色并测定吸光度,计算紫花地丁中总酚酸的含量。总酚酸含量分别为7.05,7.01,7.03,7.06,7.02,7.03 mg/g,平均(7.033±0.014 4)mg/g,RSD=0.265%。
2.12 紫花地丁总酚酸对DPPH自由基的清除率
参照文献[15]的方法,分别吸取适量总酚酸提取液,配制成浓度为0,0.1,0.2,0.3,0.4,0.5 mg/ml的待测溶液。分别吸取2 ml待测溶液,与2 ml质量浓度为0.1 mmol/L的DPPH溶液于试管中混匀,室温下在暗处静置30 min后,以维生素C为阳性对照,以无水乙醇作为参比,在517 nm处测定吸光度,用下式计算DPPH自由基抑制率(I):
I=(A0-Ae)/A0×100%。
式中:A0为不加样品的空白吸光度,Ae为加样品后的吸光度。
结果可知,在0.1-0.5 mg/ml的范围内,紫花地丁总酚酸溶液的DPPH自由基清除能力与其质量浓度呈正相关,但均小于80%(见图7)。当总酚酸溶液浓度为0.5 mg/ml时清除率为76.11%,达到最高,其对DPPH自由基的半数清除浓度IC50值为0.254 mg/ml,维生素C酸对DPPH自由基的半数清除浓度IC50值为0.077 mg/ml,说明紫花地丁总酚酸溶液在相同浓度下,对DPPH自由基的清除能力弱于维生素C。

图7 紫花地丁总酚酸及维生素C对DPPH自由基的清除率Figure 7 DPPH free radical scavenging rate of total phenolic acids from Viola philippica and Vc
3 讨论和结论
本文在单因素试验的基础上,将响应面法应用于优化紫花地丁活性成分总酚酸的提取。实验结果表明,乙醇浓度、提取温度、液料比及乙醇浓度、提取温度、液料比平方项对紫花地丁总酚酸提取率的影响显著,并且,各考察因素之间均有交互作用。说明乙醇浓度、提取温度、液料比对紫花地丁总酚酸提取率的影响不是简单的线性关系。以浓度为66%的乙醇,按照液料比34 ml/g,回流提取两次,每次时间120 min为最佳提取工艺,在此条件下,提取的紫花地丁总酚酸的含量为7.033 mg/g,基本与预测含量相吻合。
该提取方法简便易行,稳定可靠,重现性好,可作为紫花地丁总酚酸的提取方法,为紫花地丁作为新药的开发及应用于临床提供了实验基础。
紫花地丁总酚酸提取液对DPPH自由基的半数清除浓度IC50值为0.254 mg/ml,当浓度达到0.5 mg/ml时,对DPPH自由基的清除率接近维生素C的清除率,表明紫花地丁总酚酸提取液具有较好的抗氧化活性,可以为紫花地丁酚酸类化合物的探索研究及进一步开发利用提供理论依据,说明紫花地丁具有一定的开发价值并可能产生一定的经济效益。
