TGF-β1通过调控脂肪酸合酶促进胃癌细胞的迁移及侵袭*
2020-08-11刘勇刚黄俊勇梁基韵李曦罗美华
刘勇刚 黄俊勇 梁基韵 李曦 罗美华
胃癌是消化系统常见的恶性肿瘤之一,中国每年胃癌新发人数约占全球胃癌新发人数的40%以上,全球胃癌死亡率居恶性肿瘤第2 位[1]。由于早期症状隐匿,大部分患者诊断时已属于中晚期,局部浸润及远处转移导致治疗效果及预后较差,5年生存率低于20%[2]。研究表明,异常的脂肪代谢与恶性肿瘤的发生发展密切相关。脂肪酸合酶(fatty acid synthase,FASN)是人体内唯一能在细胞内合成的长链脂肪酸蛋白,属脂质合成的关键酶,是联系脂质合成与肿瘤发生的重要纽带[3]。已有研究证实,FASN 在胃癌中高表达与远处转移及化疗耐药相关[4]。转化生长因子β1(transforming growth factor β1,TGF-β1)认为是在正常生理状态下、癌症以及其他病理状态下诱导上皮间质转化(epithelial-mesenchymal transition,EMT)形成最重要的因子,已证实能促进多种恶性肿瘤的转移[5]。目前,有关TGF-β1 通过影响脂肪代谢途径导致胃癌的发展研究鲜有报道,本研究将探讨TGF-β1 通过调控FASN 对胃癌细胞迁移及侵袭的影响。
1 材料与方法
1.1 材料
1.1.1 病例资料 收集南方医科大学顺德医院2016年1月至2018年12月存档的胃癌手术切除的石蜡标本54例,所有患者术前均未接受放化疗及免疫治疗。
1.1.2 主要试剂 免疫组织化学试剂盒购自上海国源生物技术有限公司,TGF-β1一抗、FASN一抗购自美国CST公司,鼠抗人、兔抗人GAPDH抗体购自北京中杉金桥生物技术有限公司,TGF-β1过表达质粒及空载体对照、siTGF-β1、siFASN及无效对照均购自上海吉玛基因公司。Lipofectamine 3000 转染试剂购自美国Thermo Fisher Scientific 公司,RNA 提取试剂盒、逆转录试剂盒购自日本Takara公司。
1.1.3 实验细胞 所用胃癌细胞系MGC803、BGC823均购自中国科学院上海生物工程研究中心。
1.2 方法
1.2.1 免疫组织化学 将切片依次经过脱蜡、抗原修复、清洗、封闭后,将TGF-β1、FASN 一抗抗体以1:50比例进行4℃冰箱过夜孵育,PBS液清洗3次后,室温进行二抗孵育,30 min之后使用DAB显色,苏木素溶液复染,脱水透明后封片,重复晾干后进行分析。所有染色结果均由两位病理科医师单独评估判定,细胞质及细胞膜呈褐色染色的肿瘤细胞视为阳性。强度评分标准:阴性为0、弱阳性为1 分、阳性为2 分、强阳性为3 分;阳性肿瘤细胞百分比评分标准:1%~50%为1分、51%~75%为2分、≥76%为3分,将每个样本的得分相乘得到最终评分。评分≥6分定义为高表达,评分<6分定义为低表达。
1.2.2 细胞培养及转染 胃癌细胞系MGC803、BGC823均采用含10%胎牛血清的RPMI 1640培养基,在5%CO2、37℃细胞培养箱中常规培养,每2~3天传代1次。取2 mL处于对数生长期细胞种植于6孔细胞培养板(每孔2×103个细胞),正常培养12 h后采用Li⁃pofectamine 3000 将3 μg 的质粒DNA 或者200 pmoL siRNA 转染至细胞内,6 h 后换新鲜培养液继续培养细胞48 h后进行下一步实验。
1.2.3 Western blot 法检测蛋白表达水平 将蛋白样品进行SDSPAGE 凝胶电泳后转移至硝酸纤维素膜,5%牛血清蛋白(BSA)室温封闭1 h 后使用说明书推荐一抗浓度4℃孵育过夜,二抗室温孵育1 h 后ECL发光显示结果。使用Image pro Plus 图像分析软件进行灰度值分析。计算目的因子与内参GAPDH 的灰度值比值,该值代表目的检测因子蛋白的相对表达水平。
1.2.4 Real-time PCR检测基因表达水平 收集转染后48 h的细胞,Trizol法提取细胞总RNA,按照反转录试剂盒说明书操作将RNA反转录成cDNA,取1 μL cDNA采用SYBR Green法进行real-time PCR反应。PCR扩增反应条件为:95℃预变性30 s,95℃5 s,60℃34 s,共40个循环。PCR所用引物序列:FASN:F5'-CGACAGCACCA GCTTCGCCA-3,R5'-CACGCTGGCCTGCAGCTTCT-3';GAPDH:F5'-CGACCACTITGTCAAGCTCA-3',R5'-CC CTGTTGCTGTAGCC-AAAT-3'。
1.2.5 划痕实验检测细胞迁移能力 将生长状态良好的细胞消化后铺于6孔板,转染对照片段及干扰片段24 h 后,用10 μL 枪头均匀划痕,2.5%胎牛血清的RIPM 1640培养基继续培养,并分别于划痕后0、48 h对划痕进行拍照。通过测量残留划痕宽度,比较各组细胞划痕愈合情况,计算划痕修复率。每项实验重复3次。
1.2.6 Transwell 实验检测细胞侵袭能力 采用计数板计数1×105个细胞,用200 μL不含胎牛血清的培养基制成细胞悬液滴入Transwell上室,下室加入600 μL含10%胎牛血清的培养基,于培养箱中孵育48 h,取出、固定、染色,显微镜下随机选取6个视野拍照并计算出侵袭细胞数。每项实验重复3次。
1.3 统计学分析
采用SPSS 20.0软件进行统计学分析。计量资料用表示,采用t检验比较组间差异,应用Pearson correlation 分析TGF-β1 与FASN 在胃癌组织中表达的相关性。以P<0.05为差异具有统计学意义。
2 结果
2.1 TGF-β1、FASN 蛋白在胃癌组织中的表达及相关性
采用免疫组织化学法检测54 例胃癌组织中TGF-β1 及FASN 蛋白的表达情况,将同一胃癌组织进行连续病理切片,发现在TGF-β1 高表达的组织中,FASN 蛋白也呈高表达(图1)。对54 例胃癌组织中TGF-β1 及FASN 蛋白表达进行Pearson 相关性分析(表1)发现,TGF-β1 与FASN 蛋白表达呈正相关(r=0.476,P<0.05)。
2.2 TGF-β1正向调控胃癌细胞内FASN的表达
对人胃癌细胞株BGC823、MGC803 瞬时转染TGF-β1 过表达,采用Western blot 及Real-time PCR分别检测FASN 的蛋白及mRNA 表达情况,发现TGF-β1 过表达后FASN 的表达水平明显升高(P<0.05,图2A、B)。同样,沉默TGF-β1 表达后,细胞内FASN的表达水平明显降低(P<0.05,图2C、D)。
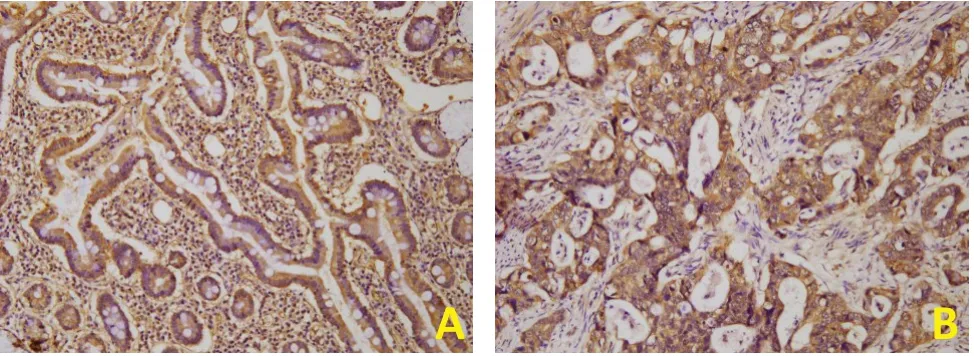
图1 免疫组织化学法检测胃癌组织中TGF-β及FASN的表达情况
2.3 FASN参与TGF-β1介导的胃癌细胞体外迁移及侵袭
胃癌细胞内过表达TGF-β1 能增强细胞的迁移及侵袭能力,而通过瞬时共转染FASN siRNA,West⁃ern blot 验证FASN siRNA 沉默效果(P<0.05,图3A)。共转染FASN siRNA 后,能减弱TGF-β1 引起的Ncadherin蛋白表达、增强E-cadherin蛋白表达,划痕及Transwell 实验显示能明显减弱TGF-β1 所上调的细胞迁移及侵袭能力(P<0.05,图3B),划痕实验显示能明显减弱TGF-β1 所上调的细胞迁移能力(P<0.05,图3C、D),Transwell 实验显示能明显减弱TGF-β1 所上调的细胞侵袭能力(P<0.05,图3E、F)。

表1 TGF-β1与FASN在胃癌组织中表达的相关性 (n=54)
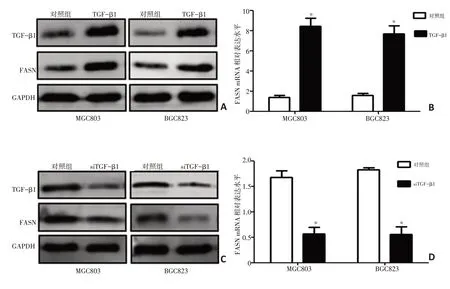
图2 TGF-β1正向调控胃癌细胞内FASN的表达
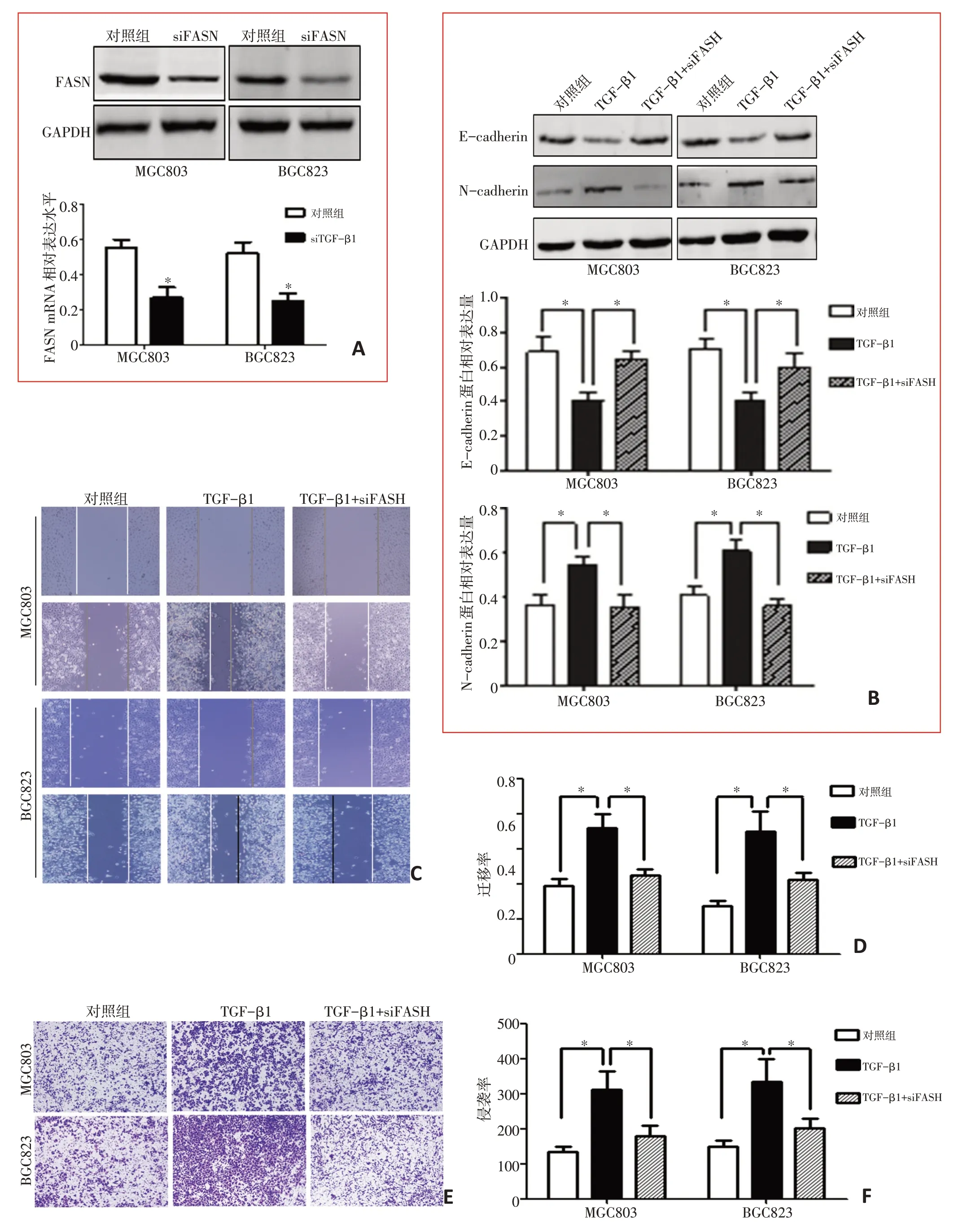
图3 FASN参与TGF-β1介导的胃癌细胞体外迁移及侵袭
3 讨论
胃癌是全球高发病率及高死亡率的消化道恶性肿瘤。近年来,尽管手术及内科治疗方法不断改善,但胃癌的死亡率却居高不下[6]。侵袭转移被认为是胃癌患者预后不良的主要因素之一[7],但其具体机制尚未明确。因此,探究相关的机制并寻找胃癌新的预后分子及治疗靶点具有非常重要的意义。
肿瘤细胞增殖迅速,侵袭及转移能力强,其恶性生物学行为依赖于充足的物质和能量代谢基础。正常生理条件下,脂肪酸主要来源于外源性膳食,可基本满足人体需要。而在肿瘤环境下,外源性脂肪酸无法满足其生长供给,肿瘤细胞即利用内源性脂肪酸进行其结构的生成及能量代谢。其中,FASN 在内源性脂肪酸的合成途径中起关键性的作用,与肿瘤的发生、发展密切相关[8]。对比相应正常组织,FASN在多种人类肿瘤组织中普遍存在表达异常,为肿瘤组织提供充分的内源性脂肪酸,以实现肿瘤的恶性生物学行为。已有研究证明,FASN 在乳腺癌、前列腺癌、黑色素瘤、膀胱癌、肺癌、卵巢癌、结直肠癌、胃癌等多种肿瘤中处于高表达水平,且与患者的不良预后密切相关[9-13]。例如在结直肠癌患者血清中,FASN 水平明显高于健康人群,对其与临床病理特征的相关性分析发现,FASN 可作为评估临床分期及预后的独立预测因子[14]。在乳腺癌患者中,FASN 阳性患者5年无病生存率仅为51.3%,而阴性患者则高达89%。进一步机制研究发现,FASN 能通过PI3k/Akt信号通路促进肿瘤细胞的生长、侵袭及转移[15]。在肾透明细胞癌组织中,分析了48 例肿瘤组织免疫组织化学结果发现,FASN 与缺氧诱导因子-1α(hypox⁃ia-inducible factor-1α,HIF-1α)表达呈正相关,并可促进HIF-1α所介导的肿瘤侵袭作用[16]。在胃癌中,研究者通过分析167 例胃癌组织标本发现,FASN 在胃癌中高表达,能促进肿瘤的复发及转移,与患者的总生存率及复发率密切相关,可能作为预测胃癌转移及生存的重要因子之一[17]。
FASN 作为脂肪酸从头合成唯一的关键酶,已经成为癌症诊断和治疗的一个重要因子。研究还发现,肿瘤的多种恶性特征如转移、抗药性均可由EMT引起,肿瘤EMT 发生的机制研究将为肿瘤的治愈提供新的线索。有研究发现,FASN 能诱导肿瘤细胞EMT 形成并促进其浸润和转移[18]。但是,由于诱导EMT 的多种因子间存在相互作用和反馈调节,并形成了一个复杂的信号网络,寻找有效调控EMT 的方法仍然存在诸多挑战。近年来,越来越多的研究已证实,TGF-β1对中晚期肿瘤的促进作用突出体现在其对,EMT的诱导和促进功能上,进而促进肿瘤的浸润和转移。目前,已知EMT 是在多个细胞内及细胞外信号因子下调控进行的,而TGF-β1已被证明是诱发EMT的一种经典细胞外因子。前期课题组实验已经证实,TGF-β1能通过促进EMT形成并促进胃癌细胞的侵袭及转移[19]。有体外实验发现,相对于正常非小细胞肺癌细胞株(A549P、H157P),在顺铂耐药细胞株(H157CisR)内,FASN 呈高表达,并伴有EMT标志物升高;在小鼠模型中,应用FASN 抑制剂处理后,在耐药株的肿瘤组织中,发现EMT标志物表达水平明显降低;实验证实可能存在FASN-TGF-β1-FASN 正向调控轴,并对非小细胞肺癌的顺铂耐药起到关键作用[20]。
目前,针对肿瘤中TGF-β1 与FASN 的相关性研究比较缺乏,二者的相互作用对胃癌细胞的侵袭及转移的研究鲜见报道。本研究发现,在胃癌组织中TGF-β1与FASN均高表达,经统计学分析,二者呈正相关性。在胃癌细胞株MGC803、BGC823中,使用瞬时转染TGF-β1 过表达或siRNA 沉默后,检测FASN在蛋白及基因水平均出现同向的变化,研究提示,TGF-β1能正向调控FASN的表达。
进一步实验发现,共转染FASN siRNA 后,能减弱TGF-β1引起的N-cadherin 蛋白表达、增强E-cad⁃herin 蛋白表达,划痕及Transwell 实验显示能明显减弱TGF-β1 所上调的细胞迁移及侵袭能力,表明FASN参与TGF-β1介导的胃癌细胞体外迁移及侵袭过程。由此可见,TGF-β1 引起的FASN 表达上调是肿瘤发生EMT 的关键因素之一,从而引起肿瘤细胞的侵袭和转移。二者在细胞内可能通过复杂的信号通路实现相互作用。
综上所述,本研究发现TGF-β1能正向调控胃癌细胞中FASN的表达,且FASN在TGF-β1介导的胃癌细胞迁移及侵袭作用中发挥重要作用。然而,TGF-β1调控FASN表达具体机制尚未明确,有待于进一步的研究阐明。
