儿童急性淋巴细胞白血病并发急性胰腺炎的临床特点分析
2020-08-11
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是儿童最常见的肿瘤,是肿瘤患儿20岁前的最常见死因[1]。1948年开始尝试对于ALL的诱导缓解化疗方案[2],基于患儿临床特点进行危险度分层,给予不同强度的治疗,了解肿瘤细胞生物学特点,多药联合化疗、靶向治疗嵌合抗原受体T细胞免疫疗法(chimeric antigen recepetor T-cell immunotherapy,CAR-T)及造血干细胞移植,逐渐完善的治疗方案使儿童ALL的生存率从20世纪60年代的10%提升至目前的90%[3-4]。急性胰腺炎(acute pancreatitis,AP)是儿童ALL化疗后的并发症之一,多报道与左旋门冬酰胺酶(L-asparaginase,L-ASP)或培门冬酶(polyethylene glycol conjugated asparaginase,PEG-ASP)治疗相关[5]。使用高风险的化疗方案会增加ALL患儿发生胰腺炎的风险,其死亡率亦高于未发生胰腺炎的患儿。
目前,在ALL联合化疗的方案中,PEG-ASP能够提高缓解率及治愈率的作用逐渐得到证实,其应用逐渐得到专家们的认可和重视。具有半衰期长、不良反应小等优点的PEG-ASP也替代了L-ASP。本研究分析11例ALL并发AP患儿的临床特点,以便在临床工作中提升诊疗水平。
1 材料与方法
1.1 病例资料
本研究分析2013年2月至2020年2月天津市儿童医院收治的11 例治疗后出现AP 的ALL 患儿。所有病例均为初治患儿,严格按照骨髓细胞形态学(morphology)、免疫分型(immunology)、细胞遗传学(cytogenetics)和分子生物学(molecular biology)进行MICM[6]分型诊断,并结合治疗效果综合评估危险度。10例患儿采用CCLG-ALL 2008方案联合化疗,1例高危组患儿缓解后巩固治疗参照儿童急性淋巴细胞白血病诊疗规范(2018年版)。全组患儿均接受联合化疗,其中单次PEG-ASP(江苏恒瑞医药股份有限公司,国药准字H20090015)剂量2 000 IU/m2,除2 例放弃治疗,2例死亡,其余7例均具有完整病历资料并长期随访。11 例患儿均符合AP 诊断标准[7],至少符合3项标准中的2项:1)典型临床症状或体征(腹痛、呕吐或肠梗阻);2)血清淀粉酶活性增高≥正常值上限3 倍或脂肪酶高于正常值;3)腹部超声和CT 提示胰腺形态改变(水肿、炎症、出血或坏死),排除其他疾病者。如患儿胰酶水平正常,必须经影像学检査确诊AP。参照《中国急性胰腺炎诊治指南(草案)》,轻型AP 指仅引起轻微的脏器功能紊乱,临床恢复顺利,无明显腹膜炎体征及严重代谢紊乱等临床表现。重症AP诊断标准指具备急性胰腺炎的临床表现和生化改变,且具有下列之一者即可诊断:局部并发症(胰腺坏死、假性囊肿、胰腺脓肿),器官衰竭,Ran⁃son评分≥3分,APACHE-Ⅱ评分≥8分,CT分级D/E。
1.2 方法
整理全组ALL 患儿的危险度分层、出现AP 时所处的治疗阶段及胰腺炎的严重程度分级、PEG-ASP累积用量、主要临床表现及体征,总结胰酶及影像学资料、血糖血脂肝肾功能等生化指标、凝血功能等结果,患儿是否同时伴有其他脏器损害及转归,综合分析病历资料总结出ALL 并发AP 患儿的临床特点。所有患儿家属均知情同意,并签署同意书,本研究申报本院伦理委员会并通过。
2 结果
2.1 临床特征
11例患儿中,男性7例,女性4例,年龄范围1~14岁,中位年龄6岁。急性B淋巴细胞白血病(type B acute lym⁃phoblastic leukemia,B-ALL)10例,急性T细胞型淋巴母细胞白血病(type T acute lymphoblastic leukemia,T-ALL)1例。危险度分层:低危6例,中危4例,高危1 例。初始联合化疗开始45 天内发病8 例,高危患儿第二循环HR3'化疗后发病1例,延迟强化化疗后发病2例,PEGASP 治疗后发病10 例,T-ALL 伴肿瘤溶解综合征予环磷酰胺+塞米松减积治疗后发病1例。胰腺炎严重程度分级:重症4 例,其中胰腺假囊肿形成3 例,Ranson评分≥3分1例,轻型7例。PEG-ASP累积用量为0的1例,4 000 IU/m26例,6 000 IU/m21例,10 000 IU/m22例(均为2次发病,首次发病时累积量4 000 IU/m2),16 000 IU/m21例。11例患儿主要表现为腹痛、恶心、呕吐。
2.2 辅助检查
11例患儿均伴有胰酶升高。影像学检查B超均提示胰腺增大,密度欠均匀,其中伴有胰腺周围积液4例,伴有胰腺假囊肿3例。由于患儿多处于化疗后骨髓抑制期,需保护性隔离,故仅4例患儿完善腹部CT检查,均提示胰腺增大,密度不均匀。低钙血症8例,白蛋白水平下降9例,凝血功能异常8例,主要表现为纤维蛋白原降低和部分活化凝血活酶时间延长。肝功能异常6例,高血糖3例,甘油三酯升高2例,肾功能受损1例,考虑为肿瘤溶解综合征的表现(表1)。
2.3 并发症及转归
并发症主要包括感染,其中3 例血流感染,分别为大肠埃希菌、肺炎链球菌、铜绿假单胞菌;深部真菌感染1 例;高血糖2 例,应用胰岛素治疗1 例,对症支持治疗血糖恢复1 例;低钙血症8 例,予葡萄糖酸钙静点及治疗原发病后较快纠正。5 例患儿首次发病治愈后再次接受PEG-ASP 治疗未再发生胰腺炎,其中1 例在延迟强化治疗阶段死于铜绿假单胞菌感染所致脓毒症、感染性休克;1 例在巩固治疗阶段因深部真菌感染、感染性休克及多脏器功能衰竭抢救无效死亡;2例患儿发生两次胰腺炎;3例患儿出现胰腺假囊肿,胰腺假囊肿胀形成时间分别为22 天、17天、25天,其中1例为第2次胰腺炎,均外科手术引流治疗,1例引流术后已恢复化疗尚未拔引流管,1例因合并中枢神经系统白血病、呼吸循环衰竭抢救无效死亡,1 例因慢性胰腺炎多个胰腺假囊肿延迟化疗5个月,后白血病复发放弃治疗;2例伴消化道出血,均为危重症终末期伴有凝血机制障碍不除外弥漫性血管内凝血患儿。
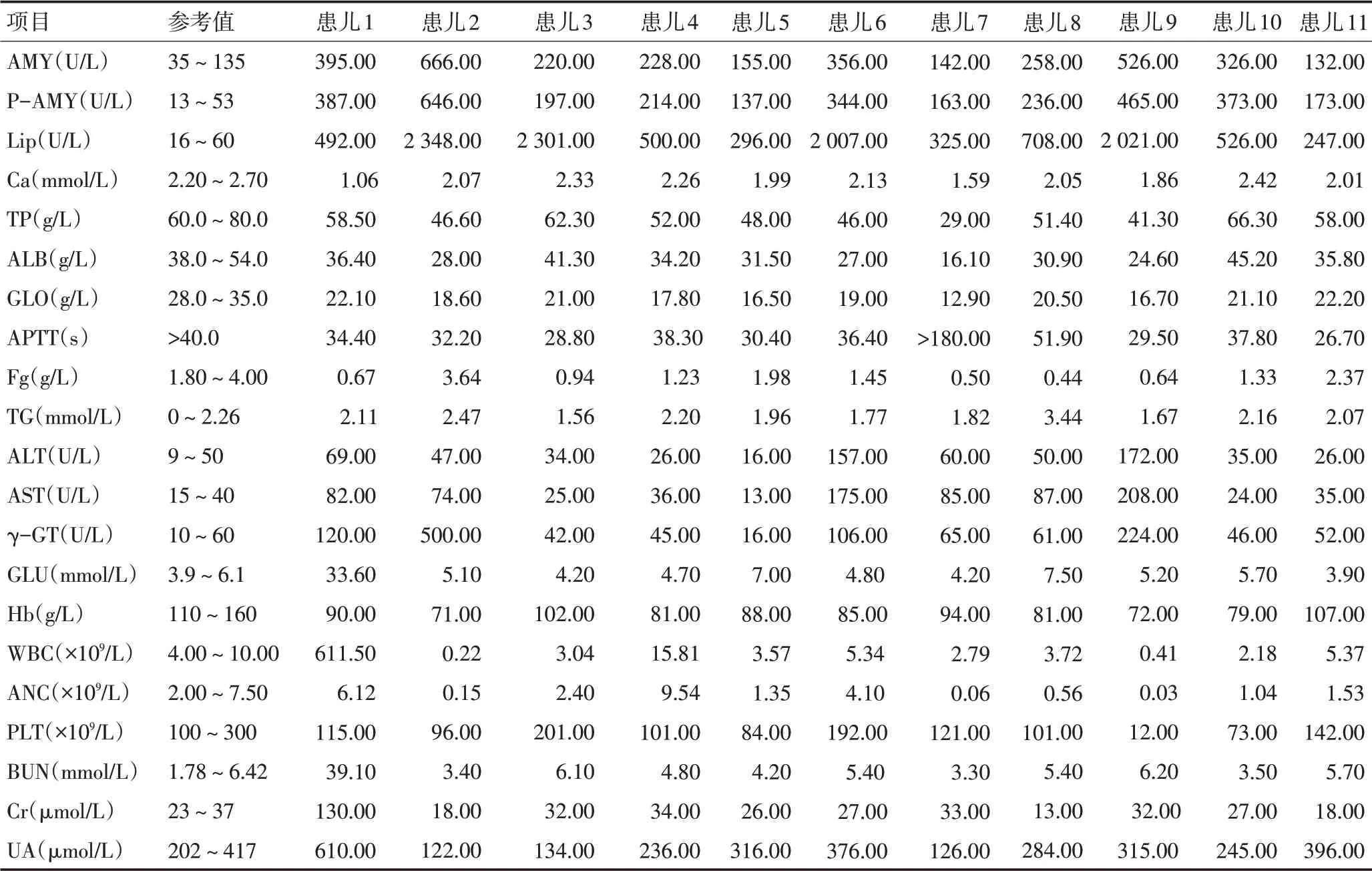
表1 合并AP的儿童ALL患儿部分临床化验指标
3 讨论
ALL 是儿童最常见的血液系统肿瘤[8]。随着细胞遗传学分子生物学研究领域的进步、化疗方案的不断改进,加之靶向治疗、CAR-T及造血干细胞移植等越来越多的治疗手段,儿童ALL 的治愈率已接近100%,尤其是危险度为低危和中危的患儿。近年来,专家们开始致力于在不影响疗效的前提下如何调整治疗方案以最大限度地降低药物毒性,如使用右雷佐生降低蒽环类抗生素对心肌的损伤[9]、研究PEGASP的个体化治疗等。
儿童ALL 并发胰腺炎是较常见且严重的治疗相关并发症,多由药物引起,如PEG-ASP、L-ASP 和糖皮质激素,其中以PEG-ASP相关最常见,发病率约为6.7%~18.0%[10]。PEG-ASP 是一种对于门冬酰胺酶进行聚乙二醇化学偶联修饰后的新型门冬酰胺酶,半衰期是L-ASP 的4~6 倍且无速发性免疫过敏反应[11]。门冬酰胺酶诱导胰腺炎的机制尚未明确,但从根本上不同于其对ALL 中肿瘤细胞的治疗作用。门冬酰胺酶对肿瘤细胞的治疗作用依赖于门冬酰胺的消耗[12],与正常细胞相比,恶性细胞无法合成门冬酰胺,而门冬酰胺酶引起的胰腺炎的副作用则归因于信号转导机制的激活,包括蛋白酶活化受体(PAR2)、细胞内信使三磷酸肌醇(IP 3)和烟酸酰胺腺嘌呤二核苷酸磷酸(NAADP)以及细胞内IP 3 受体、兰尼碱受体(RYRS)和两孔阳离子通道(TPCS)等。与其他胰腺炎诱导剂一样,门冬酰胺酶引起细胞内钙离子(Ca2+)的释放,随后大量Ca2+入胞,由于细胞内线粒体三磷酸腺苷(ATP)水平的降低,大幅减少了Ca2+的出胞。过多Ca2+激活下游信号通路所致的细胞毒性作用引起广泛的细胞组织坏死。因此,门冬酰胺酶对胰腺的作用与门冬酰胺耗竭与否无关[13]。临床很难预先判定有患病风险因素的患儿,治疗方面以对症支持治疗为主[14]。诸多为轻症病例,重症少见,且重症胰腺炎不建议再接受PEG-ASP治疗。
AP是胰腺的突发炎症,导致胰腺内酶的活化造成自身腺体的消化和炎症,具有广泛的临床特征,从轻症和自限性病程到重症病历,甚至发展为多脏器功能衰竭或死亡[15]。本研究中,11例患儿均伴有腹痛、恶心、呕吐表现,胰酶及脂肪酶水平明显升高,影像学提示胰腺肿大或伴胰周积液,甚至有假囊肿形成,其中10例继发于PEG-ASP治疗后,累积用量4 000~16 000 IU/m2,8例为初始化疗期间发病。除上述表现外,伴随有低白蛋白血症、低钙血症、凝血功能异常、高甘油三酯血症及高血糖等表现。
本研究显示,PEG-ASP 剂量与是否发生胰腺炎无关,目前国内外文献鲜见对此问题进行深入探讨。与文献报道相似的是,多数病例发生在治疗初始阶段,认为可能与患儿基础状态较差,且联合化疗初期有糖皮质激素等可能导致胰腺炎的因素有关。糖皮质激素诱发胰腺炎,尤其应提起注意。本研究中1 例T-ALL 患儿,是唯一未使用PEG-ASP 即发生胰腺炎的病例,其在合并高白细胞血症、应用环磷酰胺加地塞米松减积治疗期间出现肿瘤溶解综合征时发生的急性胰腺炎。本研究组曾考虑是否肿瘤溶解或环磷酰胺诱发胰腺炎,但国内外文献鲜见相关报道,经综合考量,认为糖皮质激素诱发者可能性最大。因此对于病因的分析仍有很多问题可以探讨,计划进一步收集病例,进行病历对照研究分析病因。
由于门冬酰胺酶制剂在儿童ALL 治疗中的重要地位,即使发生相关的胰腺炎也不能完全摒弃应用。一项包含1~45岁患者的大样本研究指出,仅对于预期有白血病复发高风险的患儿考虑再次使用门冬酰胺酶,因为多项研究表明降低门冬酰胺酶治疗强度会增加复发风险[16]。
治疗及预后方面,本研究中所有患儿均给予禁食、抑制腺体分泌、抑酸、胃肠道外营养等治疗,禁食时间长短依据病情轻重及影像学变化有所不同。随着对疾病的认识加深及诊疗水平的提升,临床工作中对病情危险度的评估及各项化验指标的监测频度有了更加丰富的经验,延长随诊时间,个体化用药,提高早期确诊率,有助于指导后期用药及改善预后。
综上所述,AP 是儿童ALL 治疗过程中常见的不良反应,多为门冬酰胺酶治疗相关并发症,糖皮质激素亦可诱发本病,联合化疗早期发病为主,病情轻重不一,重症患儿不建议再接受门冬酰胺酶治疗,监测各项化验指标及影像学检查有助于评估病情,指导后期用药。
