阿来替尼治疗ALK基因融合重排NSCLC脑转移瘤的临床疗效分析
2020-08-11
约2%~7%非小细胞肺癌(non-small cell lung cancer,NSCLC)患者会发生ALK基因融合重排[1]。与ALK基因无融合重排相比,ALK基因融合重排的NSCLC患者更容易出现脑转移[2-3]。一项回顾性研究表明,ALK阳性NSCLC患者的2年及3年累积脑转移发病率分别为45.5%和58.4%[4]。克唑替尼是第一代ALK抑制剂,对于ALK基因融合重排的晚期NSCLC患者,疗效明显优于化疗,但对基线有脑转移的患者临床效果不佳[5]。近年来,一项ALEX Ⅲ期研究报道[2,6],阿来替尼用于晚期ALK阳性NSCLC患者的一线治疗时,显示出了良好的疗效,中位无进展生存期(median progression-free survival,mPFS)高达34.8个月。2018年美国国立综合癌症网络(NCCN)推荐阿来替尼作为ALK阳性NSCLC患者的一线治疗药物[7]。但对于基线脑转移阳性的NSCLC患者,阿来替尼疗效的临床研究及报道较少。本研究回顾性分析了2016年8月至2019年10月天津医科大学肿瘤医院收治的34例ALK基因融合重排且伴有脑转移的NSCLC患者资料,旨在分析阿来替尼单药在ALK阳性NSCLC脑转移患者治疗中的临床疗效及不良反应。
1 材料与方法
1.1 病例资料
分析2016年8月至2019年10月天津医科大学肿瘤医院收治的存在EML4-ALK基因融合重排且伴有脑转移的NSCLC 患者34 例,其中接受阿来替尼的单药治疗的患者13例(38.2%),中位年龄51(35~72)岁,男性7例(53.8%),女性6例(46.2%),共19个脑转移瘤病灶(表1)。
纳入标准:1)原发灶或转移灶取得组织并通过病理学诊断确诊为NSCLC,采用免疫荧光原位杂交法检测为ALK基因阳性,头颅核磁显示可测量转移病灶1~3个;2)接受过至少2个月的阿来替尼治疗(600 mg,bid);3)未接受过化疗及其他酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)药物治疗;4)根据实体瘤疗效评价标准(RECIST 1.1),至少含1个可测量病灶。
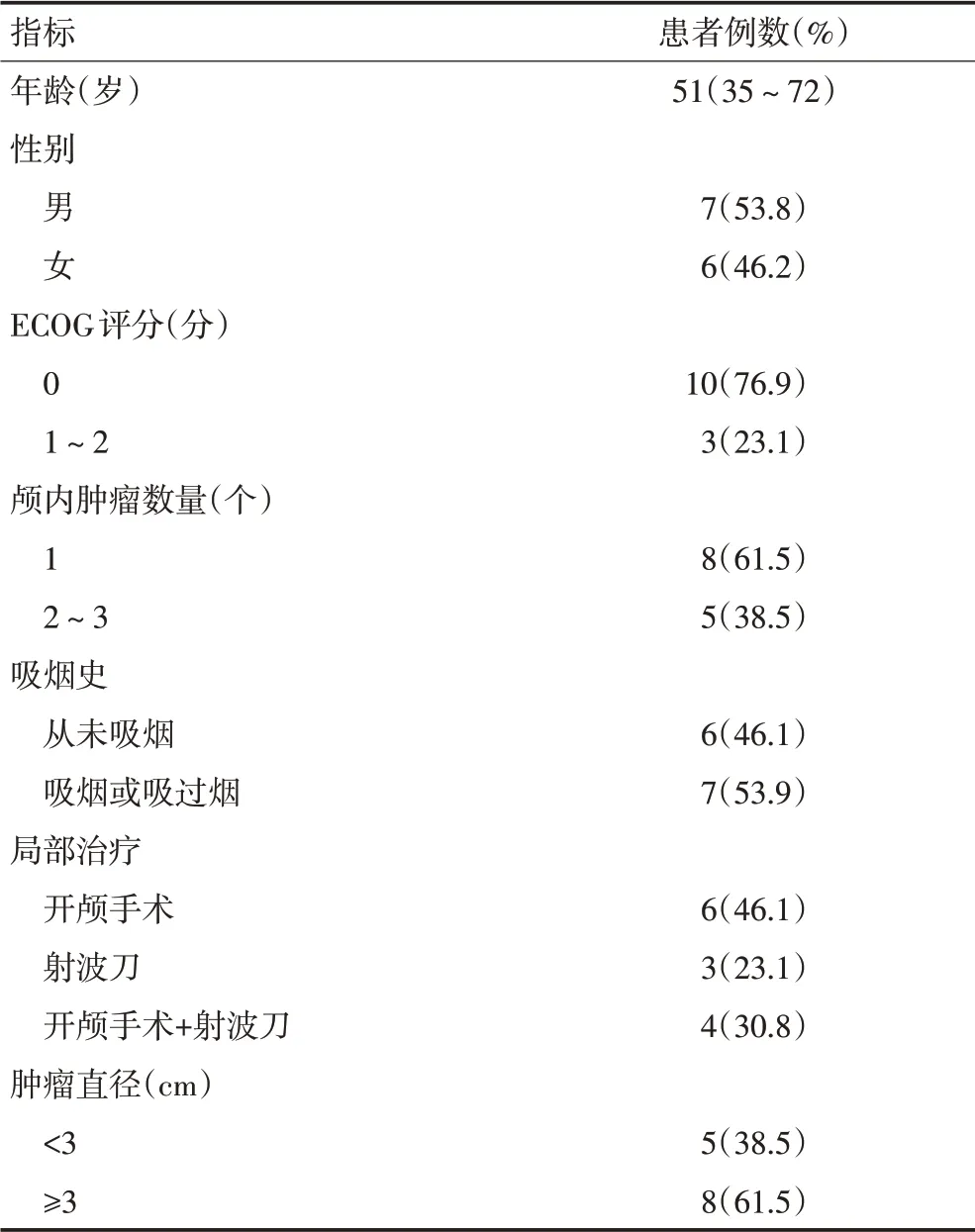
表1 患者临床特征
排除标准:1)曾确诊或接受治疗过其他恶性肿瘤;2)既往神经或精神病史;3)存在严重呼吸、心血管和肝肾疾病。
1.2 治疗方法
1.2.1 开颅手术治疗 手术标准:颅内单发肿瘤病变直径>3 cm、颅外无法获得病理诊断、颅内可测量病灶中同时有1~3个责任病灶。治疗前完成相关检查(血常规、肝肾功能、凝血功能、肿瘤标志物和心肺功能等),并对患者的一般状态进行评估,无手术禁忌证者可行开颅手术治疗。术后行病理组织学检查及基因检测。
1.2.2 经皮肺部肿瘤穿刺术 颅内病灶较小且无高颅压症状的患者,需在CT定位引导下,经皮穿刺肺部肿瘤,获得病变组织并行病理组织学检查及基因检测。
1.2.3 射波刀治疗 对未行手术切除的颅内转移病灶给予射波刀放射外科治疗(Cyberknife stereotactic ra⁃diosurgery,CK-SRS)。所有患者治疗前行强化MRI扫描(T1,层厚1.2 mm)和强化CT扫描(层厚1.5 mm)。肿瘤体积定义为强化MRI或强化CT显示的强化病灶体积,在CT和MRI图像融合后勾画GTV,计划治疗体积定义为GTV外放1.6 mm,并勾画脑干、晶状体、视交叉等重要危及器官。治疗计划由Multi Plan 4.6.0软件完成。治疗时所有患者均由面网固定,采用颅骨追踪方式进行定位。
1.2.4 阿来替尼靶向治疗 病变组织病理或基因检测结果明确ALK基因融合重排后即开始口服阿来替尼(600 mg,bid),直至出现不可耐受不良反应或颅内疾病进展。
1.2.5 疗效评价及不良反应评估 采用实体瘤疗效评价标准(RECIST 1.1)。疗效评估结果包括完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)及疾病进展(progressive disease,PD)。服用阿来替尼治疗后每2~3个月随访1次,每隔3个月行头部MRI强化检查,肿瘤控制定义为治疗后定期复查头MRI未发现病变体积明显增大或无新发病灶。颅内病灶进展定义为颅内病灶体积增大或颅内出现新发病灶。客观缓解率(objective response rate,ORR)定义为达到CR 和PR 的患者比例,疾病控制率(disease control rate,DCR)定义为达到CR、PR和SD的患者比例。
不良反应的评估指标包括肝肾功能变化、血常规变化、胃肠道反应情况、皮肤出现皮疹溃疡等情况,以及神经功能障碍。
1.2.6 随访 随访日期截至2019年10月1日,颅内无进展生存期(progression-free survival,PFS)定义为阿来替尼一线治疗开始至颅内病灶进展或死亡的时间。
1.3 统计学分析
采用SPSS 25.0软件进行统计学分析。颅内mPFS采用Kaplan-Meier法计算,组间差异采用Log-rank分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 随访情况
截至2019年10月1日,中位随访时间为24.5(18.5~36)个月,全部患者生存,随访率100%。
2.2 治疗情况
局部治疗:13例患者均以脑转移为首发诊断。其中6例(46.2%)为颅内单发病灶合并明显神经功能症状或高颅压症状,行开颅手术治疗;3例(23.1%)颅内病灶体积较小,行肺部肿瘤穿刺术明确病理后,颅内病灶行CK-SRS;4例(30.8%)为颅内多发转移灶同时合并明显的神经功能症状或高颅压症状,行开颅手术将颅内责任病灶切除后,颅内其余的小病灶行CK-SRS。
靶向治疗:全部患者口服阿来替尼(600 mg,bid)单药治疗,服药时间均≥18.5个月。
2.3 生存情况及疗效评价
截至随访时间,颅内mPFS 为24.5 个月(95%CI:19.803~29.197),图1为所有患者的Kaplan-Meier 生存曲线。颅内肿瘤疗效评价:13例中7例可以评价,7例CR,颅内ORR 为100%,颅内DCR 为100%。第1年无病例进展,第2年出现颅内进展者5例,第3年出现颅内进展者8例。1年的颅内累积发病率为0,2年的颅内累积发病率为38.5%。单因素分析发现,患者的性别、年龄、吸烟史、美国东部肿瘤协作组(ECOG)评分、颅内病灶数量、肿瘤最大直径及局部治疗方式与患者的颅内PFS无显著相关性(表2)。由于病例数较少,故不能对接受靶向治疗的基线有脑转移的ALK阳性NSCLC患者进行多因素分析。

图1 患者颅内PFS
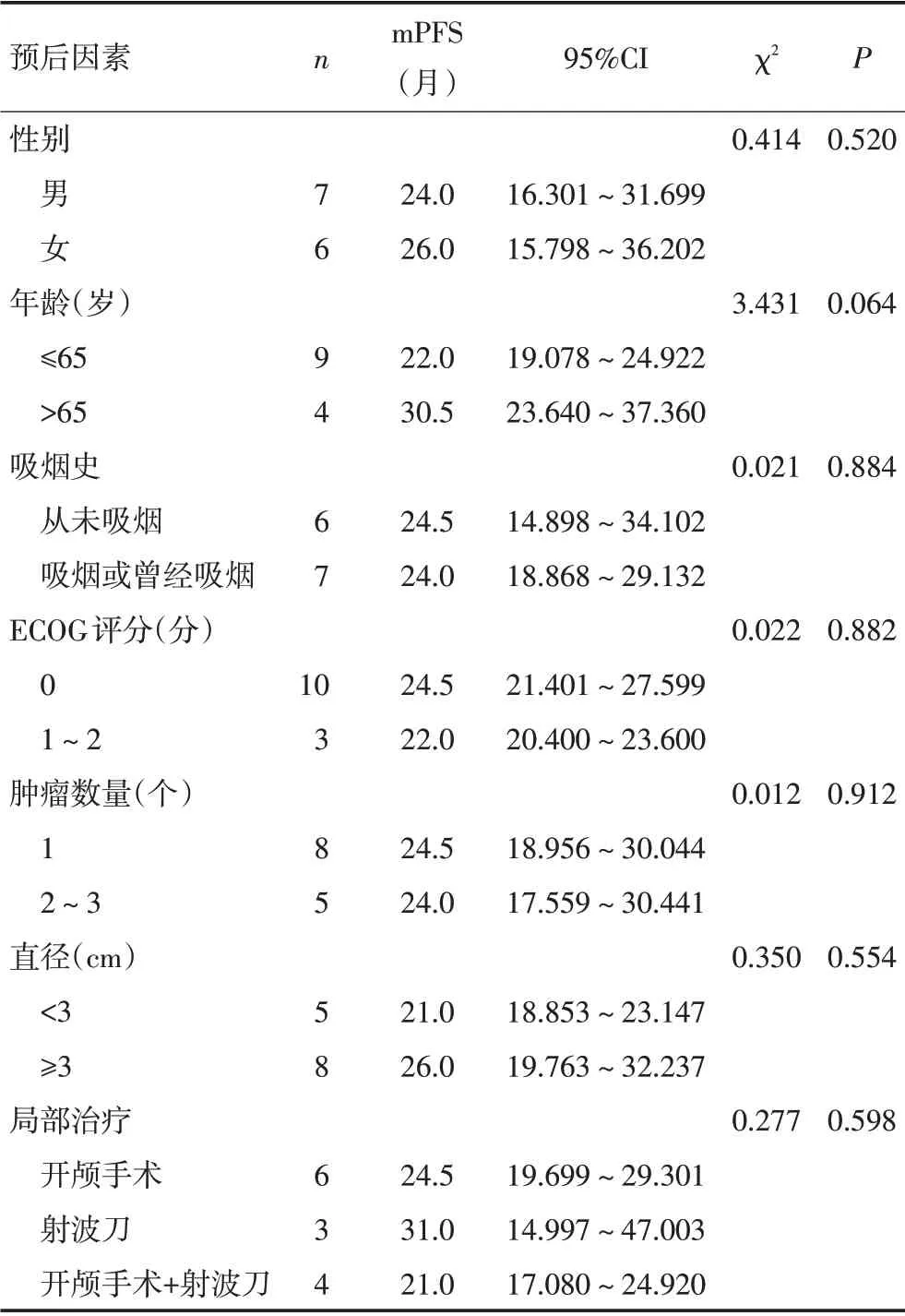
表2 ALK阳性NSCLC脑转移患者预后的单因素分析
2.4 不良反应
不良反应评估显示患者对药物的耐受性较好。最常见的不良反应为转氨酶升高、血肌酐磷酸激酶升高、轻度视觉模糊以及胃肠道的反应。其中Ⅲ级不良反应2 例,Ⅳ级不良反应1 例,分别为转氨酶升高、血肌酐磷酸激酶升高及皮疹,给予对症治疗后明显好转,继续服药(表3)。
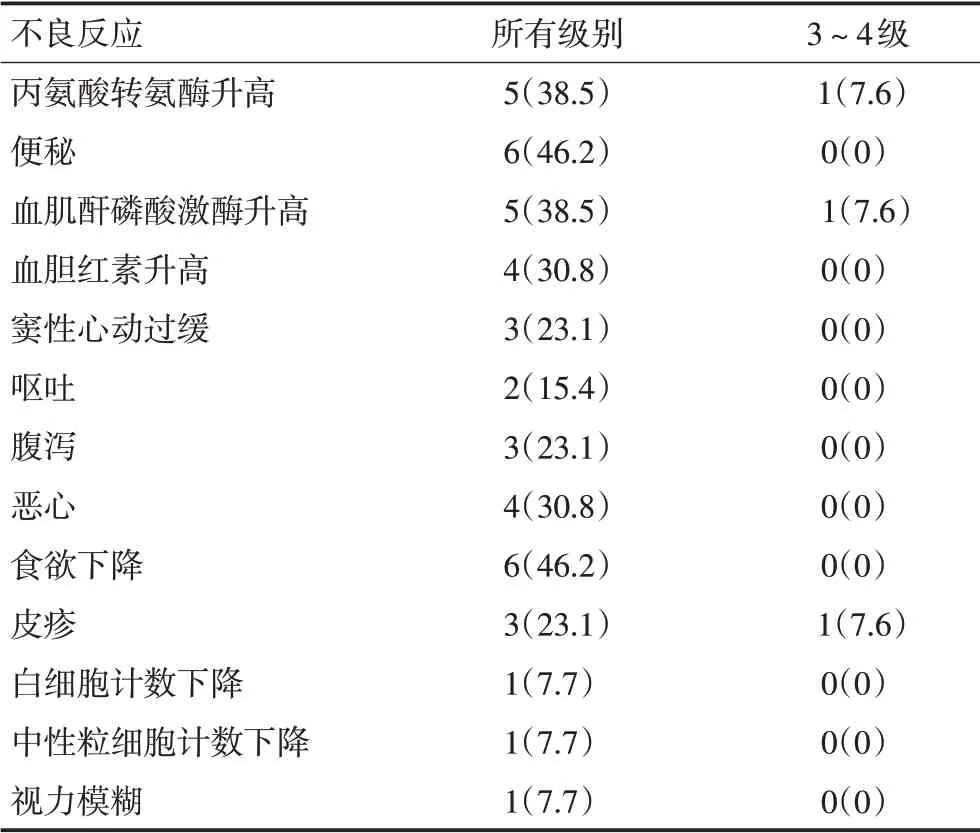
表3 不良反应 例(%)
2.5 脑转移进展后的治疗
随访结束时本组13 例患者均出现颅内进展,其中4 例患者未做进一步治疗,其余9 例患者行CKSRS 或全颅放疗,其中4 例给予培美曲塞及卡铂化疗,同时继续联合阿来替尼靶向治疗,5 例患者增加阿来替尼剂量,截至随访结束全部生存。
3 讨论
ALK基因融合重排的晚期NSCLC的特点包括患者发病年龄轻、易发生脑转移和预后差,约15%~35%ALK阳性NSCLC患者诊断时存在中枢神经系统(central nervous system,CNS)转移[8-9]。基线存在CNS转移是ALK阳性NSCLC患者的不良预后因素[10]。克唑替尼是第一代ALK-TKI,一项回顾性研究结果表明,在治疗基线无脑转移的NSCLC 患者中,20%患者会出现脑转移,在NSCLC 脑转移患者接受颅内局部治疗后再接受克唑替尼治疗的患者中,72%患者会出现CNS病灶的第二次进展;109例基线有脑转移的肺癌患者接受克唑替尼治疗后的ORR 仅18%[5]。这一现象可能与克唑替尼的血脑屏障渗透率低有关[11-13]。塞瑞替尼是第二代ALK-TKI,ASCEND-4研究结果提示,对于基线存在脑转移的患者,塞瑞替尼组与化疗组的颅内病灶ORR分别为72.7%和27.3%,mPFS 分别为10.7 个月和6.6 个月(HR=0.70,95%CI:0.44~1.12)[14]。虽然对颅内转移瘤具有一定治疗效果,但是由于血脑屏障中P-糖蛋白(P-glycoprotein,P-gP)的存在,塞瑞替尼的血浆-脑渗透率较低,导致脑内的塞瑞替尼浓度无法达到控制疾病所需的暴露量[15]。在接受塞瑞替尼治疗后疾病进展的ALK阳性NSCLC患者中,42%以CNS转移为首发症状[14]。
与克唑替尼相比,阿来替尼在ALK 阳性NSCLC的治疗中有更好的疗效和更低的不良反应率[2],并且不同于克唑替尼及塞瑞替尼,阿来替尼并非P-gP 的底物,可以穿过血脑屏障,因此脑脊液中的药物浓度较高[16]。Shaw 等[17]研究报道,阿来替尼治疗克唑替尼耐药的NSCLC 患者,mPFS 为8.1 个月(95%CI:6.2~12.6),1年总生存率(overall survival,OS)为71%(95%CI:61~81)。近期,ALEX 研究报道[6],作为基线存在CNS 转移患者的一线治疗,阿来替尼组颅内mPFS 高达27.7 个月(95%CI:9.2~NE),克唑替尼组仅为7.4个月(95%CI:6.6~9.6)。本研究病例研究结果提示,至随访结束13例患者均出现颅内进展,阿来替尼单药治疗的颅内mPFS 为24.5 个月,略小于AL⁃EXⅢ研究的结果,可能与本研究样本量较少有关,随着病例数的增加及随访时间的延长,可能会提高颅内PFS。但是对比接受塞瑞替尼治疗后的颅内mPFS仅为10.7 个月[14],24.5 个月的颅内mPFS 已使患者明显获益。
目前,对于驱动基因阳性NSCLC 患者若出现颅内转移瘤,应先行放疗还是靶向治疗仍未达成共识。Gadgeel 等[18]研究发现,基线存在脑转移瘤的患者接受放疗后再行阿来替尼靶向治疗,mPFS>11 个月(11 个月~NR),1年累积发病率为8.6%(95%CI:1.4~24.4),而不接受放疗患者的mPFS仅为14个月,1年累积发病率为20.5%(95%CI:9.5~34.4),提示先放疗再行靶向治疗可能会延长患者PFS 并降低颅内肿瘤进展的风险。本研究病例颅内可测量病灶得到局部治疗(手术及SRS)的基础上,口服阿来替尼单药靶向治疗,颅内1年累积发病率为0(0/13),2年累积发病率为38.5%(5/13),提示阿来替尼可以降低颅内肿瘤进展的风险。
根据ALEX 研究的结果,阿来替尼3~4 级不良反应的发生率为32%,克唑替尼组为56.7%。阿来替尼常见的不良反应为转氨酶升高、便秘、消化道反应等,严重的不良反应较为少见,提示阿来替尼安全性显著优于克唑替尼。本研究患者表现出较好的药物耐受性,针对3~4级不良反应,给予对症治疗后症状消失,无患者因为不良反应而停药。
综上所述,本研究回顾性分析提示在颅内可测量病灶得到局部治疗后,阿来替尼作为ALK 基因融合重排NSCLC 脑转移的一线治疗效果明显,颅内累积发生率较低,明显延长患者的颅内PFS,OS结果值得期待,不良反应较轻,患者耐受性较好。本研究不足之处在于样本量较小,随访时间相对较短,截至随访日期尚无完整的OS 数据。未来,将设立临床同期病例作为对照进行队列研究,如将单纯手术切除、单纯放射治疗或联合上述两种方案处理局部病灶作为对照组,以同期局部治疗后采用阿来替尼进行治疗病例为治疗组,对比两组mPFS 差异,所得结论作为提升阿来替尼作为一线药物治疗ALK阳性肺癌脑转移的循证医学证据,将更具说服力。
