术前MR影像特征对肝细胞癌手术切除术后早期复发的预测价值
2020-08-11
肝细胞癌(hepatocellular carcinoma,HCC)在世界常见恶性肿瘤中位居第6 位,其致死率高居第3位[1]。手术切除术为肝功能良好HCC 患者的首选治疗方案[2-3],然而早期复发占肝癌复发的70%以上,严重影响患者预后[4-5]。有研究表明肿瘤相关因素,如多灶性、分化差、微血管侵犯等是HCC早期复发的危险因素[6-7],但需要进行术后组织病理学评估。MRI作为一种无创的影像学检查广泛应用于肝癌的诊断,但用于预测肝癌早期复发的研究较少。本研究旨在探究依据术前临床资料及MR 影像特征预测HCC手术切除术后早期复发的可能性。
1 材料与方法
1.1 病例资料
1.1.1 研究对象 回顾性分析2015年1月至2018年1月间在天津医科大学肿瘤医院行手术切除的244例HCC患者的资料。其中男性204例,女40例,年龄范围23~86 岁,中位年龄58 岁。入组标准:1)手术病理证实为HCC;2)切除术前1个月内在本院进行MRI增强检查;3)术后2年内规律随访影像学检查(超声、CT、MRI 等)及实验室检查。排除标准:1)术前有过HCC治疗史;2)术后有辅助治疗及肝外转移;3)随访期内患者死于其他疾病。
1.1.2 随访 所有患者出院后均规律随访,患者术后前6 个月每月复查1 次,以后每3~6 个月复查1次,门诊常规行血清AFP 等肿瘤标志物及腹部超声检查,每3~6 个月进行1 次CT 或MRI 检查。随访终点事件为术后2年内肝内复发,如果未复发则至少随访2年。早期复发定义:HCC患者手术切除术后2年内通过超声、CT、MRI、肝动脉造影等影像学检查发现的复发性病灶,如影像学证据不足,则进一步行穿刺或手术进行病理检查。
1.2 方法
1.2.1 MRI 检查 检查设备采用GE Signa 1.5T 超导型磁共振成像系统和腹部相控阵线圈。患者屏气扫描,各扫描参数如下:1)正、反相位T1WI(TR140~170 ms,TE 同相位4.2 ms,反相位1.8 ms);抑脂T2WI(TR 7 059 ms,TE 80 ms),矩阵128×128 或320×160,视野(FOV)40 cm×34 cm,层厚7 mm,间隔1 mm;2)DWI检查采用单次激发自旋回波平面成像序列(SEEPI)序列,b 值取800 s/mm2,同时在X、Y、Z 轴3 个方向上施加敏感梯度脉冲,TR 4 000 ms,TE 56.6 ms,矩阵128×128,FOV38 cm×34.2 cm,层厚8 mm,间隔1 mm;3)最后行常规肝脏三维容积多期动态增强成像(LAVA),对比剂为Gd-DTPA,剂量0.1 mmol/kg。
1.2.2 临床资料 临床资料包括年龄、性别、肝炎情况、肝硬化、腹水、TNM分期、Child-Pugh分级、丙氨酸氨基转移酶(ALT)、谷氨酸氨基转移酶(AST)、总胆红素(TBIL)、直接胆红素(DBIL)、白蛋白(ALB)等常规肝肾功能检查及肿瘤标志物甲胎蛋白(AFP)。
1.2.3 影像资料分析 由2名影像诊断医师(分别有3年、8年工作经验)在本院影像归档和通信系统(pic⁃ture archiving and communication system,PACS)上对图像进行独立分析,2 名医生知晓所有病例均为HCC,但对术后随访情况不知。对于多发病灶,以最大肿瘤为研究对象。当两名医生对肝癌MR 影像特征判断结果不一致时,讨论达成一致。
MR 影像特征如下:1)肿瘤大小:肿瘤最大层面长径,分为≤5 cm 和>5 cm 组;2)肿瘤多灶性:分为单个或多个;3)肿瘤边缘:在抑脂T2WI 和动态增强延迟期的轴位、冠状位图像上评估,分为光滑和不光滑;4)肿瘤包膜:动脉期呈包绕肿瘤的低信号环,在延迟期呈高信号,分为完整、不完整;5)瘤周肝实质强化:动脉期肿瘤周围出现各种形态的强化区域,延迟期呈等信号,分为有或无;6)环形强化:动脉期肿瘤边缘存在不规则的环形强化区域,肿瘤中央区相对少血供呈稍低信号;7)TTPVI:肿瘤内小动脉且不伴有周边连续低信号环,动脉期评估肿瘤内小动脉、门脉期或延迟期评估肿瘤边缘低信号环,分为有或无;8)瘤内坏死:肿瘤内部缺血坏死,T1WI呈低信号,T2WI 呈高信号;9)瘤内出血:肿瘤内部血管破裂出血,一般T1WI呈高信号;10)卫星灶:具有相似MR影像特征且<2 cm 的病灶,位于主病灶周围2 cm 以内,分为有或无;11)动态增强模式:典型特征为动脉期流入,门脉期、延迟期流出;不典型特征为肿瘤少血供,门脉及延迟期无流出;12)DWI/T2WI 图像不匹配:DWI 图像上肿瘤直径大于T2WI图像上肿瘤直径或DWI图像上不匹配区域信号强度低于肿瘤但高于肝实质信号。
1.3 统计学分析
采用SPSS 23.0软件进行统计学分析。分类变量采用χ2检验及Fisher精确检验,连续变量则采用t检验或Mann-Whitney U检验。使用Kaplan-Meier法进行单因素生存分析并使用Log-rank法进行显著性检验。单因素Cox 比例风险回归模型对各因素的风险比(hazard ratios,HRs)进行计算;将单因素分析中具有统计学差异的特征纳入多因素Cox比例风险回归模型进行分析。根据Cox回归结果,使用R软件版本3.6.2“rms”包绘制诺模图。诺模图其本质是Logistic或Cox回归方程的可视化,每个自变量根据其权重取值、评分,相加得出总分,再根据转换函数计算患者发生早期复发的概率。使用GraphPad Prism 8.0.2软件绘制生存曲线。以P<0.05为差异具有统计学意义。
2 结果
2.1 临床资料
无早期复发患者134例,早期复发患者110例(早期复发率45.1%),其中半年复发患者24例(半年复发率9.8%),1年复发患者55例(1年复发率22.5%)。无早期复发组中位随访时间24个月,早期复发组中位随访时间11.5个月。单因素分析显示TNM分期、ALT、AST、DBIL、γ-GT、AFP等在两组之间的差异具有统计学意义(P<0.05)。年龄、性别、肝炎、肝硬化等临床资料在两组中差异均无统计学意义(P>0.05,表1)。
2.2 MR影像学特征
肿瘤最大径、瘤周肝实质强化、环形强化、TTPVI、瘤内坏死、卫星灶、动态增强模式、DWI/T2WI不匹配等MR影像学特征为HCC术后早期复发的重要影响因素(P<0.05,表2)。
2.3 绘制诺模图
将上述变量纳入多因素Cox回归分析,结果显示肿瘤包膜(HR=0.372,P<0.05)、环形强化(HR=2.947,P<0.05)、TTPVI(HR=1.993,P=0.004)、卫星灶(HR=2.192,P=0.017)及AFP(HR=2.234,P<0.05)是预测HCC手术切除术后早期复发的独立危险因素(表3)。根据包膜、环形强化、TTPVI、卫星灶及AFP独立预测因子的Cox回归系数绘制诺模图,可直观显示肝癌复发风险(图1),1 例典型病例证实诺模图的预测能力(图2)。使用Kaplan-Meier法进行生存分析并绘制生存曲线(图3)。
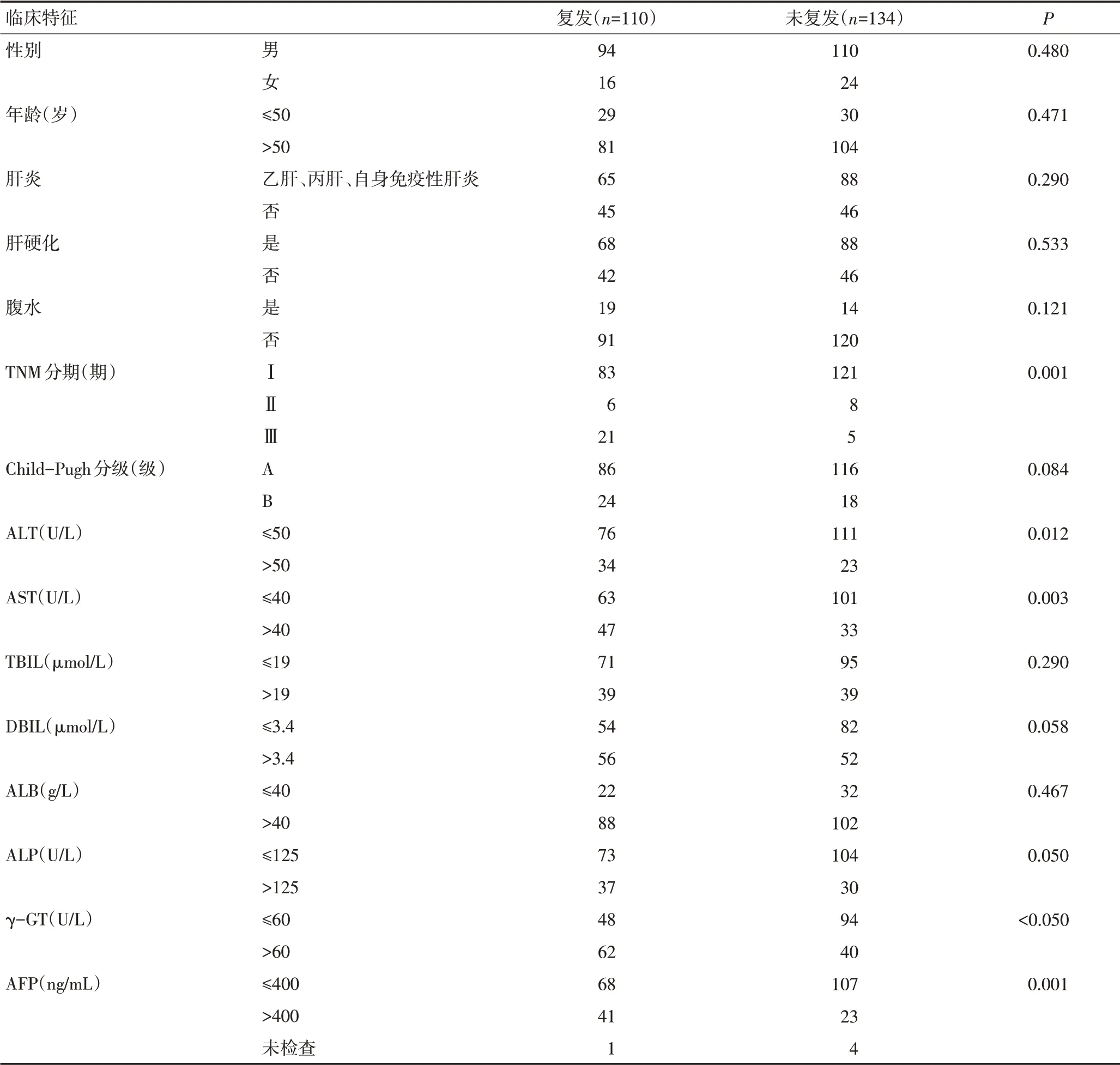
表1 患者临床特征与肝癌术后早期复发的关系
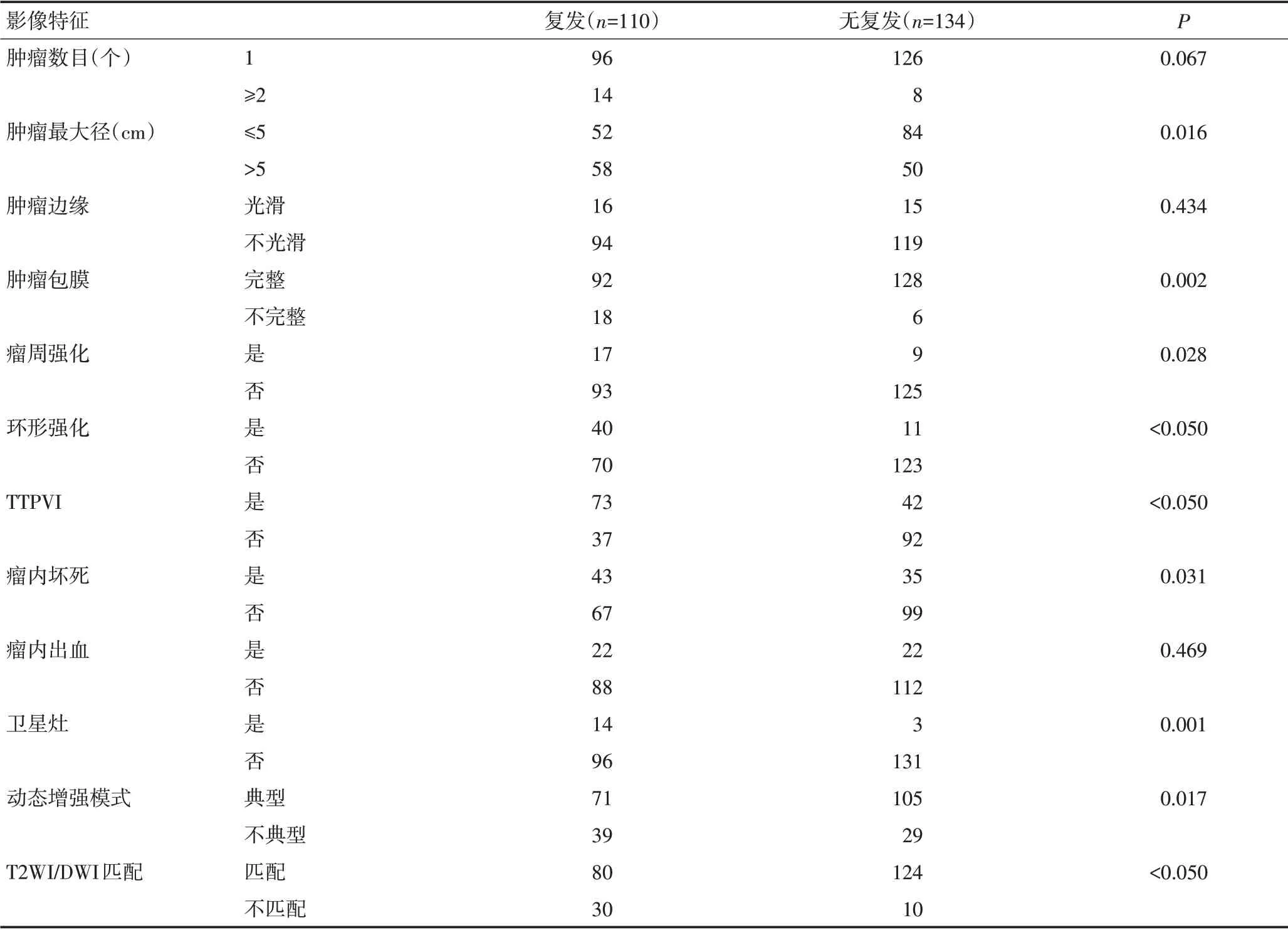
表2 MR影像特征与肝癌术后早期复发的关系
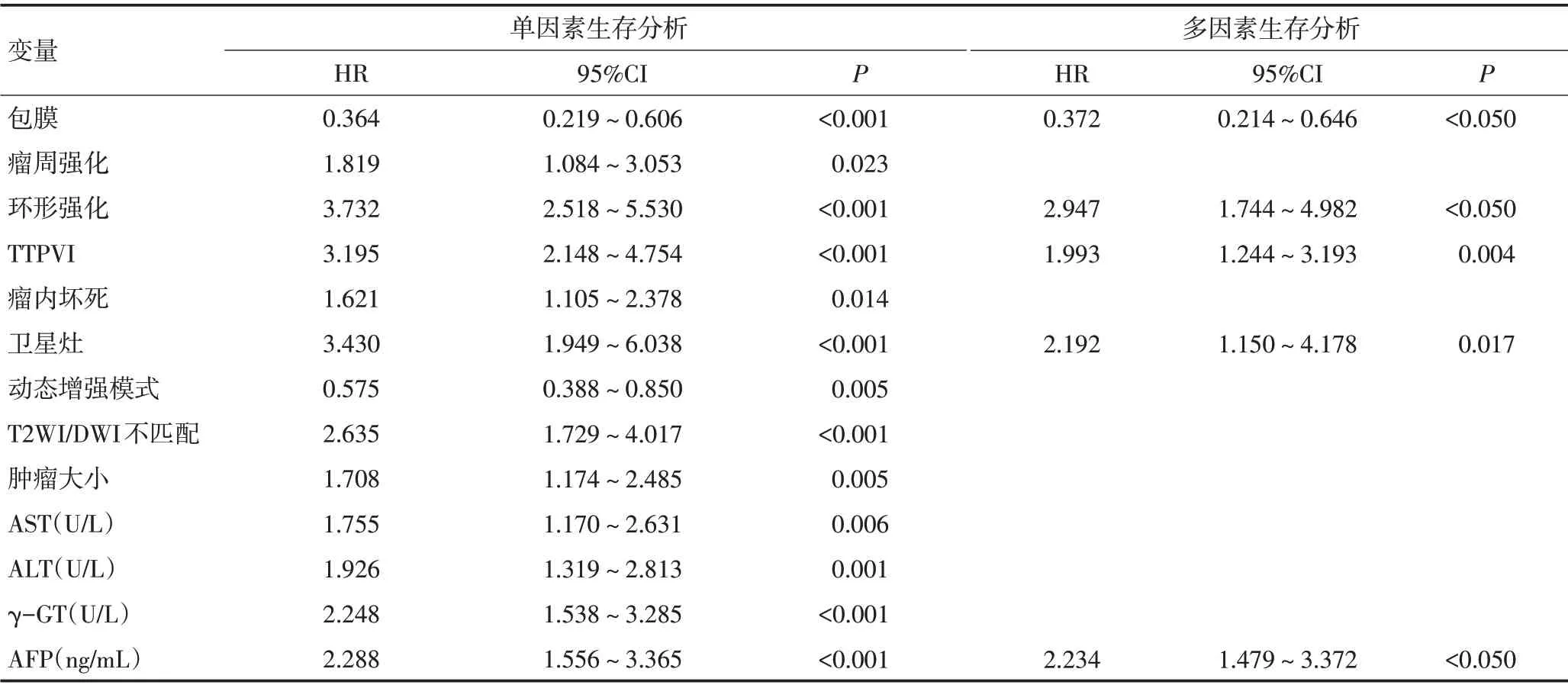
表3 单因素与多因素生存分析危险因素与肝癌术后早期复发的关系

图1 预测HCC术后早期复发的诺模图

图2 1例巨块型肝癌MR图像
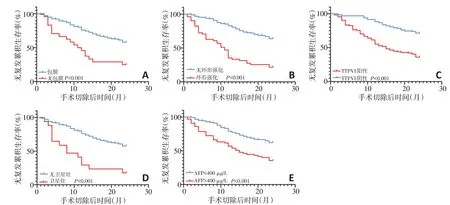
图3 各肿瘤特征与无复发生存率的关系
3 讨论
尽管手术切除和肝移植是目前公认的HCC最优治疗方案,但是早期复发仍是影响患者预后的重要因素。肝癌包膜组织成分为一层纤维囊性结构[8-12],因此完整的包膜是限制肿瘤侵袭的前提条件。当肝癌发生包膜侵犯时,势必导致肿瘤的侵袭性、扩散性提高,造成手术切除难以彻底,成为以后的复发灶。肝癌包膜在本研究中是HCC手术切除术后早期复发的保护因素。
研究表明肿瘤病灶的环形强化可能由于肿瘤病灶中央纤维基质相对较多,而病灶周围肿瘤细胞相对较多[13]。环形强化暗示肿瘤成长速度快、分化差、预后差[14-15],可能与肿瘤无包膜、肿瘤生长迅速伴中央坏死、微血管侵犯等相关。本研究中环形强化作为HCC 早期复发的独立预测因子(HR=2.947,P<0.001),与An等[16]研究结果相一致。
Segal 等[17]最早证实一些CT 影像特征能较好地预测微血管侵犯,瘤内小动脉不伴有低密度环称为TTPVI,其源于静脉侵犯相关基因与血管生成、细胞增殖扩散、局部侵犯表达等。后Renzulli 等[18]证实TTPVI 在CT 和MR 影像特征上预测微血管侵犯方面具有相同的准确性。其机制可能是低信号环为肿瘤膨胀性生长,压迫邻近肝组织使纤维结缔组织增生所致,同时由于肿瘤细胞产生大量促血管生成因子,使瘤内血管生成活跃,形成瘤内小动脉,但新生血管壁基底膜不完整、内皮细胞不连续,从而导致HCC微血管侵犯与肝内转移。本研究中TTPVI 是早期复发的独立危险因素(HR=1.993,P=0.004)。
先前研究报道卫星结节是HCC复发的独立危险因素。Pesi等[19]发现卫星结节及无卫星结节的HCC患者根治性手术切除术后1、3、5年无病生存率分别为34%vs.84%、25%vs.90%、46%vs.64%(P=0.01)。本研究中(HR=2.192,P=0.017)与先前研究结果一致。
AFP 是HCC 肿瘤标志物,由肝癌细胞合成并分泌到血液中[8]。AFP 用于HCC 诊断、疗效评估、复发监测及预后评估等方面。部分研究报道[9-10],AFP 水平是HCC 早期复发的危险因素。在本研究中,术前血清AFP>400 μg/L 与早期复发密切相关,与Shin等[11]研究结果一致。
肿瘤大小是HCC 早期复发的重要危险因素,随着肿瘤增大,早期复发率升高。An 等[16]在研究中发现瘤周强化是早期复发的独立危险因素。在本研究中,虽然多因素分析结果未发现肿瘤大小、瘤周强化是早期复发的独立危险因素,但是单因素分析结果均有显著性差异。因此,术前MRI评价肿瘤大小、瘤周强化影像特征仍然是值得重点关注的指标。研究表明肿瘤多发患者术后复发率更高[20-22]。但在该研究中肿瘤多发仅22例(9%),可能存在一定的数据偏倚,而无统计学意义。
本研究绘制的诺模图可能有助于临床医生评估肝癌根治性切除后早期复发的概率,优化治疗策略。如模型评估早期复发率高的患者可考虑肝移植替代手术切除术,如果肝移植不可行,应考虑全身化疗、经动脉化疗栓塞术等术前新辅助治疗[23-24]。此外经肝癌手术切除术的高危患者术后应密切监测和接受适当的术后辅助治疗以防止复发[25-26]。肿瘤包膜、环形强化、TTPVI、卫星灶、AFP是HCC手术切除术后早期复发的重要因素。该研究的模型仅采用MR 影像特征及临床资料进行建模,未来将考虑影像组学及基因组学特征与HCC 术后早期复发的相关性,从而建立一个集合大量临床及影像信息的预后模型。
