凯氏定氮法测定豆类粗蛋白含量的消解条件探究
2020-08-11颜常盛
颜常盛
(核工业二七〇研究所,南昌330200)
已报道的蛋白质测定方法很多, 如凯氏定氮法、 双缩脲法、 酚试剂法和紫外吸收法等[1-5],主要可分为间接法和直接法两类,较为经典的间接法为凯氏定氮法。 利用凯氏定氮法测量蛋白质含量时, 催化剂和浓硫酸使蛋白质中的碳氢化合物被氧化, 生成二氧化碳和水而逸出, 氮元素则转化为氨根, 与硫酸根结合形成硫酸铵,存于消解液当中[6-7]。在强碱环境中, 对消解液进行蒸汽加热, 使硫酸铵分解, 生成的氨气随水蒸气蒸馏出来被过量的硼酸液吸收, 最后用盐酸标准溶液或硫酸标准溶液进行滴定, 测定试样中的氮含量,通过系数折算出蛋白质含量。
豆类是一类高蛋白、 高脂肪、 高碳水化合物的农作物, 主要可分为两大类: 粗蛋白含量较高的豆类, 如黄豆和黑豆; 碳水化合物含量较高的豆类,如红豆、赤豆和绿豆等。目前对于豆类粗蛋白含量的分析, 仅停留在对大豆和大豆制品的蛋白含量研究层面, 而对于其他豆类粗蛋白的分析测定基本上为空白。 全自动凯氏定氮仪的兴起, 使各类领域内的分析人员, 在如何精准、 快速测定物质蛋白质含量的技术上做各种条件优化试验,为大批量、 高效率地测定蛋白含量, 提供了有力的技术指导[8-9]。
本试验以大豆、 黑豆、 赤豆和绿豆4 种常见的豆类为例, 利用全自动凯氏定氮仪较为全面地分析影响豆类粗蛋白含量测定的因素。 以样品质量、 硫酸添加量、 消化温度和消解时间为试验变量, 通过单一变量试验和正交试验, 建立不同种类豆类粗蛋白的最优分析试验模型, 为豆类蛋白质的测定, 提供既高效又精准的技术支撑。
1 材料和方法
1.1 主要仪器
HF1×100 g 型全密封制样粉碎机, 购置于浙江丰利公司;BSA224A-CW 型万分之一天平,购置于赛多利斯公司;K1100 型全自动凯氏定氮仪、SH220F 型石墨消解炉购置于海能仪器厂。
1.2 材料与试剂
本实验选用粗蛋白含量跨度较大的4 种常见的豆类农作物, 包括大豆、 黑豆、 赤豆和绿豆。浓硫酸(1.84 g·mL-1)、氢氧化钠溶液(400 g·L-1)、硼酸吸收液 (20 g·L-1)、硼砂标准滴定液 (0.039 8 mol·L-1)、 盐酸标准溶液(0.105 4 mol·L-1)、甲基红乙醇溶液(0.1%)和溴甲酚绿的乙醇溶液 (0.1%), 定氮催化片(K2SO4∶CuSO4=3.6∶0.4)、 石蜡油和硫酸铵,以上实验所用试剂纯度均为分析纯, 实验用水均为去氨蒸馏水。
2 实验方法
样品的制备:取4 种豆籽各200 g,进行洗涤、 晾干后, 经粉碎机粉粹, 过筛80 目,置于磨口瓶中备用。
样品的消解: 称取适量的4 种豆籽粉碎样, 置于消化管中, 加入一粒催化片、 适量体积的浓硫酸, 将消化管置于多孔石墨消解仪上对豆粉进行消解。
样品的蒸馏: 启动全自动凯氏定氮仪,待仪器调整至稳定状态时, 将消化管固定在定氮仪上, 并在界面窗口上输入具体分析参数(硼酸:25 mL,稀释水30 mL, 加碱量:40 mL, 蛋白系数:6.25, 蒸汽流量:100%,蒸馏时间5 min, 盐酸标准溶液溶度:0.105 4 mol·L-1)。
3 结果与讨论
3.1 称样量对实验结果的影响
目前, 国家标准只给整个豆类品种的大概称样量(0.2~2.0 g),对于粒径尺寸均一的样品, 适当地增加称样量, 能够一定程度地降低系统误差,但耗时长,消耗的硫酸量大。而减少称样量时, 消解时间缩短, 但又难于保证结果的精确度和准确度。 为此确定特定某一种的豆类合理的称样量对分析结果具有十分重要的意义。
固定硫酸添加量为10.00 mL, 消解温度为420 ℃,消解时间为90 min,催化剂1 片,考察4 种豆籽粉粹样在不同质量下, 消解后的粗蛋白质含量结果,见图1。
由图1 可见,4 种豆类蛋白质含量随样品称样量的变化出现了不同程度的变化, 不同种类的豆类其最佳称样量也有所不同(大豆:0.20 ~0.40 g, 黑 豆: 0.40 ~0.60 g, 绿 豆:0.40~0.70 g, 赤豆: 0.20~0.40 g), 为此,在测定豆类蛋白含量时, 应将称样量控制在0.30~0.60 g 之间,以保证数据的准确性和稳定性。
3.2 硫酸添加量对实验结果的影响

图1 样品称样量对蛋白质测量结果的影响Fig.1 Effect of sample weighting on protein measurement results
消解豆籽粉粹样时,在催化剂的作用下,浓硫酸能够破坏豆籽结构中的蛋白大分子以及有机氮化物 (催化剂中的K2SO4与H2SO4形成的KHSO4提高溶液沸点,CuSO4用于判断消解终点), 使N 元素以游离的NH4SO4存在于消解液中。 过量地使用浓硫酸容易造成温度过高, 使铵盐分解, 分析结果偏低, 并且浪费资源; 而减少浓硫酸的使用, 容易引起消解不完全, 使得分析结果不准确, 为此,寻找最佳浓硫酸用量, 对确保实验结果的准确性和环境保护具有深刻意义。
固定称样量为0.4 g,消解温度为420 ℃,消解时间为90 min, 催化剂1 片, 考察不同浓硫酸 添 加 量(2、4、6、8、10、12、14 和16 mL)对4 种豆籽粗蛋白测定的影响, 见图2。
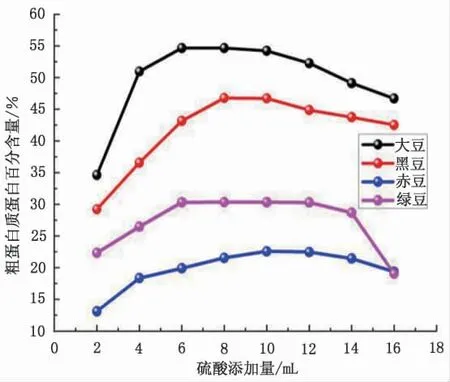
图2 硫酸添加量对蛋白质测量结果的影响Fig.2 Effect of concentrated sulfuric acid addition on protein measurement
由图2 可知,由试验结果可以看出,在4种豆籽样品中, 硫酸添加量严重影响样品的消解程度, 硫酸用量不足时, 样品消解不完全, 体现在测得的粗蛋白含量低于正常值,硫酸添加过量时, 样品消解过于彻底, 粗蛋白含量测得值出现不同程度的降低, 这是由于消解温度过高,部分铵盐发生了分解,引起蛋白含量的偏低, 用于消解大豆样品的最佳硫酸添加量为6~10 mL, 黑豆为8~10 mL,赤豆为6~12 mL,绿豆为8~12 mL,不同的豆籽样品有着不同的最佳硫酸添加范围, 这是由4 种豆类种子内部结构的差异造成的。综上所述,当豆类粉碎样在0.4 g 时,最佳硫酸用量为8~12 mL。
3.3 消解温度对实验结果的影响
在消解豆籽样品时, 由于结构复杂, 石墨炉的消解温度往往需要设置在400 ℃以上,而常用的消解酸中,以硫酸沸点最高为338 ℃(过氧化氢:105 ℃、硝酸:122 ℃、高氯酸:203 ℃), 因此选择硫酸作为消解酸液。 为了使样品充分的消解和氮元素彻底的释放, 研究人员通常采用程序升温的来处理样品。
参照程序升温的步骤 (阶段1:230 ℃保持20 min,阶段2:350 ℃保持20 min,阶段3:420 ℃保持90 min),在不改变阶段1、阶段2 的升温过程及阶段3 的保持时间(90 min)情况下,改变阶段3 的保持温度。固定样品质量0.40 g,10.00 mL 浓硫酸,1 片催化剂,考察不同的消解温度(360、380、400、420、440、460和480 ℃)对粗蛋白质含量的影响,见图3。

图3 消解温度对蛋白质测量结果的影响Fig.3 Effect of digestion temperature on protein measurement results
由图3 可知,当消解温度低于400 ℃时,4 种豆籽样品的蛋白含量随温度升高而升高,温度在420~460 ℃区间时,4 种豆籽样品的蛋白含量趋于稳定,温度高于460 ℃时,4 种豆籽样品的蛋白含量出现不同程度的下降,为此,当豆类粉碎样在0.4 g, 硫酸用量为10 mL 时, 程序加热3 阶段的加热温度在420~460 ℃为最佳温度区间。
3.4 消解时间对实验结果的影响
消解时间是决定样品是否完全消解的重要因素之一, 石墨消解仪在消解豆籽粉碎样时, 国标文件上推荐的时间为90 min, 而对于结构简单的豆籽品种, 时间也未必需要90 min, 必然会造成资源的浪费, 形成的铵盐,也因此会分解。反之,结构复杂的豆籽,国标规定的时间又可能难于满足消解要求,使分析结果偏小。 因此, 为了得到准确的粗蛋白含量, 针对不同种类豆籽样品, 探寻最佳的消解时间至关重要。 仪器厂家以程序升温对样品进行消解。 参照程序升温的步骤(阶段1:230 ℃保持20 min,阶段2:350 ℃保持20 min, 阶段3: 430 ℃保持90 min),保持阶段1 和阶段2 的升温步骤, 固定样品称样量0.4 g, 硫酸添加量8 mL, 催化剂1片,考察阶段3 中430 ℃的不同保持时间,对粗蛋白含量测定结果的影响。
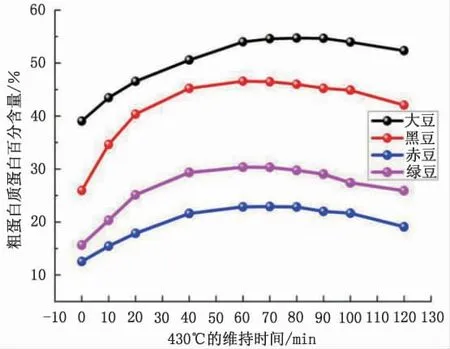
图4 消解时间对蛋白质测量结果的影响Fig.4 Effect of digestion time on protein measurement results
由图4 可知, 程序升温阶段3 的加热时间控制对样品的消解起着至关重要的作用,维持时间不足会导致样品消解不彻底, 反之时间过长, 会使得铵盐分解, 两种情况都将使得最终测得的粗蛋白含量偏低。 不同种类的豆籽有着不同的最佳维持时间,综合而言,在阶段3 中430 ℃保持60~80 min 较为合理。
3.5 正交实验
在单因素水平的基础上, 以大豆中的粗蛋白含量为对象, 选择样品质量、 硫酸添加量、 消解时间和消解温度进行4 因素4 水平的正交试验, 进一步优化凯氏定氮测量蛋白质含量的条件,交叉实验结果见表1,方差分析见表2。
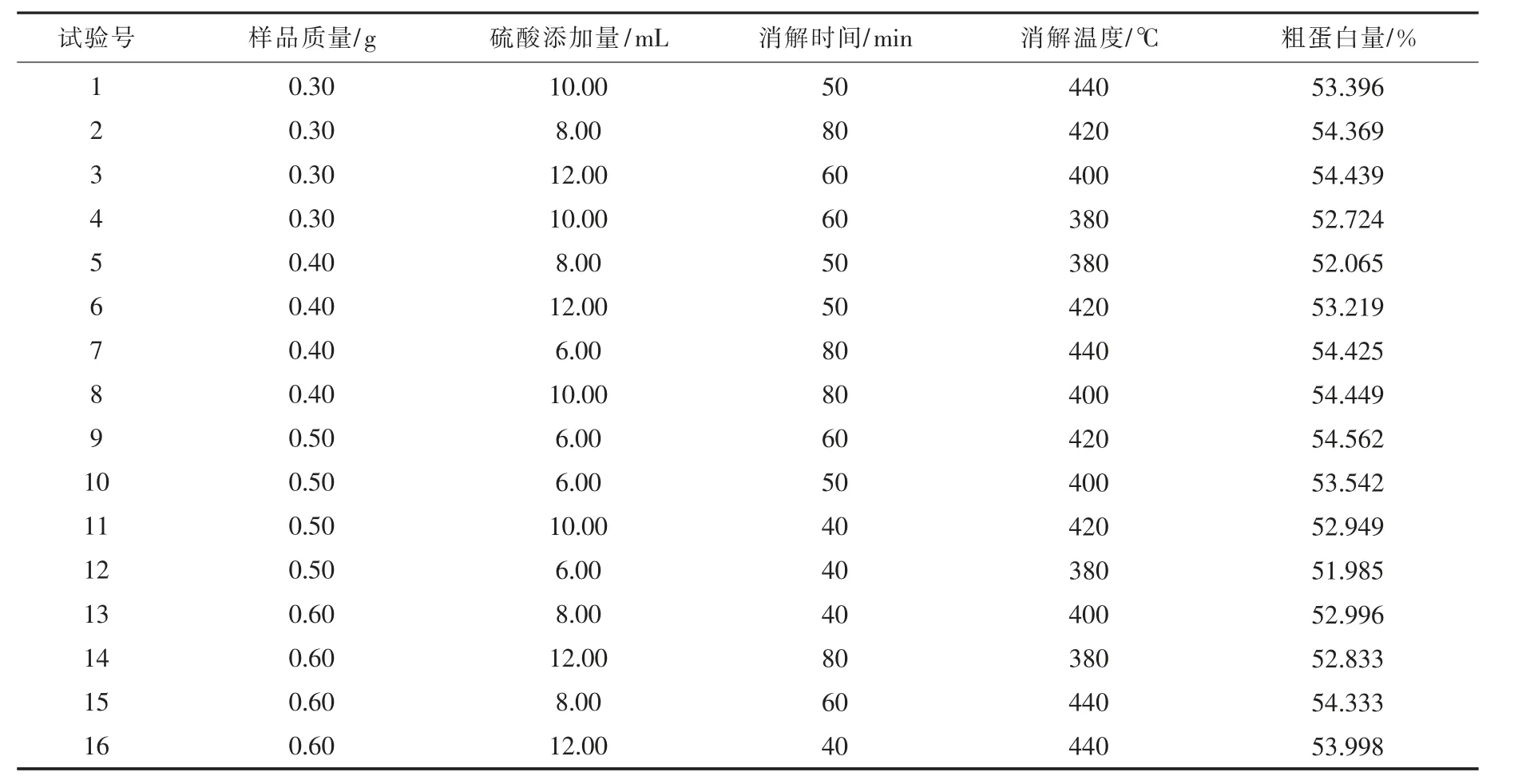
表1 交叉实验结果Table 1 Cross experiment results

表2 方差分析结果Table 2 Results of variance analysis
由表1~2 可知, 消解温度的显著性为0.006(P<0.05)和消解时间的显著性为0.013(P<0.05), 可见消解温度和消解时间的控制对测定结果具有显著影响, 而硫酸添加量的显著性为0.078(0.05<0.078<0.10), 说明硫酸的添加量对测定结果有一定的影响, 而样品质量的大小则对结果影响不明显, 即影响大小为: 消解温度>消解时间>硫酸添加量>样品质量, 因此, 当称样量为0.4 g 时,消解温度为430 ℃, 消解时间为60 min, 硫酸添加量为10 mL 时, 消解效果最佳, 所测的粗蛋白含量最大。
4 结论
以样品质量、 硫酸的添加量、 消解温度和消解时间为实验变量, 针对性地建立了不同实验条件、 不同种类豆类的粗蛋白测量实验, 得出常见豆籽样品的最佳处理条件。 在测定豆籽样品粗蛋白含量时, 豆籽样品的消解温度和消解时间的影响最为显著, 硫酸添加量次之, 样品质量最小, 影响力顺序为:消解温度>消解时间>硫酸添加量>样品质量, 得出在测定常见豆类样品中粗蛋白量含量时, 质量应控制在0.4~0.6 g 之间较为合适, 最佳的消解温度为430 ℃, 消解时间为60 min,硫酸添加量为10 mL。较为合理的样品前处理条件, 在减少了环境污染节约资源的同时, 显著地提高了豆籽粗蛋白含量的准确性与精确性, 为进一步更为深入地探究豆类样品的蛋白成分提供了有力的支撑。
