地下水样品中硼同位素组成的测定
2020-08-11张天睿汤书婷朱键铭
张天睿,汤书婷,颜 妍,朱键铭
(核工业北京地质研究院,北京100029)
自然界中的硼主要富集于岩石和水体中,存在11B 和10B 两种稳定同位素。 硼是微量易溶元素,在水/岩交换作用中, 十分活跃。 硼同位素作为灵敏的地质示踪剂, 对各种地质作用有明显的指导意义,如壳-幔演化和板块俯冲过程的研究、判别沉积环境和物质来源、研究成矿作用和矿床成因、 古海洋和古气候研究、水环境污染研究等[1-2]。地下水资源是地球水资源的重要组成部分, 与大气降水资源和地表水资源密切联系, 互相转化, 地下水中的硼主要来源于含硼酸盐、 土壤的淋滤和人类的活动。 常见的洗涤剂和清洁产品中含有过硼酸钠, 会随生活污水排放到自然水环境中, 从而对地下水资源造成污染。 天然硼酸钠矿物的硼同位素组成范围很窄, 因此可以利用不同来源硼同位素组成显著的不同的特点来示踪地下水污染物的来源[3]。但受分析技术的制约, 研究地下水体系的硼同位素组成非常困难。 目前, 硼同位素测定的主要方法有热电离质谱法[4](TIMS)、电感耦合等离子体质谱法(ICP-MS)[5]和多接收电感耦合离子体质谱法[6](MC-ICP-MS),其中TIMS 法测试精度最高, 但对样品的纯度要求较高, 因此在测量前必须对样品进行前处理, 将样品中的B 分离富集。
目前常用的硼同位素分离方法是混合离子交换树脂法,肖应凯等[7]首次使用强酸性阳离子树脂 (H+型) 和弱碱性阴离子树脂(Ion exchanger Ⅱ,HCO3-型)混合的方法成功分离出盐湖卤水中的硼, 此法已成功用于海水、卤水等样品的处理。 其原理是通过控制分离过程中溶液酸度来确保硼元素以不被交换离子树脂吸附的H3BO3形式存在, 而杂质元素离子全部被离子交换树脂所吸附, 达到硼的分离纯化。 该方法简便易于操作, 适用于硼含量较高且含杂质离子较多的样品。 但地下水样品与海水、 卤水相比, 硼的含量非常低(30 μg·L-1左右), 因此在质谱测试前必须经过浓缩富集才能得到准确的结果。 有研究表明H3BO3会与HF 反应生成BF4-,BF4-与甘露醇反应生成络合阴离子[7],可被阴离子树脂吸附。 因此可以选择不吸附阳离子的阴离子树脂来分离硼元素, 这种方法不需要较大的离子交换能力, 使得硼元素的分离和富集同时进行成为可能。
通常情况下, 地下水中含有较多的有机质, 在热电离质谱法测定过程中, 有机质的存在会抑制硼的电离, 使电离温度升高, 对离子流的稳定性产生影响, 导致测试的精密度和准确度降低[8]。因此在质谱测试前,需去除地下水样品中的有机质, 目前常用除去水中有机物的方法有紫外线照射法、 活化碳吸附法和过氧化氢等方法, 但上述方法还存在缺陷[9],可能会导致分馏。有研究表明,C18固相萃取柱可以有效地去除污水样品中的有机 质[10]。赵 大 传 等[11]采 用C18 固 相 萃 取-GC/MS 检测分析技术,分析出黄河水中有机污染物有26 种。C18 固相萃取技术能有效去除地下水中的主要有机质, 不影响硼的定量回收。
针对地下水样品中硼含量低且有机质含量较高的特点, 用C18 固相萃取柱去除有机物杂质, 采用单一阴离子交换树脂法分离硼元素, 与双离子分离法进行对比, 讨论硼酸在不同体系下的存在形式。 采用静态多接收热电离质谱仪进行硼同位素组成测定, 同时验证硼在分离富集过程中是否产生质量分馏效应, 并对某地区地下水样品进行硼的分离和同位素组成测定,检验该方法的可行性。
1 实验部分
1.1 仪器与试剂
热电离质谱仪 (PHOENIX, 英国IsotopX公 司 ); 电 感 耦 合 等 离 子 质 谱 仪(NEXION300D,PE),灯丝除气装置;电子天平(万分之一);微量取样器(0.5~10 μL)。
LC-C18 固相萃取柱(CNW 500 mg,3 mL),强酸型阳离子交换树脂(AG50W—X8)(100~200 目); 强 碱 型 阴 离 子 交 换 树 脂(AG1X8)(100~200 目); 钽带(18 mm×0.8 mm×0.03 mm,纯度为99.95%)钽带和支架在去气装置中于1 000 Pa 的直空下, 以3 000 mA 除气30 min,冷却后备用。NIST SRM 951a 硼酸同位素标准物质; 超纯水,18.3 MΩ; 低硼水(超纯水加甘露醇亚沸蒸馏),碳酸钠 (4 N),甘露醇(分析纯), 异丙醇(分析纯), 石墨悬浊液[12]。本实验全过程所用器皿均为聚四氟乙烯、 聚乙烯材质, 不接触玻璃器皿, 避免对硼造成污染。
1.2 样品中硼元素的分离
1.2.1 双离子交换树脂分离
阳离子树脂和阴离子交换树脂分别用6 mol·L-1HCl 淋洗,洗至中性后用0.1 mol·L-1HCl 5 mL 平衡,将通过C18 萃取柱1 μg·mL-1,5 mL 硼酸溶液依次通过平衡好的树脂柱中,用0.1 mol·L-1HCl,5 mL 分5 次淋洗树脂柱,将硼全部淋洗下来。 收集流出液于洁净的聚四氟乙烯溶样罐中,加入适量甘露醇,使硼、甘露醇的摩尔比约为1:1,置于通风橱中60 ℃电热板上加热,蒸发至近干(约20 μL 左右)待质谱测定。
1.2.2 阴离子交换树脂分离
阴离子交换树脂用5%HNO38 mL 淋洗,洗至中性后6 mol·L-1HCl 3 mL 淋洗,洗至中性后10 mol·L-1HF 淋洗3mL,洗至中性后用0.02 mol·L-1HF 5 mL 平衡。取10 μg·mL-1硼酸溶液,0.5 mL 经C18 柱处理后, 加0.2 mL 2%甘露醇溶液,加0.1 mL 22 mol·L-1HF 上阴离子交换柱,先3 mL 用2 mol·L-1HCl 淋洗杂质,后用6 mol·L-1HCl 洗脱硼, 收集洗脱液,置于通风橱中60 ℃电热板上加热,蒸发至近干待质谱测定。
1.3 硼同位素组成的测定
通过热电离质谱仪测量Na2BO2+离子测定硼同位素(正热电离质谱法)[13]。向已处理好的溶液中加入适量Na2CO3溶液,使B∶Na(摩尔比)为1∶1。取2 μL 石墨悬浊液点于除气处理后的钽带上,加电流0.5A 蒸至近干,然后取2 μL 样品点于石墨上, 将电流缓缓升至1A, 烘干后降至零, 点好的样品上样品盘,装入质谱仪。系统抽直空至1.0×10-7mbar 后开始测量。灯丝电流缓慢升至2.1 A。 寻找89(23Na211B16O2+)和88(23Na210B16O2+)离子流,调节聚焦参数, 直至23Na211B16O2+离子稳定。维持离子流强度不低于2V 时开始测试。计算它们的离子流强度比值R89/88, 经氧同位素校正后,11B/10B=R89/88-0.000 78。本实验所用硼同位素标准物质为NIST 951 a, 参考值11B/10B=4.043 7±0.003 3。
2 结果与讨论
2.1 不同体系中硼存在形式的讨论
2.1.1 双离子交换树脂分离(盐酸)体系
为防止样品在蒸发富集过程产生质量分馏效应, 通常加入适量的甘露醇与硼酸形成络合物。 为了研究硼酸与甘露醇形成的络合物在盐酸介质下的吸附行为, 将5 μL 硼酸(0.5 mL) 加0.2 mL 2%甘露醇溶液及0.2 mL 0.5 mol·L-1HCl 上柱, 加入平衡后的阳离子、阴离子混合交换树脂中。 前5 mL 用0.1 mol·L-1HCl 淋洗, 后 用6 mol·L-1HCl 淋 洗9 mL 收集洗脱液绘制曲线。同时取5 μL 硼酸(0.5 mL)不加甘露醇,同样的分离流程分离,收集淋洗液绘制曲线图。图1 为硼酸-甘露醇混合溶液在盐酸体系下的淋洗曲线, 图2 为盐酸体系下硼酸溶液的淋洗曲线。 对比两图可以看出: 盐酸体系下硼酸不会被阴离子交换树脂吸附, 且硼酸与甘露醇生成的络合物不会被阴离子交换树脂吸附。
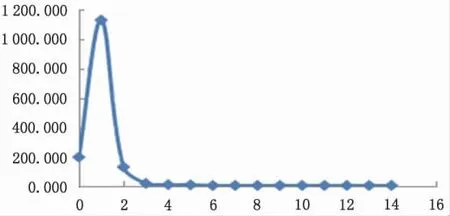
图1 盐酸体系下硼酸淋洗曲线Fig.1 Boric acid leaching curve in hydrochloric acid media
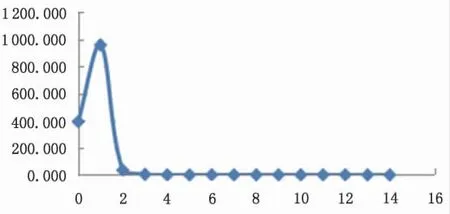
图2 盐酸体系下硼酸加甘露醇淋洗曲线Fig.2 Leaching curve of boric acid and mannitol in hydrochloric acid media
2.1.2 阴离子交换树脂分离(氢氟酸)体系
研究表明, 在氢氟酸体系下, 硼以BF4-形式存在与甘露醇反应生成络合阴离子。 为探究该络合物在阴离子交换树脂的吸附行为,本实验向5 mg(0.5 mL) 硼酸中加入0.2 mL 2%甘露醇和0.1 mL 22 mol·L-1HF 加入平衡后的阴离子交换柱中。 前3 mL 用2 mol·L-1HCl 淋洗,后用6 mol·L-1HCl 淋洗26 mL。图3 为淋洗曲线,可以看出前3 mL 稀酸淋洗杂质元素时, 硼的络合物阴离子已经被吸附在阴离子交换树脂中。 当用6 mol·L-1的HCl淋洗时, 硼元素开始被洗脱下来, 约15 mL淋洗液可将硼全部洗脱。 说明硼酸和甘露醇与足量氢氟酸反应会生成络合物阴离子, 会被阴离子树脂吸附。 利用这个反应可以建立阴离子交换树脂法来分离硼元素。
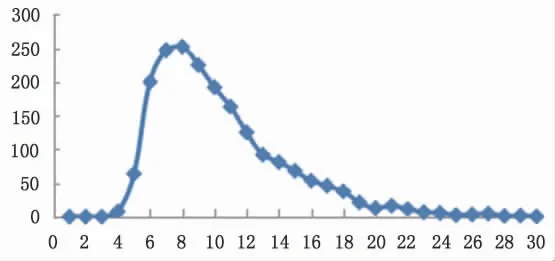
图3 氢氟酸体系下硼酸淋洗曲线Fig.3 Boric acid leaching curve in hydrofluoric acid media
2.2 前处理全流程硼的回收率
在分离过程中, 硼的吸附和解吸过程会产生质量分馏效应, 因此回收率的高低会影响测量结果的准确性。硼元素在弱酸性水中,以硼酸形式存在,是对称结构的非极性分子,在通过C18 柱时有可能会随有机质被吸附在萃取柱上。 同时, 样品在通过离子交换树脂时存在离子交换, 可能会造成硼的损失。 因此, 在样品前处理过程中应尽可能对硼进行定量回收。表1 为分别取10、20、25、50 和100 μg·mL-11 mL 硼酸标准溶液先经固相萃取柱后采用两种分离方法全流程处理, 通过ICP-MS 测得硼的回收率结果。 由表1 可见,两种分离方法的全流程回收率均在95%以上,且阴离子交换树脂分离法的回收率略高于混合离子交换树脂法, 固相萃取法和离子交换分离方法均不会造成硼的损失, 能对硼进行定量回收。
2.3 NIST 951a 通过流程的硼同位素测定值的比较
为研究上述实验方法样品处理过程中是否发生同位素分馏,本实验将NIST 951a 标准物质溶液先通过固相萃取柱, 后分别通过混合离子交换树脂和阴离子交换树脂分离流程后与未经过处理的硼标准物质溶液的硼同位素比值进行比较。 结果见表2,NIST 951a 硼酸标准在经过两种全流程后,11B/10B 测定值分别为4.045 09 和4.045 67,与未经过流程直接测 定的11B/10B (4.045 22) 在测定误差范围(0.05%)内一致[14]。 说 明 前 处 理 过 程 中 硼 的分馏效应可以忽略, 单离子交换树脂法分离方法能够满足质谱测试需要, 但双离子交换树脂法结果误差更小。
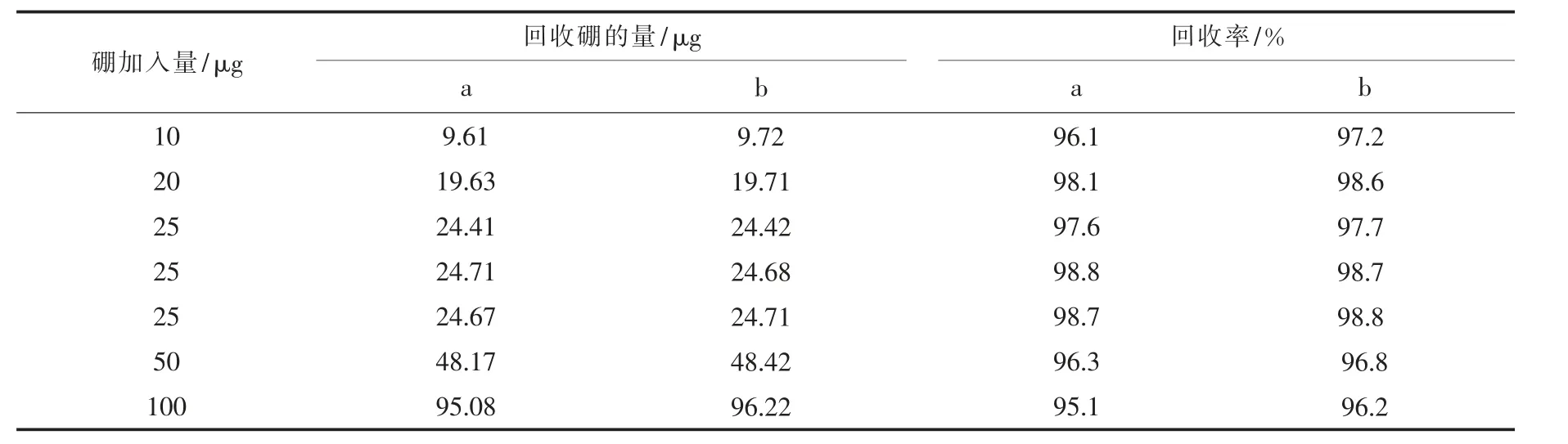
表1 不同分离方法硼的全流程回收率Table 1 The recovery of boron of the whole process in different separation methods

表2 经流程的与未经流程的NIST 951a 硼同位素测定结果比较Table 2 Comparison of the results of boron isotope determination by NIST 951a after flow and without flow
为更直观分析分离流程对测试结果的影响, 忽略硼酸标准样品在质谱测试过程中的分馏效应,计算偏差值δ,并作图。由图4 可见, 两种分离流程的测量结果在零点上下均匀分布,且都在参考值的误差范围内(误差范围0.8‰由951 a 参考值计算得出),说明样品经两种分离方法处理后未发生明显分馏, 分离流程不影响测试结果的准确性。
2.4 样品测定的重复性
阴离子交换树脂法在分离过程中能同时对B 进行富集, 缩短样品处理时间, 降低样品被污染的概率。 为验证单离子交换树脂分离法的准确性, 选取某地区地下水样品分别采用单离子交换和双离子树脂交换法分离硼元素。 根据样品硼含量, 取100 mL 样品经C18 柱处理后上柱分离,最终单、双离子交换分离法得到的收集液分别为20 和110 mL,浓缩后用热电离质谱法进行重复测定, 见表3。结果表明, 两种分离方法得到的结果相近,精度在0.3‰~0.8‰, 但阴离子交换树脂法的测试精度更高, 与标样测试水平接近, 说明该处理方法均能满足正热电离质谱法测定的需要,且具有良好的重现性。
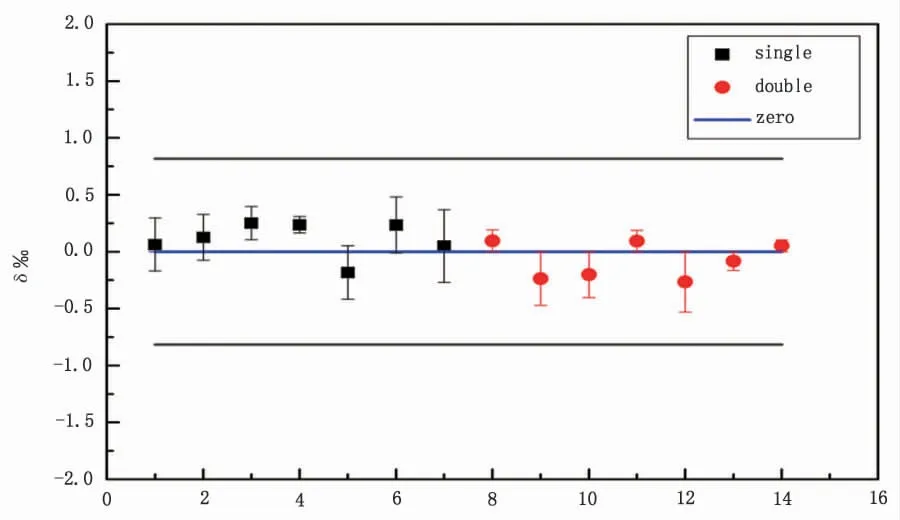
图4 两种分离方法与参考值偏差图Fig.4 Deviation graph to reference values by two separation methods

表3 地下水样品重复性测试Table 3 The results of repeated testing of groundwater samples
3 结论
针对地下水有机质含量高且硼含量低的特点, 采用C18 固相萃取柱去除样品中的有机质, 建立了阴离子交换树脂分离富集硼的方法, 并和混合离子交换法进行了比较。 结果表明: 固相萃取法和离子交换树脂分离法联用的全流程回收率在95%以上,能对硼进行定量回收。 质谱测试结果表明, 在误差范围内分离过程中硼元素不产生同位素质量分馏。对不同地区地下水样品进行重复测定的结果说明这两种方法均能很好地满足正热电离质谱法测定的需要, 得到准确的结果, 但阴离子交换树脂法能够同时实现硼的分离和富集,测试精度更高(0.06%),更适用于硼含量低的地下水样品。
