二点委夜蛾非典型嗅觉受体AlepOrco的基因克隆、原核表达及多克隆抗体制备
2020-08-06田彩红刘晓光黄建荣封洪强
田彩红, 刘晓光, 黄建荣, 王 瑛, 封洪强,*
(1. 河南省农业科学院植物保护研究所, 河南省农作物病虫害防治重点实验室, 农业部华北南部作物有害生物综合治理重点实验室, 河南省作物保护国际联合实验室, 河南省生物农药工程研究中心, 郑州 450002; 2. 河南农业大学植物保护学院, 省部共建小麦玉米作物学重点实验室, 郑州 450002)
二点委夜蛾Athetislepigone属鳞翅目(Lepidoptera)夜蛾科(Noctuidae)委夜蛾属Athetis(Bomare, 2002),是一种在世界范围内分布的以30多种寄主植物为食的多食性害虫(Lindeborg, 2007)。该害虫的幼虫2005年首次在河北被发现危害夏玉米苗,2011年在黄淮海地区暴发成灾(王振营等, 2012; Lietal., 2013)。随着我国农作物免耕播种、秸秆还田、种肥同播的普遍采用,加之简单的小麦-玉米连作制度的影响,其发生范围逐渐扩大,于2017年在河北唐山地区再次暴发(张尚卿等, 2018)。目前,二点委夜蛾已经成为我国黄淮海地区夏玉米上的常发性苗期害虫,是黄淮海夏玉米区的重点防控对象(王振营和王晓鸣, 2019)。其成虫善迁飞(Fuetal., 2014; 黄建荣等, 2018),幼虫喜阴暗潮湿环境,畏强光,常躲在玉米幼苗周围的碎麦秸下危害,常啃食苗期玉米根部,造成玉米植株损伤,缺苗断垅。在夏玉米产区暴发,常常呈现发生面积大、虫口密度高和危害程度重的特点,并造成大片死苗,严重威胁夏玉米安全生产(江幸福等, 2011; 石洁等, 2011)。由于该虫的隐蔽危害习性,单次化学防治效果甚微,常造成多次施药,不仅增加了该虫抗性产生的风险,且污染了生态环境。因此,准确监测和诱杀二点委夜蛾成为目前亟待解决的难题,迫切需要有一种高效、持久、稳定、环境友好、不伤害天敌和保护生态平衡的玉米害虫综合防治技术体系,也是“农药化肥双减”和“农药零增长”的迫切要求(吴孔明, 2018; 张凯等, 2019)。
昆虫在长期进化中,通过自身嗅觉机体反应,可以感知环境中的挥发性物质,并依此信息觅食、求偶和寻找适宜的产卵场所。触角感器中的嗅觉受体与脂溶性气味物质特异性识别与反应,是昆虫识别外界气味物质的重要一环,使昆虫可以特异地识别环境中无数不同的化学物质(Bargmannetal., 2006; Pelosietal., 2018),也为开发新型害虫防控技术提供了重要理论基础。昆虫的非典型嗅觉受体(olfactory receptor co-receptor, Orco)能与传统嗅觉受体形成复合体,共同形成异源二聚体配体门控阳离子通道,促进传统嗅觉受体在神经元树突上的定位并维持其稳定性,提高传统嗅觉受体对气味反应的效率(Satoetal., 2008; Wicheretal., 2008; Kaupp, 2010; Changetal., 2017; Butterwicketal., 2018)。昆虫的非典型嗅觉受体的氨基酸序列在不同昆虫间高度保守,其编码基因已在8个目的40多种昆虫中得以鉴定(Stengl and Funk, 2013),诸如:鳞翅目的家蚕Bombyxmori、烟芽夜蛾Heliothisvirescens、双委夜蛾Athetisdissimilis等(Nakagawaetal., 2005; 宋月芹等, 2015; Liuetal., 2017),同翅目的麦长管蚜Sitobionavenae(Fanetal., 2015),半翅目的绿盲蝽Apolyguslucorum(Zhouetal., 2014)和鞘翅目的广聚萤叶甲Ophraellacommuna(Maetal., 2019)。Orco的组织特异性表达也在直翅目的东亚飞蝗Locustamigratoria和沙漠蝗Schistocercagregaria(Yangetal., 2012),鳞翅目的斜纹夜蛾Spodopteralitura(Wuetal., 2013)和桃蛀螟Conogethespunctiferalis(葛星等, 2013),以及膜翅目的棉铃虫齿唇姬蜂Campoletischlorideae(董钧锋等, 2015)中得到了详细的阐明。
二点委夜蛾作为我国耕作制度变革和气候变化引发的新害虫,其化学通讯行为值得深入研究。Zhang等(2017, 2019)利用转录组测序数据分析鉴定了二点委夜蛾的28个触角气味蛋白和20个化学感受蛋白的生物信息学功能,并利用双电极电压钳技术研究了二点委夜蛾的4个信息素受体基因的功能。但对二点委夜蛾的非典型嗅觉受体基因AlepOrco的研究尚未见报道,因此,研究昆虫间高度保守的二点委夜蛾Orco基因,解析其在气味分子识别过程中的机制,探索通过调节昆虫的行为来防治二点委夜蛾的新技术,具有一定的理论价值。本研究在二点委夜蛾雌雄触角转录组数据基础上,结合RT-PCR技术,克隆并鉴定了二点委夜蛾非典型嗅觉受体基因,并在大肠杆菌Escherichiacoli中进行了原核表达,制备并检测了该基因的多克隆抗体,同时利用qPCR技术检测了该基因在雌雄成虫不同组织中的表达,以期为解析该基因的结构和功能奠定基础。
1 材料与方法
1.1 供试昆虫
二点委夜蛾为本实验室在温度为26±1℃,相对湿度为85%,光周期为15L∶9D的条件下用人工饲料饲养的实验种群(田彩红等, 2013)。雌雄蛹分开放置在不同养虫笼中等待羽化,成虫羽化后饲喂以10%的蜂蜜水补充营养,备用。
1.2 样品的收集及总RNA的提取
取羽化3 d的未交配的二点委夜蛾雌雄成虫各100头,取其触角、头部(去除触角和喙)、喙、胸、腹、足和翅。每50~100 mg上述组织放入含有1 mL Trizol(Invitrogen公司)的离心管中,加适量液氮迅速充分研磨,提取得到总RNA。总RNA经DNaseⅠ酶(TaKaRa公司)消化后,用NanoDropTM检测并记录其浓度,保证OD260/OD280比值在1.8~2.0之间。以上实验重复3次,并使用1.0%的琼脂糖凝胶电泳检测总RNA 的完整性。
1.3 二点委夜蛾Orco基因的克隆鉴定
以本实验室前期获得的二点委夜蛾雌、雄成虫触角转录组unigene序列(数据未发表),建立核苷酸本地BLAST数据库。根据姚雪等(2019)调取同源基因的方法,以家蚕非典型嗅觉受体基因氨基酸序列(GenBank登录号: NP_001037060.1)为诱饵蛋白,通过tBlastn搜索,钓取二点委夜蛾候选蛋白,获得二点委夜蛾OrcomRNA全长。 将获得的OrcomRNA序列进行分析,设计二点委夜蛾Orco(AlepOrco)特异性引物AlepOrco-F和AlepOrco-R(表1,酶切位点以下划线标示)。将1.2节提取的总RNA 2 μg按照SMART cDNA Library Construction Kit(Clontech公司)合成方法合成cDNA第1链。RT-PCR反应体系(25 μL): cDNA模板2 μL, Premix Taq Version 2.0试剂12.5 μL, AlepOrco-F/AlepOrco-R引物各1 μL,去离子水8.5 μL。反应条件: 94℃预变性3 min; 95℃ 30 s, 56℃ 1 min, 72℃ 1 min, 33个循环; 72℃总延伸10 min。PCR产物用1.0%的琼脂糖凝胶电泳检测并用DNA凝胶回收试剂盒(Axygen公司)回收目的片段。将回收的PCR产物按照3∶1的摩尔浓度连接到pMD18-T载体(TaKaRa公司)(重组质粒命名为pMD18-T/AlepOrco),转化TG1感受态细胞,蓝白斑筛选挑出阳性克隆,将获得的阳性克隆分别大量培养,利用质粒小量制备试剂盒提取质粒DNA(Axygen公司),利用BamHⅠ和XhoⅠ(TaKaRa)双酶切鉴定重组克隆pMD18-T/AlepOrco,将对应的正确克隆在生工生物工程上海股份有限公司进行DNA序列测定。

表1 引物信息Table 1 Primer information
1.4 生物信息学分析
将1.3节中测序正确的二点委夜蛾Orco核苷酸序列进行氨基酸序列预测,然后利用在线软件Expasy (https:∥www.expasy.org/) 进行蛋白质性质分析;氨基酸序列理化性质分析参考Gasteiger等(2005)分析方法。采用在线软件(http:∥www.cbs.dtu.dk/services/SignalP/)进行信号肽预测,同时利用在线软件(http:∥www.cbs.dtu.dk/services/TMHMM/)进行跨膜域预测。搜集其他已知昆虫Orco氨基酸序列进行比对分析,比对结果用GeneDoc 2.7软件进行编辑(https:∥genedoc.software.informer.com/)。此外,根据搜集到的Orco基因的氨基酸序列,在在线软件(https:∥www.ebi.ac.uk/Tools/msa/clustalo/)中,选择Jones-Taylor-Thornton (JTT)模型,利用最大似然法(maximum likelihood method)构建系统进化树进行聚类分析。
1.5 二点委夜蛾Orco原核表达及Western blot检测
将pMD18-T/AlepOrco经BamHⅠ和XhoⅠ双酶切后,与经同样酶切的原核表达载体pGEX-6P-1(河南农业大学安世恒教授惠赠)连接,目的片段和酶切的质粒载体比例为3∶1。在T4 DNA连接酶(TaKaRa)的作用下16℃过夜连接,转化TG1感受态细胞,过夜培养后,提取重组质粒(命名为pGEX/AlepOrco)质粒DNA,BamHⅠ和XhoⅠ双酶切鉴定,鉴定正确的阳性克隆送生工生物工程上海股份有限公司测序。
将上述经鉴定正确的pGEX/AlepOrco质粒转化大肠杆菌BL21(DE3)(河南农业大学安世恒教授惠赠)感受态细胞,挑取单菌落置于5mL LB培养基(含AMP 100 μg/mL)中,200 r/min于37℃下振荡培养过夜。按0.1%(体积比)活化转接5 mL LB培养基(含AMP 100 μg/mL),200 r/min于37℃振荡培养至OD值达0.6~0.8时,加IPTG(生工生物工程上海股份有限公司)分别至终浓度为10, 20和40 mmol/L,37℃ 150 r/min 诱导8 h。6 000 r/min离心5 min收集菌体沉淀。用200 μL的1×PBS将沉淀重新悬浮,4 000 r/min离心10 min,收集沉淀,加入200 μL的SDS凝胶上样缓冲液[含40 mmol/L Tris-HCl(pH 6.8),10%甘油,2% SDS,5%巯基乙醇,0.1%溴酚蓝]后用漩涡混匀器震荡悬浮,沸水中煮沸10 min,12 000 r/min离心10 min离心后取上清,置4℃保存备用(程晓东等, 2011)。
SDS-聚丙烯酰胺凝胶电泳参照徐秋芳等(2014)方法进行,Western blot 分析参照Sambrook等(1998)的方法进行。具体为:蛋白样品经SDS-PAGE电泳后,取与分离胶相同大小的PVDF膜(Millipore),在冰浴条件下用湿式转膜仪以120 V电压,转膜1.5 h, 然后用含有辣根过氧化物酶标记的抗GST标签鼠单克隆抗体(BBI)的一抗封闭液(含2‰ Tween-20的1×PBS),4℃冰箱中封闭过夜;第2天,室温反应30 min,用洗涤缓冲液(含0.5% Tween-20的pH 7.4 的0.02 mol/L PBS)洗膜3次;加入封闭液稀释的辣根过氧化物酶标记的山羊抗小鼠IgG为二抗(Promega),室温反应2 h,用洗涤缓冲液洗膜3次;最后将膜置于含有DAB(Promega)的显色液(0.1 mol/L PBS 10 mL;临用前加DAB 4 mg, 10% H2O260 μL)中显色至条带清晰,将膜置于双蒸水中终止显色反应并拍照。
1.6 抗体的制备及特异性检测
表达产物经SDS-PAGE电泳后,割胶回收并纯化表达的蛋白。多克隆抗体的制备参照标准技术(程晓东等, 2011)进行,免疫新西兰大白兔的工作由北京赛百盛基因技术有限公司协助完成,取其免疫前血清作为阴性对照。抗体特异性检测参照Tian等(2009)进行,具体操作为:取二点委夜蛾羽化后3 d内的未交配雌雄成虫触角各300对,加入适量的缓冲液(1×PBS),在冰浴条件下利用电动组织研磨器研磨匀浆,加入等体积的蛋白上样缓冲液[含100 mmol/L Tris-HCl(pH 6.8),200 mmol/L二硫苏糖醇(DTT),4% SDS,0.2%溴酚蓝,20%甘油],沸水煮10 min,4℃条件下12 000 r/min离心10 min,取上清10 μL,进行SDS-PAGE和Western blot分析,Western blot的一抗采用制备的多克隆抗体,二抗采用辣根过氧化物酶标记山羊抗兔IgG(Promega),阴性对照采用免疫前血清。
1.7 AlepOrco在二点委夜蛾成虫不同组织中的表达
将1.3节获得二点委夜蛾非典型嗅觉受体基因序列用Primer3web Version 4.1.0引物设计软件设计特异性引物(Untergasseretal., 2012; Kõressaaretal., 2018)。AlepOrco-RT-F和AlepOrco-RT-R(表1)用于测定AlepOrco在二点委夜蛾成虫不同组织中的表达,以AlepGAPDH作为内参基因(Zhangetal., 2017),引物序列见表1。引物由生工生物工程上海股份有限公司负责合成。具体操作方法如下:取2 μg 1.2节获得的各组织总RNA,DNaseⅠ酶消化后,按照试剂盒PrimeScript RT Reagent Kit with gDNA Eraser (TaKaRa)说明书进行反转录。之后,按照SYBRPremixExTaqTM(Tli RNaseH Plus) (TaKaRa)的使用说明配制PCR反应液,反应体系(20 μL): SYBRPremixExTaqTMII 10 μL, 上下游引物(0.2 μmol/L)各1 μL, cDNA模板1 μL, 经DEPC(TaKaRa)处理的灭菌超纯水7 μL。每个样本组织设3个生物学重复,每个生物学重复的组织样本分别来自羽化3 d未交配的二点委夜蛾雌、雄成虫各100头,每样品3个技术重复。在StepOnePlusTMReal-Time PCR System (Applied Biosystems, USA)定量PCR仪上进行反应。反应条件: 95℃预变性3 min; 95℃变性10 s, 60℃退火30 s, 共计40个循环。溶解曲线分析后提取有效样品数据,阴性对照为在反应体系中加入不含DNA模板的DEPC处理过的灭活双蒸水。
1.8 数据分析
以二点委夜蛾雌蛾触角中Orco基因的表达量为基准(宋月芹等, 2015),利用2-ΔΔCt方法(Livak and Schmittgen, 2001)计算基因相对表达量,采用3次生物学实验重复,误差取3次实验重复的标准差。数据统计分析采用SPSS 19.0软件;相同组织不同性别间基因表达量差异用t测验,相同性别不同组织间基因表达量差异用单因素方差分析。
2 结果
2.1 二点委夜蛾Orco基因的克隆及序列分析
获得了二点委夜蛾AlepOrco基因(GenBank登录号: MN583125)cDNA全长序列,长度为1 422 bp,共编码473个氨基酸残基,预测等电点为8.59,分子量为53.40 kD。
序列分析表明该基因编码蛋白AlepOrco氨基酸序列中不存在信号肽序列,但存在7个跨膜区,分别位于第45-65, 74-97, 135-158, 193-216, 333-356, 375-396和446-469位氨基酸处。疏水性分析表明,亲脂性氨基酸占据了序列的大部分,尤其是第800-1 000位氨基酸的亲脂性较高,在第0-200位氨基酸后也存在较高亲脂性区域。在编码的473个氨基酸中,疏水氨基酸个数和对应的占编码的氨基酸总百分数分别是:51个亮氨酸(Leu),占10.8%;41个丙氨酸(Ala),占8.7%;36个丝氨酸(Ser),占7.6%;36个苏氨酸(Thr),占7.6%;31个苯丙氨酸(Phe),占6.6%;31个缬氨酸(Val),占6.6%。蛋白不稳定指数为30.67,脂溶指数为93.64,总亲水性平均系数为0.23,可推测该蛋白为脂溶性蛋白。
氨基酸序列比对分析结果表明,二点委夜蛾Orco与其他鳞翅目昆虫Orco氨基酸序列一致性在90%以上,其中与双委夜蛾Orco的氨基酸序列一致性最高,达99.15%;与鳞翅目其他昆虫如疆夜蛾Peridromasaucia、粘虫Mythimnaseparata、草地贪夜蛾Spodopterafrugiperda、烟青虫Helicoverpaassulta、黄地老虎Agrotissegetum和大螟Sesamiainferens等的Orco的氨基酸序列一致性分别为96.83%, 96.41%, 95.77%, 95.56%, 95.35%和95.14%;与其他目昆虫Orco氨基酸序列一致性较与鳞翅目的稍低,其中与黑腹果蝇Drosophilamelanogaster的Orco氨基酸序列一致性为75.30%(图1)。
系统进化树结果显示,二点委夜蛾Orco与同属夜蛾科的双委夜蛾的Orco亲缘关系最近,其次是与粘虫、疆夜蛾和黄地老虎的Orco,而与同属鳞翅目蚕蛾科的家蚕、菜蛾科的小菜蛾Plutellaxylostella和螟蛾科的二化螟Chilosuppressalis的Orco亲缘关系稍远,与双翅目的黑腹果蝇的Orco亲缘关系最远(图2),这与Orco氨基酸序列同源联配分析结果(图1)是相吻合的。

图1 二点委夜蛾与其他昆虫Orco的氨基酸序列比对Fig. 1 Amino acid sequence alignment of Orco proteins from Athetis lepigone and other insects 不同昆虫种的Orco及其GenBank登录号Orco proteins from different insect species and their respective GenBank accession numbers: Alep: 二点委夜蛾Athetis lepigone (AOE41007.1); Adis: 双委夜蛾Athetis dissimilis (KR632987); Psau: 疆夜蛾Peridroma saucia (AQY16413.1); Msep: 粘虫Mythimna separata (BAG71415.1); Hass: 烟青虫Helicoverpa assulta (ABU45983.2); Harm: 棉铃虫Helicoverpa armigera (XP_021195606.1); Sinf: 大螟Sesamia inferens (AGY14565.1); Aseg: 黄地老虎Agrotis segetum (AGS41440.1); Hvir: 苜蓿夜蛾Heliothis viriplaca (AFI25169.1); Slit: 斜纹夜蛾Spodoptera littoralis (ABQ82137.1); Hzea: 谷实夜蛾Helicoverpa zea (AAX14773.1); Sexi: 甜菜夜蛾Spodoptera exigua (AAW52583.1); Pxyl: 小菜蛾Plutella xylostella (XP_011558816.1); Csup: 二化螟Chilo suppressalis (AFQ94041.1); Bmor: 家蚕Bombyx mori (NP_001037060.1); Dmel: 黑腹果蝇Drosophila melanogaster (NP_524235.2). 图2同The same forFig. 2. 黑色阴影表示氨基酸序列100%一致性,灰色阴影表示序列80%一致性。The amino acid sequences with 100% identity are in black shade, while those with 80% identity are in grey shade.

图2 最大似然法构建的基于氨基酸序列的昆虫Orco 系统进化树(MEGA ver. 7.0.14, 1 000次重复)Fig. 2 Phylogenic tree of Orco proteins from different insect species based on amino acid sequences by maximum likelihood method (MEGA ver. 7.0.14, 1 000 replicates) 遗传距离以比例标尺表示。Genetic distance is indicated by scale bar.
2.2 二点委夜蛾Orco原核表达与Western blot分析
经终浓度为10 mmol/L的IPTG诱导,蛋白表达量最大(图3: A,泳道3),产生79 kD左右的特异性蛋白条带(图3: A, 泳道3, 4, 5),而未插入目的片段的pGEX-6P-1空载体经诱导产生26 kD大小的蛋白条带(图3: A, 泳道2)。以鼠抗GST标签单克隆抗体为一抗对表达产物进行Western blot分析,pGEX/AlepOrco经IPTG诱导产生约79 kD的蛋白条带与GST抗体发生了很强的交叉反应(图3: B, 条带以箭头标记),表明融合蛋白得到了有效表达。

图3 pGEX/AlepOrco的原核表达蛋白的SDS-PAGE (A) 和Western blot (B)分析Fig. 3 SDS-PAGE (A) and Western blot (B) analysis of the expressed protein of pGEX/AlepOrco in prokaryotic expression system M: 蛋白质分子量标准Protein molecular weight marker; 1: BL21阴性对照BL21 negative control; 2: pGEX-6P-1转化BL21的表达产物Expression product of pGEX-6P-1 in BL21; 3: IPTG终浓度为10 mmol/L时,pGEX/AlepOrco的表达产物Expression product of pGEX/AlepOrco induced by IPTG (10 mmol/L); 4: IPTG终浓度为20 mmol/L 时,pGEX/AlepOrco的表达产物Expression product of pGEX/AlepOrco induced by IPTG (20 mmol/L); 5: IPTG终浓度为40 mmol/L时,pGEX/AlepOrco的表达产物Expression product of pGEX/AlepOrco induced by IPTG (40 mmol/L); 6: IPTG终浓度为10 mmol/L时, pGEX/AlepOrco的表达产物(箭头标示)Expression product (marked by an arrow) of pGEX/AlepOrco induced by IPTG (10 mmol/L).
2.3 二点委夜蛾Orco多克隆抗体检测
Western blot检测结果显示,在二点委夜蛾的雌雄成虫触角蛋白中出现了53 kD左右的印迹(图4: 条带2和4),而在以免疫前兔血清作为一抗的对照中,在二点委夜蛾雌雄成虫触角中并没有检测到特异性条带(图4: 条带1和3)。表明所制备的多克隆抗体能够特异的识别二点委夜蛾成虫触角内的Orco蛋白。
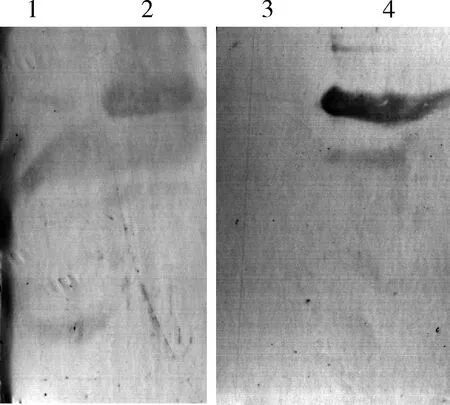
图4 Western blot检测抗体对二点委夜蛾雌雄成虫 触角中AlepOrco的特异性Fig. 4 Antibody specificity to AlepOrco protein in antennae of female and male adults of Athetis lepigone by Western blotting 1: 雌成虫触角(一抗为免疫前兔血清,作为对照)Antenna of female adults (preimmune serum was used as the primary antibodies for control); 2: 雌成虫触角(一抗为所制备的多克隆抗体)Antenna of female adults (anti-AlepOrco was used as the primary antibodies); 3: 雄成虫触角(一抗为免疫前兔血清,作为对照)Antenna of male adults (pre-immune serum was used as the primary antibodies for control); 4: 雄成虫触角(一抗为所制备的多克隆抗体)Antenna of male adults (anti-AlepOrco was used as the primary antibodies).
2.4 二点委夜蛾Orco在成虫不同组织中的表达
qPCR检测结果表明,AlepOrco在二点委夜蛾雌雄成虫(F=42.75,P<0.01)和不同组织间(F=112.41,P<0.01)存在显著的差异,AlepOrco在雌雄成虫不同组织中具有相似的表达模式,都是在触角中的相对表达量最大,在翅中的相对表达量最小。在雄成虫不同组织间,AlepOrco表达量差异显著(F=88.9,P<0.01),在雄成虫的触角中表达量最高,约是雌成虫触角中表达量的5.7倍;其次为在雄成虫的喙部,与其他组织相比,差异显著(P<0.05),足部次之,然后依次为腹部、胸部、去除触角和喙的头部,在翅中的相对表达量最低。AlepOrco在雌成虫不同组织间的表达量也不同(F=169.6,P<0.01),尽管与雄成虫具有相似的表达模式,但是,与在第2位的足部中的表达量相比,并没有达到显著差异(P>0.05),足部的相对表达量则显著大于喙部,其后依次为:在腹部中的相对表达量显著大于胸部中的,胸部中的相对表达量显著大于去除触角和喙的头部中的(P<0.05),去除触角和喙的头部中的相对表达量显著大于翅的(P<0.05)(图5)。

图5 qPCR分析AlepOrco在二点委夜蛾雌雄成虫不同组织中的表达谱Fig. 5 Expression profiles of AlepOrco in different tissues of female and male adults of Athetis lepigone detected by qPCR 图中数据为平均值±标准差;柱上不同大写字母和小写字母分别代表AlepOrco基因表达在雄成虫和雌成虫不同组织间的相对表达量的差异显著性(P<0.01, ANOVA和Duncan氏新复极差法);柱上ns、星号和双星号分别表示基因表达量在相同组织不同性别间差异不显著(P>0.05)、差异显著(P<0.05)和差异极显著(P<0.01)(t测验)。Data in theFigure are mean±SE. Different capital and lowercase letters above bars indicate significant differences in the gene expression level of male and female adults between different tissues (ANOVA and Duncan’s new multiple range test, P<0.01), respectively. ns, asterisk and double asterisk above bars represent no significant difference (P>0.05), significant difference (P<0.05) and extremely significant difference (P<0.01), respectively, in the gene expression level in the same tissue among different sexes (t-test).
3 讨论
本研究对二点委夜蛾的非典型嗅觉受体基因进行了克隆、原核表达和多克隆抗体制备,并明确了其在雌雄成虫不同组织内的分布,为将来利用RNAi或者基因编辑系统等深入研究其基因功能,明确其嗅觉分子机制,阐明其是否具有味觉功能奠定了基础。
序列比对分析表明,二点委夜蛾Orco与双委夜蛾Orco氨基酸序列的一致性高达99%,进化树分析结果也表明了二者亲缘关系最近(图1和2)。可能是因为二者同属鳞翅目夜蛾科委夜蛾属,具有相似的基因起源,研究表明,这两种昆虫具有相似地理分布及危害方式,常常在夏玉米田混合发生,都具有隐蔽危害习性(宋月芹等, 2015)。Orco在昆虫嗅觉神经嗅觉系统中广泛表达, 在不同目间高度保守(Kriegeretal., 2003; Bargmann, 2006)。本研究发现,二点委夜蛾Orco与鳞翅目的疆夜蛾、粘虫、草地贪夜蛾、烟青虫、黄地老虎、大螟等序列高度保守,一致性高达95%以上,与双翅目的黑腹果蝇的Orco关系较远,一致性为75%(图2)。
本研究原核表达了二点委夜蛾Orco开放阅读框蛋白,并利用回收的蛋白制备了多克隆抗体。经IPTG在37℃诱导下,经SDS-PAGE和Western blot检测结果证明,基因得到了有效表达(图3)。通过回收蛋白制备抗体过程中,发现所表达的蛋白主要以包涵体的形式存在于菌体沉淀中。这种不溶性蛋白质颗粒形式存在的表达产物,不具有生物学活性,今后的工作是尝试在真核表达系统(例如杆状病毒昆虫细胞表达系统)进行表达,以获得应用广泛的可溶性融合蛋白,并对AlepOrco基因的分子生物学功能进行深入研究。目前的研究,对抗体的利用主要在利用抗体组织定位方面,通过免疫组织化学方法在冈比亚按蚊Anophelesgambiae、埃及伊蚊Aedesaegypti和致倦库蚊Culexquinquefasciatus的触角、下颚须和喙中均检测到了Orco蛋白,通过进一步在3种蚊子的触角感受器进行定位发现蛋白主要分布在冈比亚按蚊触角鞭节除基部第1节部分的各节,不同的是埃及伊蚊和致倦库蚊Orco在所有鞭节上均有分布(Meloetal., 2004; Pittsetal., 2004; Xia and Zwiebel, 2006),且埃及伊蚊的Orco仅分布在第1鞭节的末端1/3处(Meloetal., 2004)。中华蜜蜂ApisceranaceranaOrco被定位在触角鞭节的板形感器和毛形感器上,且在毛形感器上较多(张林雅等, 2012; 张中印等, 2016)。本研究制备的抗体为在已经明确了二点委夜蛾触角感器种类的基础上(田彩红等, 2015, 2016)进行下一步的组织定位及功能研究奠定了基础。
本研究通过qPCR表明,AlepOrco在二点委夜蛾雄成虫触角中表达量最高,是在雌蛾触角中表达量的5.7倍(图5),该表达模式与多数昆虫Orco如双委夜蛾(宋月芹等, 2015),华山松大小蠹Dendroctonusarmandi(Zhangetal., 2016),中华蜜蜂(张中印等, 2016)等昆虫的表达分布情况一致。AlepOrco除了在触角中高表达之外,在去除触角和喙的成虫的头部、喙、胸、腹、足和翅中也有表达(图5),不同于同为鳞翅目的斜纹夜蛾,其Orco仅在触角中特异性表达(Dongetal., 2012),而与无花果黄蜂CeratosolensolmsiOrco(Luetal., 2009)、中华蜜蜂Orco(张林雅等, 2012)、桃蛀螟DichocrocispunctiferalisOrco(葛星等, 2013)和西方角蝇HaematobiairritansOrco(Olafson, 2013)的分布表达情况一致。尤其是在足部,AlepOrco表达量位于这7个组织中表达量的第2位(图5),与双委夜蛾Orco(宋月芹, 2015)相反,其在雄虫中表达量略大于雌虫中的,与致倦库蚊只在雄虫足中Orco的表达(Xia and Zwiebel, 2006)又有所不同。本研究发现,在二点委夜蛾雌雄成虫喙中AlepOrco的表达量仅次于在触角和足中的表达量,且在雄成虫喙部的表达量大于在雌成虫喙部的表达量,但无显著差异(图5),而同为鳞翅目的甜菜夜蛾SpodopteraexiguaOrco在雌雄蛾的触角和喙中也都有表达,但喙中表达量极低(张逸凡等, 2011)。直翅目的飞蝗Locustamigratoria和沙漠蝗Schistocercagregaria的成虫口器中也有Orco的表达(Yangetal., 2012), 说明在味觉感受器中Orco也有表达。我们在用扫描电镜研究二点委夜蛾触角及附肢的感器类型时,在二点委夜蛾的成虫喙部也观察了丰富的感器类型(田彩红等, 2015, 2016),而Krieger等(2002)利用原位杂交的方法在烟芽夜蛾的喙的感受器细胞中也检测到Orco, 进而推测,Orco在发挥嗅觉功能的同时是否行使了味觉功能,值得将来进一步研究。
本研究通过克隆和原核表达二点委夜蛾Orco基因,并制备了蛋白的多克隆抗体,并明确了在雌雄成虫不同组织内的分布,为将来利用RNAi或者基因编辑系统等深入研究其基因功能,明确其嗅觉分子机制,阐明其是否具有味觉功能奠定了基础。
致谢特别感谢美国密苏里大学崔英俊博士对本文做出的修改。
