纤维鞘皮下段在中心静脉再置管中的利用价值
2020-08-08何达苏姗娜陈芳程力张璜谢兰茜熊飞
何达 苏姗娜 陈芳 程力 张璜 谢兰茜 熊飞
430022 武汉,武汉市第一医院肾内科
血管通路是血液透析患者的“生命线”,近年中国成人慢性肾脏病的患病率为10.8%,肾脏替代治疗患者人数以每年11%以上的速度递增[1]。目前国内外血液透析患者首次透析通路使用导管比例过高,达到约80%[2]。同时,高龄及高透析龄患者不断增多,部分患者因血管条件差、血管资源耗竭或心功能差等原因无法建立及使用动静脉内瘘,只能依赖血液透析导管作为唯一透析通路[3]。一旦出现相关并发症如导管堵塞失功、导管脱落及导管感染等,必要时须予更换导管或拔除。武汉市第一医院血液透析中心在2012年9月至2019年6月期间,对部分特定血液透析导管并发症患者采用了经原导管纤维鞘皮下段再置入新导管的手术方式,现对其临床病例资料进行收集分析报道如下。
资料与方法
一、临床资料
本组共收集了21例患者,男性7例,女性14例,年龄范围24~87岁,平均(65.9±15.8)岁。原发病包括慢性肾炎5例,糖尿病肾病7例,高血压肾损害3例,药物性肾炎1例,多囊肾1例,狼疮肾炎1例,另有3例原发病不详。患者透析龄(0.3~73.7)个月,平均(27.7±24.0)个月。原血液透析导管类型为右颈内静脉临时导管5例,右股静脉临时导管1例,右颈内静脉长期导管15例。临时导管留置时间(0.6~2.2)个月,平均(1.0±0.6)个月;长期导管留置时间(3.9~59.9)个月,平均(23.7±17.5)个月。再次置管原因包括导管完全脱落11例(导管脱落时间4 h至3 d不等),导管相关性血流感染患者6例,长期导管双腔完全堵塞失功2例,另有2例导管为换管时异位穿刺不成功。
二、方法
1.术前评估及准备 完善常规检查,导管相关血流感染患者行血培养提示1例为沃氏葡萄球菌,1例患者为丝状真菌某种,1例为快生长分支杆菌,2例为嗜麦芽窄食单胞菌,另有1例患者血培养阴性。同时,拍摄X线片了解骨性标志与心脏及大血管关系,术前行血管超声检查了解动静脉血管情况及定位血管走行。21例患者均使用超声引导,其中1例使用超声+数字减影血管造影术(digital subtraction angiography,DSA)联合引导。血管超声检查发现19例患者均存在中心静脉留置导管后附壁血栓填充和或静脉严重狭窄,无法使用异位穿刺法再置入血液透析导管,2例患者异位穿刺失败后急诊改行该方法。
2.手术方法 (1)经临时导管纤维鞘皮下段再置管方法:患者平卧位,常规消毒铺巾,局部麻醉。以导管扩皮器于原导管皮肤出口部位探入(图1A),方向沿原导管纤维鞘皮下段走行,并指向目标中心静脉入口,以操作者手感为指引轻柔的向前输送扩皮器,待扩张器可轻松进入约3 cm后,同样使用轻柔力量以导丝弯头尝试经过扩皮器中空腔向中心静脉内输送(图1B),如扩张器或导丝遇到阻力切忌盲目前探,适当回撤,调节导丝及扩皮器方向,以类似腔内介入治疗时捻转抻拉及旋转导丝超选血管方式操作。一旦导丝可无阻力进入,则提示成功进入血管,继续向下轻柔输送导丝,直至导丝可无阻力深入约15~20 cm时,提示导丝可能已成功置入目标中心静脉。立即经超声或DSA明确导丝位置,一旦确认,则再置入导丝已成功(图1C),后续血液透析导管置管操作同通常更换导管操作。
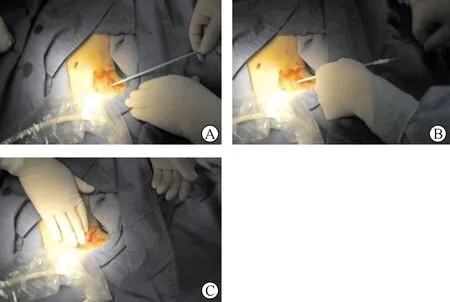
图1 经临时导管纤维鞘皮下段再置管 A.扩皮器探入皮肤入口;B.扩皮器探入后输送导丝;C.导丝到位
(2)经长期导管纤维鞘皮下段再置管方法:以右颈内静脉为例,因长期导管皮下隧道较长,因此操作方法与临时导管略有差别。患者平卧位,常规消毒铺巾,局部麻醉。触摸原皮下隧道走行,并于前长期导管皮下隧道近颈内静脉入口处(尽量靠近入口)纵行切开皮肤,游离原导管纤维鞘的皮下段,成功后于纤维鞘上壁行横切口(图2A),将扩皮器经横切口探入纤维鞘腔内(图2B),沿纤维鞘走行向颈内静脉方向深入,注意适当调整扩皮器纵轴方向以尽量靠近中心静脉纵轴。当扩皮器在纤维鞘内顺利走行约3~5 cm后,尝试经扩皮器输送导丝(图2C),方法略同临时导管,成功后撤出扩皮器(图2D),进行常规换管后续操作。

图2 经长期导管纤维鞘皮下段换管 A.游离原导管纤维鞘皮下段(非血管)并于鞘壁横切;B.探入扩皮器;C.扩皮器引导导丝进入;D.导丝到位
3.随访及疗效评定 术后使用导管透析并评估导管流量。导管流量≥250 mL/min,能顺利完成透析定义为导管功能良好;导管血流量<200 mL/min,无法完成透析治疗,定义为导管失功。置管后定期门诊及透析随访导管使用情况。
三、统计学处理
采用SPSS 22统计软件进行统计分析。计数资料用率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
结 果
21例患者中,20例(95.2%)手术取得技术成功,1例(4.8%)患者换管手术失败改行股静脉长期导管手术。成功患者中18例直接更换长期导管,2例先期更换为临时导管,后二期手术更换为长期导管。长期导管选用长度36~45 cm不等,长度根据实际测量所得,术中规划导管深度较原导管深入约1~2 cm以规避纤维鞘包裹。成功患者术后X线片复查导管位置正常,颈内静脉导管尖端投影位于第3前肋下至5前肋间不等,基本位于右心房中段水平上下。1例患者为股静脉导管脱出后再置入,置管后复查导管尖端进入下腔静脉。新置入导管透析中泵控血流量均可达250 mL/min及以上,观察2周透析血流量均可达250 mL/min及以上。换管术后并发症较少,主要为新长期导管皮下隧道少量渗血4例,予局部盐袋加压1~4 h后好转,另有1例术后一过性发热,对症治疗后热退无复发。本组无患者出现局部皮下大血肿、感染加重、肺栓塞等严重并发症。原导管相关性感染患者换管术后感染症状均较前好转,病情得到控制,透析时未再发热,复查血培养均阴性。术后随访,患者更换后长期导管使用时间85天~5年余不等。其中20例颈内静脉再置管患者与同期随访的经导丝颈内静脉原位更换长期导管者比较,两者无显著性差异。(表1)
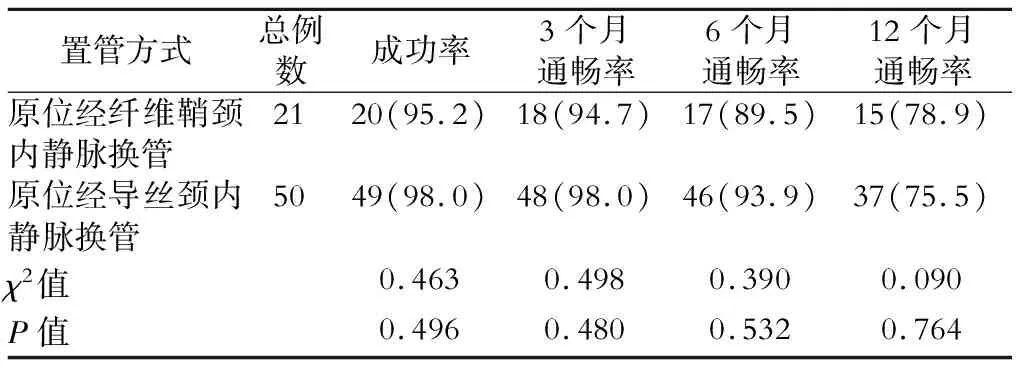
表1 不同置管方式成功率及预后的比较 例(%)
讨 论
目前常见的血液透析导管失功原因主要有血栓形成、纤维鞘包裹、导管相关性感染等[4-5],一旦出现内科治疗无法纠正的情况,则须进行导管更换或拔除。现有换管方法包括异位穿刺换管、导丝引导原位换管、球囊破坏纤维鞘后换管以及更换其他穿刺部位换管等[6-9]。异位穿刺换管需要目标血管仍存在一定管腔,可供导丝通过直至进入目标中心静脉。随着患者血液透析导管留置时间的延长,中心静脉血栓形成及狭窄在所难免[10],严重者甚至完全闭塞[11],仅剩下导管经纤维鞘包裹在血管腔中占位,此时已无异位穿刺可能。而对于原位导丝引导换管,需要原导管留置于血管腔内,通过其管腔引导导丝进入目标中心静脉,再行拔除原导管并更换新导管进入。如果发生原导管完全脱落,或出现导管腔完全堵塞,则导丝无法经原导管管腔进入中心静脉,此时原位换管也无法成功。另有一种特殊情况,即单纯导管相关性血流感染的患者,若无法异位穿刺换管,原位换管存在导丝全程通过原导管管腔时造成细菌沾染并定植于新导管可能性,从而危及新导管,尤其是病原菌顽固凶险的情况下。如遇以上情况,最终办法是放弃此处改换其他位置穿刺置管,造成有限的血管资源的进一步损失。
有研究表明纤维鞘在导管置入时即开始形成,最早7 d即可包裹导管[12]。另有动物实验研究显示中心静脉置管纤维鞘发生率为100%[13]。晚期纤维鞘由成纤维组织构成,质地坚韧,可包裹导管导致导管失功及拔管换管困难,国内外均有使用球囊扩张纤维鞘后更换导管及球囊扩张解除纤维鞘包裹的报道[14-15]。另外,血管外的皮下隧道段则出现肉芽组织生长,并最终形成纤维组织瘢痕包裹导管,该纤维瘢痕坚韧,通过导管一直延伸到静脉血管,与血管内纤维鞘相连。
在临床工作中,我们发现血液透析导管皮下段包裹的纤维组织相对坚韧,延伸至静脉入口,且随导管留置时间增加,其坚韧程度也不断增加,部分长期导管拔管以后遗留明显的条索状皮下隧道,切开皮下隧道可见其类似血管管腔构造,笔者认为此即沿血管管路向导管皮下隧道延伸的纤维鞘[6],我们亦曾截取小段纤维包裹组织送检,提示该组织为增生纤维组织伴玻璃样变性(图3)。我们还观察到,在部分临时导管留置一定时间后,表皮会向穿刺处皮下隧道移行,形成类似肚脐样结构,连接皮下的纤维组织管腔。上述两种纤维鞘皮下段不同的地方是临时导管纤维鞘皮下段短,走行直,长期导管纤维鞘皮下段走行弯曲,较长。基于以上研究及观察结果,我们尝试对于导管意外完全脱落的患者采用急诊手术经原导管纤维鞘皮下段再置入新导管,并取得成功,因此验证了我们的推测——纤维鞘皮下段与血管内纤维鞘通过血管入口相连接,随着时间推移形成一个完整的管腔并逐渐牢固,在导管完全脱落滑出后的一定时间内仍可维持其形态,在其塌陷后机化完全闭塞之前,我们仍有机会通过扩张器及导丝尝试进入中心静脉,完成再置管操作,其原理类似介入治疗开通闭塞塌陷血管。目前我们成功的经纤维鞘皮下段再置入导管的最长导管脱落时间为3 d,更长脱落时间的再置管操作尚需更多病例研究论证。
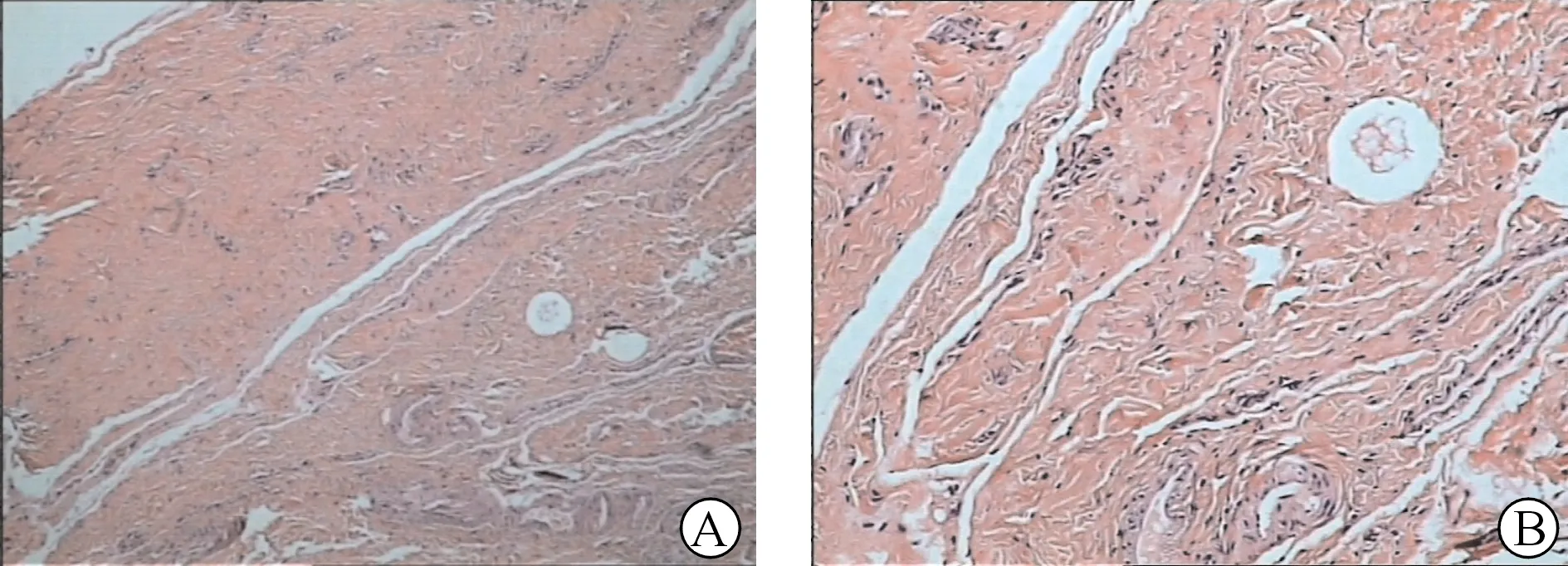
图3 长期导管周围的纤维包裹物送检结果 A.HE染色,光镜×100;B.HE染色,光镜×400
中心静脉置管风险相对较高,主要严重并发症为血肿压迫气管引起窒息死亡、穿破血管导致纵膈血肿及心包填塞以及血栓脱落造成致死性肺栓塞等[16]。对于经原导管纤维鞘皮下段再置入血液透析导管的方式,因导丝经纤维鞘直接进入中心静脉,不存在重新穿刺问题,因此避免了中心静脉和(或)临近动脉的穿刺损伤,大出血风险降至最低。另外多数导管为完全脱落,更换导管时不存在分离涤纶套情况,因此这部分出血并发症也得以规避。本研究患者换管后仅少数患者出现少量新皮下隧道渗血,无一例大出血并发症,也印证了这一点。血栓形成及脱落栓塞是中心静脉拔管和换管的另一并发症,严重者可能危及生命。采用该换管方式,导丝及扩皮器、新导管主要接触的是原导管纤维鞘,未直接接触导管外附壁血栓,且纤维鞘组织相对牢固,不易脱落,因此该方式换管血栓脱落风险亦较低。同样,基于皮下隧道纤维鞘的牢固程度相对较高,轻柔操作下由扩皮器钝性探入成功后再引导导丝沿血管内纤维鞘深入至目的地,导丝不易穿出纤维鞘到血管外,从而降低了导丝异位所致相关并发症风险。一旦导丝进入中心静脉,后续操作与原位经导管引导导丝换管一样,只需注意导管尖端位置稍突破纤维鞘顶端以获得更佳流量。我们比较的两组换管方式也显示两种换管方式无明显差异。对于单纯导管相关性血流感染患者,虽已有作者研究表明原位导丝引导换管并不增加新导管感染率[17-18],但部分严重感染患者仍建议拔除导管更换部位穿刺换管[19],以后该部位亦难以再次置管,这对于血管资源耗竭的患者而言相当于放弃了重要的中心静脉血管资源之一。我们分析考虑该方法因其由纤维鞘引导新导管进入,新导管与原导管腔完全不接触,可最大程度避免病原菌沾染,从而避免新导管感染,实际情况与我们分析推论相同,患者术后导管培养转阴,后续使用时间长,延长了该血管资源的使用寿命。因本组导管相关性血流感染患者更换导管例数较少,缺乏大样本长周期观察分析,虽成功率高,并发症少,但仍无法推荐为首选更换导管方法,后期仍需大样本研究确定其地位及选用次序。
超声及DSA介入引导可以提高中心静脉穿刺成功率,降低并发症[20-21],这一点同样适用于该置管方式。但须指出的是,该方法更换导管时,扩皮器引导导丝置入时,因血管管腔多为狭窄闭塞或窄塌陷状态无法清晰判断血管管腔,因此在此阶段超声引导及DSA引导无太大帮助,而更强调操作者需要有必要的腔内介入操作经验,手法须细腻,动作须轻柔,同时还需要注意力集中,感受导丝及扩皮器的触觉反馈,并有足够的耐心,毫不气馁的多次尝试,切不可暴力输送导丝及扩皮器。其次,之所以使用扩皮器“钝性”引导导丝进入血管而非直接使用导丝弯头或者尾端直头引导扩皮器,是因纤维鞘虽然相对牢固,但仍无自体血管壁的三层固有结构,因此任何锐性器械试探时仍存在损伤纤维鞘壁导致纤维鞘管腔破坏,形成迷路无法继续引导导丝进入血管的情况,而导丝弯头有一定宽度(约8 mm),对于相对狭小且已经塌陷的纤维鞘管腔,单纯使用导丝弯头难以通过,扩皮器形态介于两者之间,使用扩皮器头端尝试钝性通过纤维鞘腔道,既可以避免损伤纤维鞘壁又能顺利通过狭窄塌陷纤维鞘腔直至进入静脉入口。导丝打折及位置异常会导致导管功能不良[22]。一旦扩皮器引导导丝顺利进入后,则须使用超声或DSA透视检查明确导丝位置,排除导丝异位,如扫查锁骨下静脉排除导丝误入锁骨下静脉等;而使用DSA引导则可直观的引导导丝及导管进入目标中心静脉相应位置。本研究所有患者未出现导丝异位情况,术后X线检查显示导管投影位置均正常。
综上所述,经原导管纤维鞘皮下段再置入血液透析导管的方法作为一种特殊的置管方法,方便经济,成功率高,并发症少,对于特定的血液透析患者,如导管完全脱落、完全堵塞或单纯导管相关性血流感染等,可以作为异位穿刺换管及原位导管引导导丝换管的有益补充,有助于解决血管资源耗竭患者的血液透析通路问题,挽救濒临失功废弃的中心静脉,延长患者的透析寿命。因本研究病例数有限,更多经验有待收集更大样本数据并且长时间观察分析后得出。
