沙门菌Ⅰ型菌毛研究进展
2020-08-06吴青青彭先启吴小磊
吴青青,周 潇,彭先启,吴小磊,乐 敏
(浙江大学 动物预防医学研究所/浙江省动物预防医学重点实验室,浙江 杭州 310058)
沙门菌(Salmonella)是一种全球关注的人畜共患病病原菌,具有非常广泛的宿主谱,能引起人和动物肠道疾病或全身性疾病。因此,沙门菌的防控在医学、兽医学和公共卫生等领域均十分重要[1-2]。沙门菌依靠许多毒力因子在宿主体内生存、繁殖和扩散,如毒力岛(Salmonella pathogen islands,SPIs)、pSLT 毒力质粒、菌毛、鞭毛和生物被膜等。菌毛是细菌表面的纤细丝状结构,一般认为与细菌粘附宿主细胞和定植有关[3]。根据菌毛形态和凝集红细胞的能力,沙门菌菌毛主要分为4 类。Ⅰ型和Ⅱ型菌毛形态相似,Ⅰ型菌毛广泛分布于沙门菌属内,可以介导甘露糖敏感血凝反应(Mannose sensitive hemagglutination,MSHA);Ⅱ型菌毛只在少数沙门菌中发现,缺乏凝集红细胞的能力。Ⅲ型和Ⅳ型菌毛形态相似,较细而且容易弯曲,在甘露糖存在时仍可凝集鞣酸处理的红细胞[4]。另外还有两种体积差异较大且缺乏凝集红细胞能力的菌毛,按其主要亚单位蛋白大小命名为SEF14 和SEF17[5]。
沙门菌Ⅰ型菌毛(TypeⅠfimbriae)是菌体表面的一种粘附因子,参与介导细菌粘附多种细胞的过程,是沙门菌定植和侵袭宿主的关键,在沙门菌感染机体的初始阶段起着重要作用[6-7]。沙门菌Ⅰ型菌毛能促进生物被膜形成[8],且在天然免疫过程发挥着重要作用,还与鞭毛存在联系,能调节鞭毛基因表达和菌体运动。因此,Ⅰ型菌毛一直都是沙门菌致病性研究的热点。本文综述了沙门菌Ⅰ型菌毛的生物组成,还分析了沙门菌Ⅰ型菌毛蛋白对宿主、受体的粘附特性和生物被膜形成的影响,并且讨论了沙门菌Ⅰ型菌毛蛋白在先天免疫过程中对抗细胞吞噬、促进炎性细胞因子分泌和抑制细胞凋亡等方面的重要作用。
1 沙门菌Ⅰ型菌毛的结构组成
沙门菌Ⅰ型菌毛又称Fim 菌毛,由fim 基因簇编码(图1)[9],其中fimA、fimI、fimC、fimD、fimH、fimF 编码菌毛结构蛋白和组装蛋白[10],在fimA启动子控制下构成一个操纵子结构域,fimZ、fimY、fimW 和stm0551 负责调控结构基因的转录和表达[11-12]。FimA亚单位以右手螺旋方式单一重复缠绕形成菌毛轴,FimH 是重要的粘附素蛋白,位于菌毛的尖端,可直接参与宿主细胞相互作用[13]。沙门菌Ⅰ型菌毛属于伴侣推进途径(Chaperone usher pathway,CUP)菌毛,FimC 和FimD 分别是菌毛组装的伴侣蛋白和推进蛋白。菌毛各个亚基蛋白分泌到细胞周质,通过伴侣蛋白FimC 催化折叠并组合形成FimC-蛋白复合物,FimD 通过其胞质氨基末端结构域FimDN特异性识别该FimC-蛋白复合物,催化其跨膜与装配,并释放游离的FimC(图2)[14]。
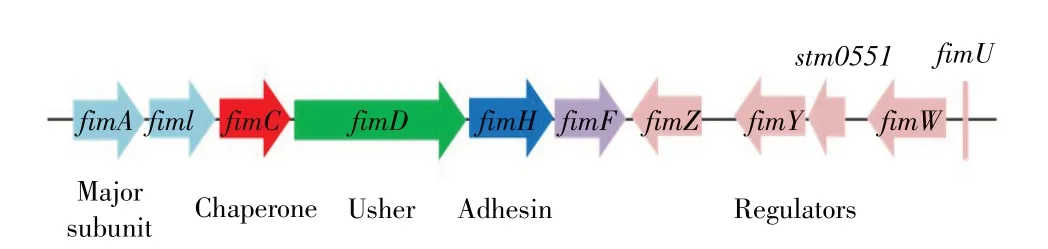
图1 沙门菌fim 基因簇结构图Fig.1 fim gene cluster of Salmonella
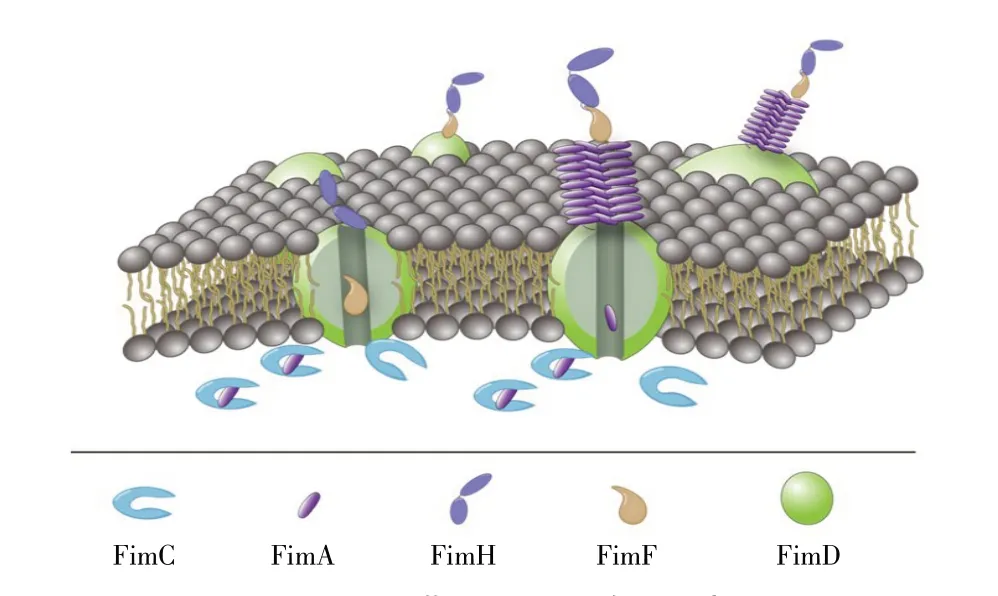
图2 I 型菌毛结构和装配示意图Fig.2 Structure and assembly of type I fimbriae
2 沙门菌Ⅰ型菌毛的功能与调控
2.1 Ⅰ型菌毛的粘附功能沙门菌Ⅰ型菌毛能介导细菌对真核生物细胞膜的特异性粘附,细胞膜糖蛋白末端通常带有各种寡糖残基,其中甘露糖残基是最常见的组分。粘附素蛋白FimH 位于菌毛尖端,能与甘露糖受体以化学键形式特异性结合,介导细菌粘附宿主细胞,为进一步入侵机体创造条件[15]。Hancox 等发现鼠伤寒沙门菌(S.typhimurium)fimH 基因突变能导致细菌出现不粘附且不产生Ⅰ型菌毛的表型[16],Dibb-Fuller 研究了肠炎沙门菌野生型菌株和Ⅰ型菌毛缺失株对上皮细胞INT-407 的粘附和侵袭作用,发现Ⅰ型菌毛缺失株的粘附和侵袭能力都比野生型菌株弱[17]。因此笔者认为FimH 作为菌毛粘附素蛋白对菌毛完整性和粘附功能都是必需的。
越来越多的研究显示,不同宿主来源和不同血清型的Ⅰ型菌毛FimH 有高达99%的序列同源性,但微小的氨基酸序列差异就能显著影响它们与甘露糖的结合。Kisiela 研究了33 个不同血清型沙门菌的FimH,比较了各FimH 的氨基酸序列差异,并且根据其对甘露糖化BSA 的粘附特性分为高粘附、低粘附和无粘附特性三类,整和三类沙门菌FimH 序列差异,系统分析后发现多数低粘附特性的FimH 在改变几个特定的氨基酸后能转变为高粘附特性的FimH,高粘附特性的FimH 再改变几个氨基酸残基后转变为无粘附特性[18]。笔者推测特殊的氨基酸变化可能影响FimH 多肽与其他Ⅰ型菌毛亚基的相互作用,从而影响菌毛合成,并改变细菌粘附特性。
Ⅰ型菌毛粘附蛋白FimH 的序列差异能改变菌毛对甘露糖受体的粘附特异性。通常,鸡伤寒沙门菌(S. gallinarum)Ⅰ型菌毛是甘露糖耐受(Mannose resistance,MR)菌毛,在凝集红细胞和酵母细胞时不能被D-甘露糖抑制。然而当鸡伤寒沙门菌Ⅰ型菌毛FimH 粘附素第78 位氨基酸从苏氨酸突变为异亮氨酸后,导致菌毛MR 结合特性丧失[19]。Guo 等人研究发现鸡伤寒沙门菌Ⅰ型菌毛FimH 粘附素MR 表型改变能够导致菌毛受体特异性的变化[20]。肠炎沙门菌(S. enteritidis)的Fim 菌毛是甘露糖敏感(Mannose sensitive,MS)菌毛,可以介导甘露糖敏感血凝反应,表达FimHS.Enteritidis的鸡伤寒沙门菌感染鸡过程中,肝脏、脾脏和盲肠的细菌定植量减少,甚至没有细菌定植[21],再次证明了fimH 等位基因特殊氨基酸变异在沙门菌宿主细胞特异性方面有显著影响[22]。有研究发现,Ⅰ型菌毛粘附蛋白FimH 的序列差异能决定各种血清型沙门菌对不同物种和组织细胞的粘附趋向性[23],并以宿主特异性方式介导沙门菌与特定细胞系的结合。在最近的一项研究中,Yue 等人收集了1848 株不同宿主来源的沙门菌,发现猪来源的猪伤寒沙门菌(S.typhisuis)和猪霍乱沙门菌(S.choleraesuis)的FimH 能更好地结合猪IPEC-1 和IPEC-J2 细胞,而人来源的伤寒沙门菌(S. typhi)和纽波特沙门菌(S. newport)的FimH 能更好地结合人源的RKO、HCT116 和Caco-2 细胞,牛来源的都柏林沙门菌(S.dublin)的FimH 更好地结合牛C8 和CMS细胞,家禽来源的鸡伤寒沙门菌FimH 更好地结合禽类LMH 细胞[24]。另外,Schifferli 研究小组分析了从牛、猪和人宿主分离的纽波特沙门菌菌株fimH 等位基因变体,并比较细菌对相同宿主来源细胞系的粘附作用[25-26]。结果表明,牛和猪来源的纽波特沙门菌的FimH 变体,第15 位氨基酸为苯丙氨酸,第32 位为丙氨酸,第89 位为精氨酸,与牛源(CMS,J8)和猪源(IPEC-J2)的细胞系结合更好;人源纽波特沙门菌的FimH 的第15 位氨基酸为亮氨酸,第32位为缬氨酸,第89 位为谷氨酰胺,其与人源细胞系(RKO,Caco-2)的结合比牛源或猪源细胞系更好。
2.2 Ⅰ型菌毛参与生物被膜形成细菌生物被膜(Biofilm)是指细菌附着于物体表面,分泌大量多聚糖基质和蛋白并将自身包绕其中而形成的生物群落。形成生物被膜的细菌比游离细菌具有更强的耐药性,并且能吸引游离的细菌,迅速扩大容量并由此向外传播,常常导致感染迁延不愈和急性发作[27]。Ledeboer等发现鼠伤寒沙门菌BJ2710 fimH 基因缺失株在HEp-2 细胞上不能形成生物被膜,也不能在鸡肠道组织上形成生物被膜[28]。因此,Ⅰ型菌毛对沙门菌在细胞和组织上生物被膜的形成有较大作用。
沙门菌有1 000 多个不同血清型,但是这些血清型中fimH 的等位基因的变异程度目前尚不清楚。Dwyer 等分析了来自14 种不同沙门菌血清型的fimH等位基因差异,与菌株SL1344 的FimH 相比,各个血清型FimH 都存在氨基酸差异,而且各血清型的变化都不相同。作者还比较了Ⅰ型菌毛介导的细菌在甘露糖化蛋白Man-BSA 上形成生物被膜的能力,发现仅有4 个菌株(3 株鼠伤寒血清型,1 株纽波特血清型)的FimH 能促进细菌在Man-BSA 上形成生物被膜。另外,鼠伤寒沙门菌菌株8704 和鸭伤寒沙门菌(S.anatum)两者FimH 仅有5 个氨基酸的差异,在感染Hep-2 细胞24 h 后表达菌株8704 FimH 的SL1344 能形成大面积的生物被膜,但是表达鸭伤寒沙门菌FimH 的SL1344 只形成少部分的生物被膜[29]。
鼠伤寒沙门菌SL1344 和LB5010 的FimH 只有两个氨基酸不同,位于第61 和118 位。Boddicker 发现菌株LB5010 在HEP-2 细胞上培养48 h 后能形成广泛的生物被膜,但是SL1344 菌株在HEP-2 细胞上几乎没有检测到。当SL1344 菌株FimH 第61 位甘氨酸和第118 位苯丙氨酸分别替换为和LB5010 FimH 一样的丙氨酸和丝氨酸后,感染HEP-2 单层细胞24 h后能形成大量的生物被膜。若只将SL1344 菌株FimH 第118 位定点突变,感染HEP-2 细胞能形成少量分散的生物被膜;只将FimH 第61 位定点突变,出现较广泛的生物被膜,而且比野生株和只突变第118 位氨基酸的菌株范围广泛。小鼠感染实验的结果和细胞实验结果一致,这些结果表明FimH 第61位氨基酸的差异影响细菌在Hep-2 细胞和生物体肠道上皮组织上形成生物被膜,第118 位氨基酸的差异则起到协同促进作用[30]。生物被膜的形成过程复杂,受多种因素的影响,但首先需要菌毛帮助菌体粘附并固定到合适的位置,再形成生物被膜。因此,笔者认为沙门菌Ⅰ型菌毛可能是通过粘附特性差异对生物被膜产生影响的。
2.3 Ⅰ型菌毛诱导宿主先天免疫反应鼠伤寒沙门菌经口腔感染后定植于小肠,最先被M 细胞(Membranous/Microfold cell)摄取。M 细胞存在于淋巴滤泡上皮之间,与肠道上皮细胞紧密排列在一起形成上皮屏障,能通过胞吞作用将粘膜表面的抗原转运到组织淋巴系统中。Hase 等发现鼠伤寒沙门菌I型菌毛FimH 能特异性结合M 细胞膜上的转胞吞作用受体糖蛋白2(Glycoprotein 2,GP2),细菌FimH或宿主GP2 缺失都能导致M 细胞胞吞细菌作用消失,从而导致派尔氏集合淋巴结中抗原特异性免疫应答减弱[31]。因此,FimH 对M 细胞摄取沙门菌是必需的,并且影响特异性粘膜免疫应答反应。Guo 等研究表明树突状细胞(Dendritic cells,DC)通过与沙门细菌Ⅰ型菌毛粘附素FimH 相互作用从而靶向鼠伤寒沙门菌进行细胞摄取[32]。DC 细胞是机体功能最强的专职抗原递呈细胞(Antigen presenting cells,APC),它能高效地摄取、加工处理并递呈抗原给T细胞,构成了先天免疫和适应性免疫之间的联系。表达Ⅰ型菌毛的鼠伤寒沙门菌比没有Ⅰ型菌毛表达的fimH 突变菌株粘附鼠骨髓源DC 细胞的能力更强,且fimH 突变菌株与DC 细胞的结合和内化都减弱。所以细菌在与DC 细胞相互作用时需要FimH 存在,即FimH 是联系宿主抵抗沙门菌先天免疫和适应性免疫的重要因子。
FimH 是先天抗菌反应的有效诱导剂,通过粘膜表面的Toll 样受体-4(Toll-like receptors-4,TLR4)发出不同的信号[33]。Uchiya 等发现感染fimH 突变株的巨噬细胞中白细胞介素-1β(IL-1β)mRNA 水平低于感染野生型沙门菌的巨噬细胞。FimH 重组蛋白处理后的巨噬细胞能激活丝裂原活化蛋白激酶(Mitogen-activated protein kinase)和核转录因子kappa B(Nuclear factor-kappa B,NF-κB)信号传导途径,导致IL-1β 和其他促炎细胞因子,如白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)的表达。Kuzminska 等研究发现,野生肠炎沙门菌感染鼠肠细胞ICE-1 分 泌 的IL-1b、IL-6、IL-10 和IL-12b 细 胞 因子水平比感染fimH::kan 突变菌株的更高[34]。TLR4 对革兰氏阴性菌脂多糖LPS 的有效识别需要LPS 结合蛋白CD14 和活化蛋白MD-2 组成信号复合物MD-2/CD14,通过MD-2/CD14 协同作用,使LPS 作用于TLR4,从而诱导随后的信号响应[35]。Uchiya 的研究结果显示MD-2/CD14 对介导沙门菌FimH-TLR4 相互作用是必需的,FimH只能刺激TLR4和MD-2/CD14都表达的HEK293 细胞,不能刺激仅表达TLR4的HEK293 细 胞。此 外,FimH 诱 导IL-1β 表 达 能被TLR4 抑制剂TAK-242 所抑制。上述结果证明鼠伤寒沙门菌FimH 是一种病原相关分子模式(Pathogen-associated molecular patterns,PAMP), 在MD-2 和CD14 同时存在时才被TLR4 识别,并在沙门菌感染巨噬细胞中对促炎细胞因子的表达起重要作用[36]。
最近,有研究者通过X 射线衍射解析了FimA 蛋白晶体结构,并发现FimA 能作为上皮细胞凋亡的抑制剂[37]。细胞凋亡是多细胞生物抑制胞内病毒和细菌病原体繁殖的重要先天反应。为了成功感染宿主,细菌病原体通过抑制感染期间宿主细胞的凋亡信号传导来对抗宿主细胞的凋亡反应[38-39]。线粒体外膜透化(Mitochondrial outer membrane permeabilization,MOMP)是细胞凋亡过程中细胞色素c 从线粒体释放到胞质溶胶的最关键也是最后一步[40]。Bax(BCL-2 associated x protein)是Bcl-2(B-cell CLL/Lymphoma 2)促凋亡蛋白家族的成员之一,在诱导细胞凋亡时位于或转移到线粒体外膜,并负责创建释放细胞色素c 的蛋白孔道来穿透线粒体外膜[41]。Sukumaran 等揭示了沙门菌Ⅰ型菌毛蛋白FimA 参与的抗细胞凋亡机制[42]。他们研究发现稳定表达FimA 的HCT116 人结肠癌细胞在凋亡刺激下Bax 与线粒体外膜的整合延迟,说明菌毛蛋白FimA 能有效抑制Bax介导的线粒体细胞色素c 的释放。电压依赖性阴离子通道(Voltage-dependent anion channel,VDAC)是线粒体外膜上控制物质进出的通道,在凋亡信号刺激下能与Bax 形成VDAC-Bax 通道[43],促进细胞色素c 释放。在细菌感染早期阶段,FimA 通过与线粒体外膜上的VDAC 结合而靶向线粒体。FimA 能增强VDAC 与己糖激酶(Hexokinase,HK)的相互作用,防止由凋亡刺激引发的VDAC-HK 解离,抑制VDAC-Bax 通道形成从而抗细胞凋亡。
2.4 Ⅰ型菌毛的表达与调控在沙门菌Ⅰ型菌毛合成过程中,有3 个主要的调节蛋白FimZ、FimY 和FimW(图3)。FimZ 和FimY 能单独地正向激活fimA启动子(PfimA),并且可以形成FimY-FimZ 蛋白复合物以调节其他菌毛基因[44],FimW 通过抑制fimZ 的转录来下调fim 基因表达。fimU 编码稀有精氨酸转运RNA tRNAArg,fimU 的缺失能抑制FimY 的翻译,从而抑制Ⅰ型菌毛产生。新发现的调控基因stm0551 位于fimY和fimW之间,对Ⅰ型菌毛起负调节作用。另外,其他因子如亮氨酸应答调节蛋白(Leucine-responsive regulatory protein,Lrp)也能参与Ⅰ型菌毛的调控表达[45]。
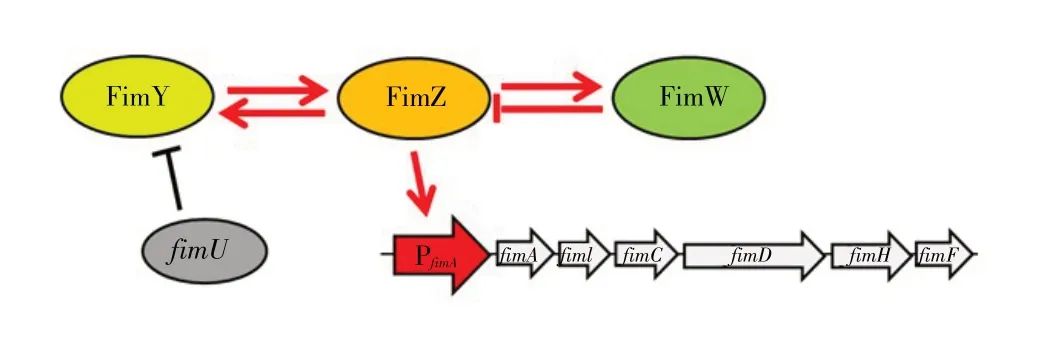
图3 Fim 菌毛调控通路Fig.3 Regulatory pathway of type I fimbriae
FimZ 是Ⅰ型菌毛表达的主要激活因子,能直接结合到fimA 启动子区域。Yeh 的研究证实FimZ 是Ⅰ型菌毛轴亚单位FimA 表达所必需的,fimZ 的突变能减少FimA 的表达[46],他们还发现FimZ 的结合位点在fimA 转录起始位点上游第47 至98 个核苷酸之间,该区域存在一对7 bp 的串联重叠序列。另外,在fimZ 转录起始位点也存在相同的串联重叠序列,说明FimZ 可能也参与调节自身表达,但这种调节机制尚不明确。有研究发现Lrp 能调控FimZ,从而间接影响鼠伤寒沙门菌Ⅰ型菌毛合成[45]。此外,鼠伤寒沙门菌中FimZ 的过表达会导致鞭毛操纵子flhDC的下调,使细菌缺乏运动性[11,47]。Wang 等发现FimZ和FimY 之间存在物理上的蛋白质相互作用,他们认为在Ⅰ型菌毛的调节通路中,FimY 作为DNA 结合蛋白激活fimZ,并且可形成FimY-FimZ 蛋白复合物以调节其他fim 基因表达,并且发现fimY 基因缺失株的Ⅰ型菌毛轴亚单位蛋白FimA 表达量下降,和fimZ 突变株相似[44]。
FimW 是沙门菌Ⅰ型菌毛的负调控因子,能对FimZ 起到干扰作用[48]。Zeine 提出,FimW 与FimZ 存在直接相互作用,能通过阻止FimZ 与fimA 启动子结合来下调Ⅰ型菌毛表达[49]。Saini 认为,FimZ、FimY和FimW 三者存在负反馈通路[12],两个Ⅰ型菌毛激活因子FimZ 和FimY 的表达由FimW 负向控制,但其确切机制尚未阐明。Wang 等研究发现,当沙门菌LB5010 感染巨噬细胞RAW264.7 后,侵袭到细胞内的菌体的fimA 和fimZ 基因转录水平降低,fimW 的转录水平上升,fimY 不变[50],这些结果和上述结论一致。
沙门菌Ⅰ型菌毛基因簇中fimU 编码tRNAArg[51],在菌毛蛋白翻译过程中产生作用。fimY 中有许多由tRNAArg识别的稀有精氨酸密码子(AGA),fimY mRNA 的 翻 译 强 烈 依 赖 于tRNAarg 的 存 在[52]。fimU 的缺失能抑制FimY 的翻译,从而抑制鼠伤寒沙门菌中的Ⅰ型菌毛合成。另外,位于fimY 和fimW 之间的新基因stm0551,编码磷酸二酯酶(PDE),对鼠伤寒沙门菌Ⅰ型菌毛起负调节作用[53]。
3 展 望
目前为止,有关沙门菌Ⅰ型菌毛功能的研究近几年虽陆续有相关文章报道,但是相比较大肠杆菌Ⅰ型菌毛结构和功能的研究,仍有许多问题值得深入研究,本实验室表达了沙门菌Fim 菌毛的多个结构蛋白并制备了多抗血清,为后期菌毛蛋白结晶和晶体结构的解析打下良好基础。Rafal 等总结了20 多项沙门菌Ⅰ型菌毛和动物感染模型的研究结果[54],发现Ⅰ型菌毛缺失株在感染小鼠时毒力增强,这和本实验室fimH 基因缺失株感染秀丽隐杆线虫(Caenorhabditis elegans)的实验结果一致,该结果是由细菌其他毒力因子如生物被膜相关基因的表达上调引起的,但具体机制还有待探究。另外,沙门菌Ⅰ型菌毛粘附素FimH 参与先天免疫应答的多个过程,还具有粘膜佐剂的能力[55],值得更深层次挖掘开发。对沙门菌Ⅰ型菌毛进行深入系统地研究有助于揭示其相关生物信息和作用机制,这将对未来沙门菌的防控和利用发挥着重要作用。
