WzxE 蛋白影响鸡白痢沙门氏菌致病性的研究
2020-08-06张志强张艳英杜万年吴同垒李蕴玉李佩国
张志强,张艳英,葛 成,王 苗,杜万年,莘 余,吴同垒,索 勋,李蕴玉*,李佩国*
(1. 河北科技师范学院 河北省预防兽医学重点实验室,河北 秦皇岛 066004;2. 中国农业大学 动物医学院,北京 100094)
O 抗原位于革兰氏阴性菌的最外表面,是具有保护性作用的一种细菌结构。该结构由短的重复的寡糖单元(O 单元)组成,每个寡糖单位含有3~8 个不等的单糖分子[1]。寡糖单位组成和分布的多样性造成了不同种属甚至同一细菌的抗原性差异,同时也是内毒素LPS 的组成成分,其在细菌致病过程中发挥关键作用[2-3]。革兰氏阴性菌O抗原的合成是一个复杂的过程,涉及Wzx/Wzy 途径40 多种酶的参与[4]。细菌首先于细胞内膜表面合成寡糖单位,利用wzx编码的外翻酶将寡糖单元转移至周质间隙,在wzy编码聚合酶作用下进行O 抗原侧链的合成,侧链的组成和长度由wzz 编码蛋白调控;合成的O 抗原在waaL 基因编码的连接酶的作用下结合到脂多糖(LPS)脂质A 核心上,通过Lpt 途径转运到细胞外膜表面[5-6]。
Wzx 翻转酶介导O 抗原合成原料的转运,是O抗原合成的起始和关键环节,前期有研究将Wzx 基因簇缺失,会导致细菌O抗原产量下降以及细菌生长速度的减缓,揭示了其在细菌生长中的重要作用[1]。Wzx 基因簇由多个基因组成[7],不同的基因发挥何种作用尚不明确。本研究聚焦该基因簇的wzxE 基因,拟通过同源重组方法构建其缺失菌株,通过分析wzxE 基因缺失菌株的生物学特性变化,揭示WzxE翻转酶的生物学功能。
1 材料与方法
1.1 菌株、质粒及主要试剂λ-Red 同源重组系统(包括pKD46、pKD3 和pCP20 质粒)由扬州大学朱国强教授惠赠;鸡白痢沙门菌参考菌株ATCC19945 由吉林省出入境检验检疫局王伟利研究员惠赠。1 日龄白来航雏鸡,由河北科技师范学院实验牧场提供。
细菌基因组提取试剂盒购自北京艾德莱生物科技有限公司;LATaq DNA 聚合酶预混液(2×)、限制性内切酶及T4 连接酶均购自TaKaRa 公司;细菌脂多糖(LPS)提取试剂盒购自贝博生物技术有限公司;银染试剂盒购自碧云天生物科技有限公司;SDS-PAGE 凝胶试剂盒和ECL 化学发光液购自康维世纪生物技术有限公司。
1.2 λ-Red 同源重组引物的设计根据NCBI 登录的白痢沙门菌基因组序列(CP012347.1)设计引物(表1),P1/P2 用于扩增含有氯霉素基因的打靶片段;P3/P4 为RT-qPCR 引物,用于缺失株的转录水平鉴定。P5/P6 用于缺失株的PCR 鉴定;P7/P8 用于构建回补菌株,P9/P10 为RT-qPCR 沙门菌内参基因GMK 引物。
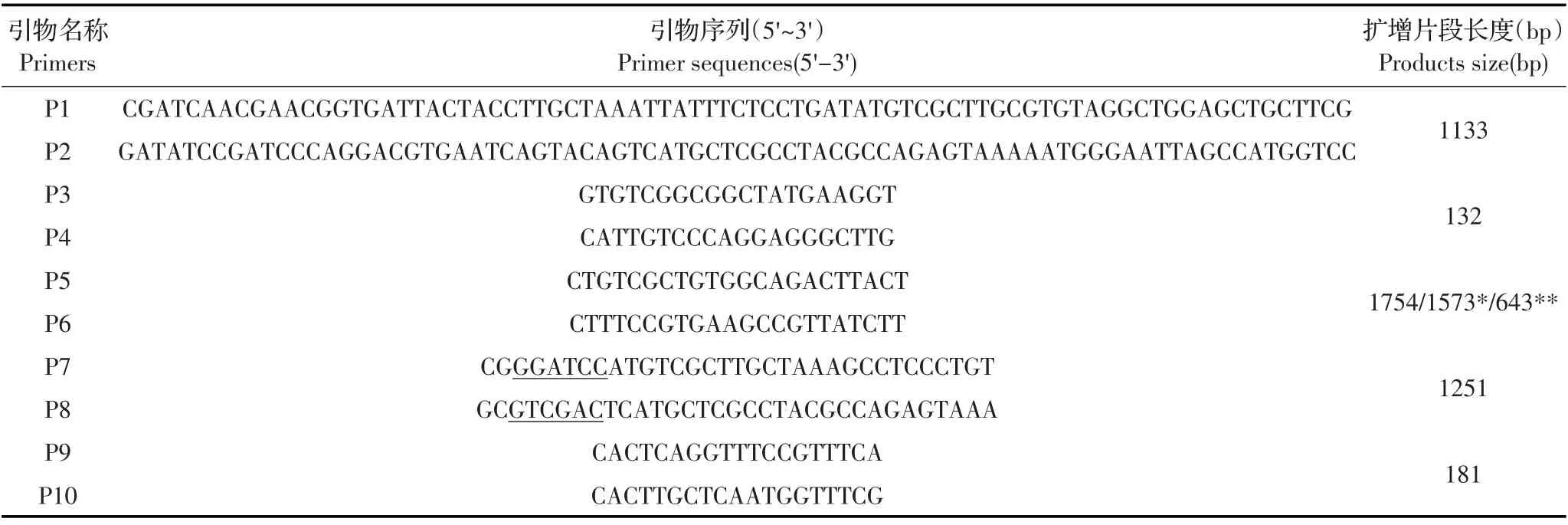
表1 本研究用到的引物Table 1 Primers used in this study
1.3 沙门菌wzxE基因缺失株及回补菌株的构建参照文献[8],利用同源重组方法从白痢沙门菌ATCC19945 基因组中敲除目的基因wzxE,得到基因缺 失 菌 株ATCC19945ΔwzxE。利 用PCR(P5/P6)和RT-qPCR(P3/P4)方法鉴定基因缺失菌株,并对其进一步测序鉴定。
以提取ATCC19945 基因组为模板,利用P7/P8引物扩增wzxE 基因,将其克隆至pBR322 质粒。将构建的重组质粒转化至基因缺失菌株中,构建回补菌株pBR322-wzxE/ATCC19945ΔwzxE。文中分别用缩写字母WT(Wild type)、KO(Knock-out)和RS(Recomplemented strain)代表本文涉及的野生型菌株、wzxE 基因缺失株以及回补菌株。
1.4 沙门菌生长特性检测分别将白痢沙门菌3 个菌株接种液体LB,37 ℃过夜培养后以1∶50 比例转接新鲜LB 或M9 培养基,37 ℃培养;每隔2 h 吸取菌液样品,测定其OD600nm值,绘制3 种菌的生长曲线。
1.5 沙门菌对环境应激抵抗力的测定利用盐酸调整生理盐水至pH 3.5,同时向生理盐水中添加H2O2至终浓度为10 mmol/L。参照文献[9],分别检测白痢沙门菌3 个菌株在酸性应激条件(pH 3.5 生理盐水处理1 h)和氧化应激条件(10 mmoL/L H2O2处理20 min)下的存活情况。对应激条件下的细菌培养物进行计数,计算3 种菌的存活率(存活菌数/处理前菌数×100%)。试验重复3 次,实验数据统计采用prism 5.0 软件分析。
1.6 wzxE 对白痢沙门菌蛋清存活能力的影响参照文献[10],将白痢沙门菌3 个菌株培养物分别稀释至2×103cfu/mL~4×103cfu/mL 后分别加入1.5 mL 蛋清液中充分混匀,于不同时间对各培养物进行计数,计算其存活率。
1.7 细菌对1 日龄雏鸡致病力的检测参照文献[11],利用1 日龄雏鸡模型评价白痢沙门菌WT、RS和KO 株致病力。将160 只雏鸡随机分为4 组,包括3个实验组和1个对照组,实验组每组50只,分别以1×105cfu、1×106cfu、1×107cfu、1×108cfu、1×109cfu 的剂量肌肉注射白痢沙门菌3 个菌株,每一剂量10只;对照组10 只,接种等体积PBS。连续观察2 周并统计死亡情况,根据改良寇氏法计算各菌株对雏鸡的LD50。
1.8 wzxE 对白痢沙门菌LPS 的表达影响参照文献[12],利用细菌LPS 提取试剂盒提取白痢沙门菌WT 和KO 株的脂多糖成分。将提取的各菌株脂多糖在15%的凝胶内进行SDS-PAGE 凝胶电泳,凝胶充分洗涤后,利用银染试剂盒染色,检测wzxE 对白痢沙门菌LPS 的影响。同时设置考马斯亮蓝染色对照,排除蛋白污染情况。
2 结 果
2.1 鸡白痢沙门菌KO 株的构建利用鉴定引物P5/P6 对鸡白痢沙门菌野生型菌株、一次重组菌株、二次重组菌株进行PCR 鉴定。结果显示,野生型菌株扩增片段大小约为1 800 bp(ATCC 19945),一次重组菌株扩增片段约为1 600 bp(ATCC 19945::cat),二次重组菌株扩增片段约为600 bp(ATCC 19945ΔwzxE),均与预期相符(图1);对二次重组菌株PCR 鉴定产物进行测序,以及利用P3/P4 引物qRT-PCR 方法进一步验证了wzxE 基因缺失株ATCC 19945ΔwzxE 正确构建。
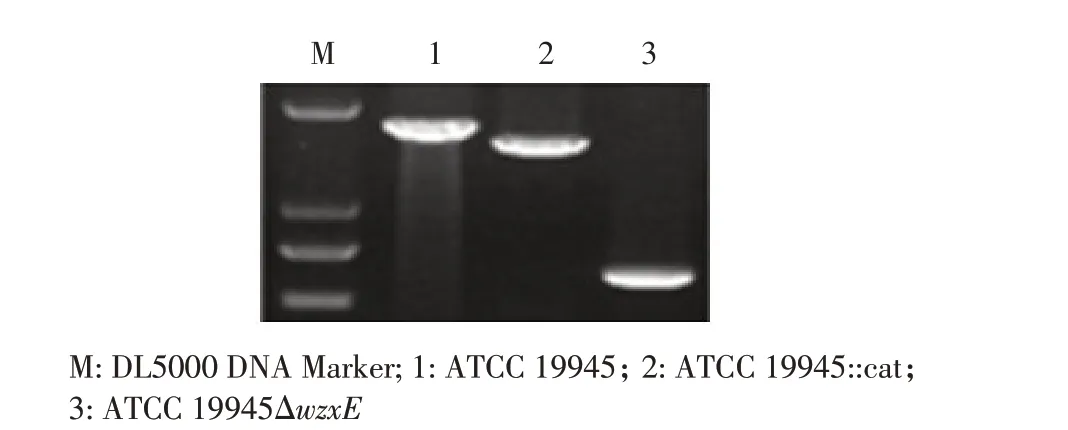
图1 鸡白痢沙门菌KO 株的PCR 鉴定Fig.1 Identification of the wzxE gene deletion in Salmonella Pullorum by PCR
2.2wzxE基因缺失对鸡白痢沙门菌生长特性的影响将鸡白痢沙门菌3 个菌株分别接种LB 培养基和M9 培养基,测定其不同时间点OD600nm值,绘制其生长曲线。结果显示,无论是在普通LB 培养基中还是营养相对缺乏的限制性培养基M9 中,3 株细菌的生长速度均未呈现明显差异(图2)。表明,wzxE 基因缺失不影响鸡白痢沙门菌的生长。

图2 鸡白痢沙门菌ATCC19945 相关菌株生长曲线测定Fig.2 Growth characteristics of ATCC 19945 related strains
2.3wzxE基因缺失对白痢沙门菌应对酸性和氧化应激的影响分别测定鸡白痢沙门菌各菌株在酸性和氧化应激条件下的存活情况。结果显示,在pH 3.5的生理盐水作用下,KO株的存活情况明显低于WT 和RS,同时RS 较WT 回复明显(图3A);同样的,KO 株耐受H2O2的能力也显著低于WT 株和RS 株(图3B),回补之后得到明显回复。上述结果表明,wzxE缺失影响鸡白痢沙门菌在酸性和氧化应激条件下的生存。

图3 环境应激对wzxE 基因缺失株生长的影响Fig.3 Effects of environmental stress on the growth of wzxE gene deficient strains
2.4 wzxE 对鸡白痢沙门菌蛋清中存活能力的检测结果分别测定鸡白痢沙门菌各菌株在蛋清内的存活率。结果显示,鸡白痢沙门菌WT 株能够抵御蛋清的杀伤作用,随着孵育时间延长,菌量稍有下降;而wzxE基因缺失后,白痢沙门菌在蛋清内的存活能力下降明显,在第6 h和第9 h,存活率仅为17%和13%;回补株应对蛋清杀伤的能力得到部分恢复(图4)。上述结果表明wzxE基因影响白痢沙门菌在蛋清的存活。

图4 wzxE 基因缺失对ATCC19945 菌株在蛋清中存活率的影响Fig.4 Viability of wzxE gene deficient strains in egg white
2.5wzxE基因缺失对白痢沙门菌毒力影响分别将鸡白痢沙门菌各菌株感染1 日龄雏鸡,计算其对雏鸡的LD50。结果显示,鸡白痢沙门菌WT、KO 和RS 株LD50分别为1.65×108cfu、4.67×108cfu和3.43×108cfu,变化不大。表明wzxE 基因缺失对白痢沙门菌毒力影响较小。
2.6 wzxE 对白痢沙门菌LPS 表达的影响提取白痢沙门菌各菌株LPS,利用银染方法观察2 株菌LPS条带。结果显示,考马斯亮蓝染色未在LPS 样品中检出条带,表明提取的LPS 无蛋白污染;银染结果显示,2 株细菌LPS 电泳条带的带型类似,但缺失株LPS 条带与野生型和回补株相比条带浓度减小(图5)。表明wzxE 不影响白痢沙门菌LPS 总体成分构成,但影响特定LPS 特定寡糖单位的含量。

图5 白痢沙门菌LPS 提取及染色分析Fig.5 Extraction and staining analysis of LPS of ATCC19945 related strains
3 讨 论
Wzx 基因簇是细菌内介导寡糖单位向周质间隙转运的一类基因的总成,其编码蛋白具有多样性,有研究证实这种多样性是造成细菌O 抗原多样性的重要原因[13-14]。针对wzx 基因簇的研究已有部分报道,其功能不断被解析,但具体到该簇基因的每个基因功能还有待挖掘。本研究即利用基因缺失和生物学特性分析方法针对该簇的wzxE 基因功能进行挖掘。
前期有研究表明wzx 基因簇不仅能够影响细菌O 抗原的产量,还会影响细菌的生长[1],其机制尚不明确。因此本研究首先检测了wzxE 基因缺失对白痢沙门菌生长的影响,结果显示wzxE 缺失并未影响细菌的生长,说明影响细菌生长的是wzx 基因簇中的其它基因。
O 抗原作为细菌外膜的构成成分,同时具有保护作用[15]。为此,本研究也检测了wzxE 缺失后的白痢沙门菌自我保护能力是否发生变化。本实验分析了白痢沙门菌在感染过程中可能遇到的最大的两种应激:酸性应激和氧化应激,这两种应激是白痢沙门菌经过消化道感染以及胞内寄生所无法避免的挑战[16]。结果显示,wzxE 基因缺失后白痢沙门菌应对酸性应激和氧化应激的能力显著下降。鸡白痢能够得以广泛传播,并且难于防控的一大诱因在于其能够经卵垂直传播。鸡蛋的蛋清内含有大量的杀菌物质,如溶菌酶类和转铁蛋白,能够有效的实施对卵内微生物的有效杀伤[8]。在长期的进化中,鸡白痢沙门菌能够使这些杀菌物质的杀伤作用得以存活,O 抗原在其中发挥了一定作用。前期有研究发现将O 抗原合成重要基因waaL 缺失会导致沙门菌在蛋清内的存活能力显著下降[15],那么wzxE 缺失是否会影响白痢沙门菌的蛋内存活呢?本研究结果显示,wzxE 基因缺失后,白痢沙门菌在蛋清内的存活能力显著下降。
LPS 是革兰氏阴性菌的重要毒力因子,由脂质A、胞外多糖以及O 抗原组成[2]。有研究表明作为O抗原合成的主要途径,wzx、wzy、waaL 等任一基因簇缺失都会严重影响细菌LPS 的生成[14]。但是O 抗原的合成途径十分复杂,涉及到40 余种酶的参与,具体到每一种酶对细菌LPS 合成的影响有较大差异,如wzxB[14]、wzyB[14]、waaL[15]、wbaV[17]基因的缺失均会引起细菌LPS 的显著变化,而wzzE 则并不影响细菌LPS 的合成[18]。本研究同样检测了wzxE 对白痢沙门菌LPS 的影响,银染结果显示,wzxE 不影响白痢沙门菌LPS 的总体构成,但影响不同寡糖单位的丰度。这与前人研究证实wzxE 并不是转运所有的寡糖单位,而是有针对性的转运不含侧链的寡聚3,6-二脱氧甘露糖[14]的结论一致。LPS 影响革兰氏阴性细菌的致病力,前期已有多种研究表明O 抗原合成涉及的部分酶与细菌毒力相关,如waaL、wzzE 基因缺失后细菌毒力下降明显[15,18]。Wzx 基因簇与细菌毒力的密切关系已被证实[1],但其中每个基因与细菌的毒力关系如何,尚不明确,本研究评估了wzxE 基因缺失菌株的毒力情况,结果显示,wzxE 基因缺失后,白痢沙门菌对雏鸡的LD50仅下降约3 倍,表明该基因对鸡白痢沙门菌致病性影响不大。
本研究构建了鸡白痢沙门菌wzxE 基因缺失菌株并对其部分生物学特性进行分析,确认了wzxE 与细菌抗应激、蛋清存活、LPS 合成以及细菌致病力间的密切关系,为白痢沙门菌致病机制研究以及防控提供了参考。
