3 种TLR 配体对猪圆环病毒2 型病毒样颗粒疫苗佐剂活性的比较
2020-08-06李洋洋王亚杰张鑫宇夏晓莉孙怀昌
李洋洋,宗 扬,程 健,王亚杰,张鑫宇,夏晓莉,孙怀昌,2*
(1. 扬州大学 兽医学院/江苏省重要动物疫病与人兽共患病协同创新中心,江苏 扬州 225009;2. 江苏农牧科技职业学院 江苏省兽用生物制药高技术研究重点实验室,江苏 泰州 225300)
猪 圆 环 病 毒2 型(Porcine circovirus type 2,PCV2)是猪圆环病毒相关疾病(Porcine circovirus-associated disease,PCVAD)的主要病原,目前在世界范围内流行,给养猪业国家造成很大的经济损失[1]。该病主要靠疫苗接种进行控制,可用疫苗包括灭活苗、重组亚单位疫苗和病毒样颗粒(Virus-like particle,VLP)疫苗,但均需与免疫佐剂配合使用。尽管油乳剂等传统免疫佐剂相对安全,但不能有效诱导抗病毒感染重要的细胞免疫应答。新型水包油包水佐剂的免疫佐剂活性较全面,但使用成本较高[2]。因此,新型免疫佐剂研制是预防兽医学的重要研究课题。
Toll 样受体(Toll-like receptor,TLR)是一类重要的模式识别受体,通过与病原相关分子模式结合能刺激细胞因子产生和促进抗原提呈细胞活化,在先天性和获得性免疫中发挥重要的桥梁作用,因此TLR 配体是很有开发前景的新型免疫佐剂[3]。本实验室在前期研究中以类弹性蛋白多肽(Elastin-like polypeptide,ELP)为融合标签,在重组大肠杆菌中表达了PCV2 Cap 蛋白,纯化的ELP-Cap 融合蛋白能形成典型的VLP,具有较强的免疫原性,有望作为PCV2新型亚单位疫苗被进一步开发。细菌脂蛋白、鞭毛蛋白和热应激蛋白分别是TLR2、TLR5和TLR2/4的配体,也是很有应用前景的新型分子佐剂[4]。为了研制PCV2 VLP 候选疫苗的新型佐剂,本研究利用重组大肠杆菌分别表达了脑膜炎奈瑟菌Ag473 脂蛋白、创伤弧菌FlaB 鞭毛蛋白和结核分枝杆菌热应激蛋白70(Hsp70),并将这些重组蛋白分别与PCV2 VLP 候选疫苗混合进行小鼠免疫试验,旨在筛选获得合适的分子佐剂。
1 材料与方法
1.1 主要实验材料重组菌pET-Hsp70/E. coli、pET-FlaB/E. coli 和pELK-Ag473/E. coli 由 本 研 究 室 构建,其中pET-Hsp70/E.coli 和pET-FlaB/E.coli 表达产物分别为His-Hsp70 和His-FlaB 融合蛋白,pELK-Ag473/E.coli 表达产物为ELK16 自聚肽融合蛋白(ELK-Ag473);ELP-Cap 融合蛋白形成的PCV2 VLP 候选疫苗以及Cap-His 融合蛋白由本实验室制备;小鼠IFN-γ、TNF-α和IL-4 ELISA 试剂盒均购自武汉博士德生物公司;辣根过氧化物酶(HRP)标记的羊抗鼠IgG(IgG-HRP)购自生工生物工程(上海)有限公司;病毒RNA/DNA 快速纯化试剂盒购自宝生物工程(大连)有限公司;镍琼脂糖凝胶购自北京康为世纪生物科技有限公司;6 周龄SPF 级BALB/c 小鼠购自扬州大学比较医学中心。
1.2 重组蛋白的表达与纯化将本实验室前期构建的重组菌pET-Hsp70/E. coli、pET-FlaB/E. coli、pELK-Ag473/E.coli 分别培养至OD600nm约0.6 时加入终浓度0.2 mmol/L 的IPTG,37 ℃诱导表达6 h,设不加IPTG 诱导对照;离心菌体,沉淀菌体用PBS 洗涤后,经 细 菌 裂 解 液(50 mmol/L Tris-HCl,pH 8.0,2 mmol/L EDTA,1 mmol/L DTT,0.5% Triton X-100,5%甘油)悬浮,超声波充分破碎、离心后收集离心上清(可溶性表达)和沉淀(包涵体表达),按照镍琼脂糖凝胶说明书纯化各重组蛋白,可溶性蛋白直接在非变性条件下纯化,包涵体经8 mol/L 尿素溶解后在变性条件下纯化,纯化后的各重组蛋白经SDS-PAGE 检测。
1.3 小鼠免疫及样品采集将36 只6 周龄雌性BALB/c 小鼠随机分为6 组(N=6),免疫方案见表1,初免后14 d 加强免疫1 次,方法相同。初免后每周眼眶静脉丛采血分离血清,-80 ℃冻存。
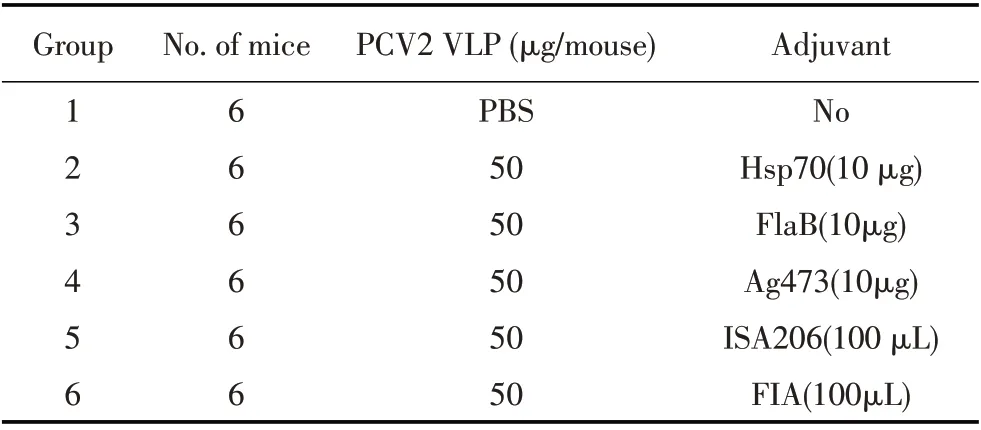
表1 本研究的小鼠免疫方案Table 1 Mouse immunization protocol in this study
1.4 免疫小鼠Cap蛋白特异性抗体的ELISA检测以Cap-His 融 合 蛋 白(5 μg/mL,100 μL/孔)为 包 被 抗原,待测血清用抗体稀释液按1∶100 稀释,每孔加入100 μL,以羊抗鼠IgG-HRP(1∶10 000)为二抗,利用ELISA 方法检测1.3 中收集的各组血清,P/N≥2.1 时判定为阳性。
1.5 免疫小鼠脾细胞培养及细胞因子检测初免后28 d每组随机断颈迫杀3只小鼠,无菌操作摘取小鼠脾脏,按常规方法收集培养各组小鼠脾细胞,各组分别加Con A(10 μg/mL)和Cap-His 融合蛋白(10 μg/mL),37 ℃刺激72 h 后4 ℃、3 000 r/min 离心10 min,收集细胞培养上清液,利用TNF-α、IFN-γ和IL-4 ELISA试剂盒分别检测各组小鼠的各细胞因子水平。
1.6 攻毒小鼠的病毒血症检测初免后28 d 后对各组小鼠腹腔注射200 μL/只(104TCID50/mL)PCV2 进行攻毒试验,分别于攻毒后7 d 和14 d 眼眶静脉丛采血分离血清,采用病毒RNA/DNA 快速纯化试剂盒提取DNA,参照文献[5]中荧光定量PCR 检测各组小鼠血液中PCV2 DNA 拷贝数。
2 结 果
2.1 重组蛋白的表达与纯化各重组菌经IPTG 诱导表达重组蛋白,SDS-PAGE 分析显示,pET-Hsp70/E.coli 重组菌表达了31 ku His-Hsp70 融合蛋白,表达产物为包涵体;pET-FlaB/E. coli 重组菌表达了32 ku His-FlaB 融合蛋白,表达产物为可溶性蛋白;pELKAg473/E. coli 重组菌表达了41 ku ELK-Ag473 融合蛋白,表达产物为包涵体。经镍琼脂糖凝胶纯化后,SDS-PAGE 凝 胶 经Bio-Rad Image Lab software 条 带分析,结果显示纯化的His-Hsp70、His-FlaB 和ELK-Ag473 融合蛋白条带比例分别为94%、91.3%和91%(图1)。表明正确表达并纯化得到3 种与预期相符的重组蛋白。
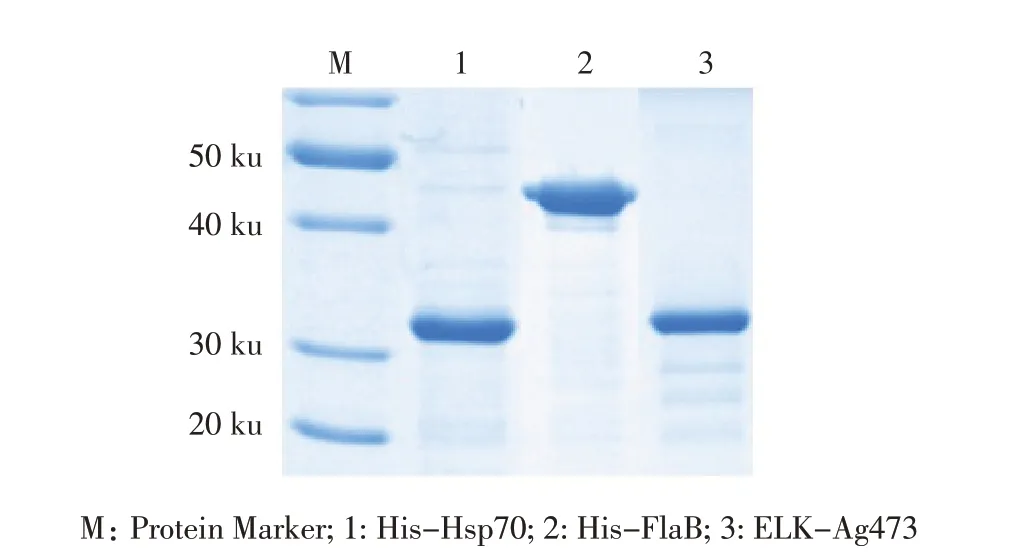
图1 3 种纯化融合蛋白的SDS-PAGE 分析Fig.1 SDS-PAGE analysis of three purified fusion proteins
2.2 免疫小鼠抗体测定结果采集小鼠首免后第7 d、14 d、21 d、28 d 血清,ELISA 检测Cap 蛋白特异抗体水平,结果显示从首免后7 d 起,各免疫组小鼠均为PCV2 Cap 蛋白特异抗体检测阳性(P/N≥2.1),抗体水平随免疫时间延长呈明显的上升趋势,28 d各组小鼠抗体水平达到最高值;其中Ag473 佐剂组小鼠的特异性抗体水平最高(OD450nm=1.627),HSP70佐 剂 组 次 之(OD450nm=1.513), FlaB 佐 剂 组 较 低(OD450nm=1.435);与未免疫组相比,各佐剂组小鼠抗体水平差异显著(p<0.05);与商品化佐剂组相比,3个分子佐剂组小鼠的抗体水平均低于ISA206 佐剂组但高于不完全弗氏佐剂(FIA)组,Ag473 佐剂组与ISA206、FIA 组相比差异不显著(p>0.05)(图2)。结果表明,Ag473 佐剂组小鼠能够产生较高的PCV2 Cap 特异性抗体,免疫佐剂活性最强。

图2 免疫小鼠的Cap 蛋白特异抗体检测Fig.2 Detection of PCV2 Cap-specific antibodies in immunized mice
2.3 免疫小鼠细胞因子检测结果免疫小鼠脾细胞经ConA 或ELP-VLP 刺激后72 h,利用ELISA 检测细胞培养上清中各细胞因子浓度。结果显示,与未免疫对照组相比,5 个免疫组的TNF-α、IFN-γ表达水平显著升高(p<0.05),且ELP-VLP 刺激组高于ConA刺激组。在3 种分子佐剂中,Ag473 佐剂组的TNF-α、IFN-γ浓度高于HSP70、FlaB 两组,差异显著(p<0.05);与商品化佐剂相比,Ag473 佐剂组的TNF-α、IFN-γ浓度低于ISA206 佐剂组但高于FIA 佐剂组,差异显著(p<0.05)(图3、图4)。细胞因子IL-4 检测结果显示,ConA 刺激后各免疫组的IL-4水平很低,与未免疫组相比差异不显著;ELP-VLP刺激Ag473 佐剂组产生的IL-4 浓度最高,HSP70 和FlaB佐剂组次之,与未免疫组相比差异显著(p<0.05),ISA206、FIA 佐剂组不产生高水平的IL-4(图5)。结果表明Ag473 佐剂组能够刺激产生较强的抗原特异性细胞免疫应答,能够诱导平衡的Th1/Th2 免疫应答,而商品化佐剂不能诱导免疫小鼠产生Th2 免疫应答。
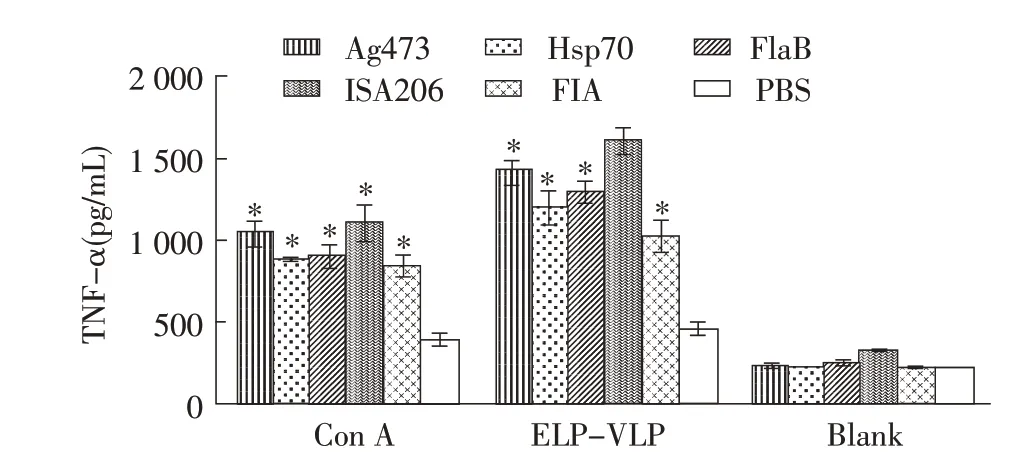
图3 免疫小鼠脾细胞的TNF-α表达检测Fig.3 Detection of TNF-α expression in splenocytes of immunized mice
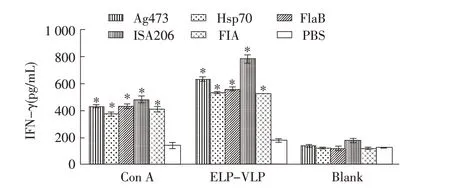
图4 免疫小鼠脾细胞的IFN-γ表达检测Fig.4 Detection of IFN-γ expression in splenocytes of immunized mice

图5 免疫小鼠脾细胞的IL-4 表达检测Fig.5 Detection of IL-4 expression in splenocytes of immunized mice
2.4 攻毒小鼠的病毒血症检测在攻毒后7 d 和14 d 采血分离血清,利用荧光定量PCR 检测血清中PCV2 基因组DNA 拷贝数。结果显示在攻毒后7 d,5 个免疫组的病毒DNA 拷贝数均较未免疫对照组显著降低(p<0.05);攻毒后14 d,未免疫对照组的病毒滴度为5.4±0.18 log10/mL,5 个免疫组小鼠的病毒DNA 拷贝数均显著下降,其中Ag473 佐剂组下降最明 显,为2.9±0.08 log10/mL(图6)。结 果 表 明,Ag473 作为佐剂能显著提高VLP 疫苗的抗病毒能力,并且强于商品化佐剂ISA206 和FIA。

图6 免疫攻毒小鼠的病毒血症检测Fig.6 Viremic detection of immunized mice after PCV2 challenge
3 讨 论
VLP 具有天然病毒粒子的空间构象和与相似的免疫原性,容易被机体免疫系统识别,从而诱导良好的免疫应答,是很有应用前景的新型重组亚单位疫苗[6]。本实验室在前期研究中以ELP 为纯化标签,利用重组大肠杆菌表达了ELP-Cap 融合蛋白。该重组蛋白经VLP 装配缓冲液溶解后,不仅能组装成典型的VLP,而且经小鼠免疫试验证明具有良好的免疫原性。为了获得PCV2 VLP 候选疫苗的分子佐剂,本研究选择佐剂活性较强的膜炎奈瑟菌Ag473 脂蛋白、结核分枝杆菌Hsp70 和创伤弧菌FlaB 鞭毛蛋白进行重组大肠杆菌表达研究。为了减少纯化标签对重组蛋白折叠和佐剂活性的影响,本研究先将3 个细菌蛋白与组氨酸标签(6×His)进行融合表达,SDS-PAGE 分析结果显示His-Hsp70 和His-FlaB 融合蛋白不仅表达水平较高,而且镍层析柱纯化的蛋白纯度大于90%。然而,His-Ag473 融合蛋白却未获表达,通过反复摸索诱导温度、IPTG浓度等条件也未获成功,因此本研究改用ELK16 标签进行融合表达。ELK16 是由16 个谷氨酸、亮氨酸或赖氨酸组成(LELELKLKLELELKLK)的自聚肽,在水溶液或大肠杆菌中可自动装配成蛋白凝聚物即活性包涵体,因此其融合蛋白可用离心洗涤法纯化[7]。SDS-PAGE 分析结果显示,尽管重组菌的ELKAg473 融合蛋白表达水平较高,但离心洗涤获得的蛋白纯度很低,可能与Ag473 脂蛋白影响自聚肽装配有关。不过,ELK-Ag473 融合蛋白C 端保留了组氨酸标签,最终用镍柱层析法获得了纯度很高的ELK-Ag473 融合蛋白。
本研究选择的膜炎奈瑟菌Ag473 脂蛋白、结核分枝杆菌Hsp70 和创伤弧菌FlaB 鞭毛蛋白均为TLR配体[8],其中Ag473 脂蛋白是TLR2 的配体,并能与TLR1 或TLR6 相互作用,从而发挥很强的免疫佐剂活性[9]。结核分枝杆菌Hsp70 是TLR2 和TLR4 的配体,不仅可刺激Th1 和Th2 细胞因子产生,还能增强抗原提呈细胞活性和细胞免疫应答[10]。创伤弧菌FlaB 是TLR5 的配体,具有很强的粘膜免疫佐剂活性[11]。尽管此3 种TLR 配体的佐剂活性均有报道,但其作用机制不同,对不同抗原的佐剂活性可能也有所差异。因此,本研究使用相同剂量的PCV2 VLP候选疫苗,利用相同剂量的3 种分子佐剂进行小鼠免疫试验。结果显示在测试的3 种分子佐剂中,Ag473 脂蛋白的体液和细胞免疫佐剂活性均较强,不仅能刺激小鼠脾细胞产生较高水平TNF-α 和IFN-γ等Th1 细胞因子,还能产生较高水平的IL-4等Th2 细胞因子。另外,ELK-Ag473 融合蛋白的强佐剂活性还可能与ELK16 标签有关,因为自聚肽能利用非共价键的相互凝聚作用,使其融合蛋白形成纳米级颗粒,以便被抗原提呈细胞摄取[12]。与ELK-Ag473 融合蛋白相比,His-Hsp70 融合蛋白的免疫佐剂活性较弱,可能需要与疫苗抗原融合表达有关[9]。在比较测试的3 种分子佐剂中,His-FlaB 融合蛋白的免疫佐剂活性最低,可能与其粘膜免疫佐剂性质有关,需要通过粘膜途径才能发挥较强的免疫佐剂活性[10]。
本研究结果显示,尽管ELK-Ag473 融合蛋白刺激产生的Th1 细胞因子(TNF-α和IFN-γ)表达水平略低于新型ISA206 佐剂,但明显优于FIA 的细胞免疫佐剂活性。另外,ELK-Ag473 融合蛋白刺激Th2 细胞因子(IL-4)产生不仅优于FIA,而且优于ISA206佐剂。这些研究结果进一步证明Ag473 融合蛋白能诱导平衡的Th1/Th2 免疫应答。更为重要的是免疫小鼠攻毒保护检测结果显示,ELK-Ag473 佐剂组的PCV2 病毒血症滴度下降与目前最好的ISA206 佐剂组接近或略高。由于ELK-Ag473 融合蛋白可利用重组大肠杆菌自行表达,与ISA206 佐剂相比可能具有明显的价格优势,因此有望作为PCV2 VLP 等重组亚单位疫苗佐剂被进一步开发。
