非洲马瘟病毒可视化RT-LAMP 现场检测方法的建立
2020-08-06李富祥赵文华杨仕标
李富祥,赵文华,杨仕标
(云南省畜牧兽医科学院 云南省热带亚热带动物病毒病重点实验室,云南 昆明 650224)
非洲马瘟(African horse sickness,AHS)是AHS病毒(AHS virus,AHSV)引起马属动物的一种急性或亚急性高致死性虫媒(库蠓)传染病,该病以发热、呼吸系统和血液循环系统的病理变化为特征。到目前为止,共发现9 个血清型的AHSV。马、骡、斑马和犬对AHSV 均易感[1],其中,马的致死率可超过90%[2],给养马业造成严重危害。AHS 主要在北非、南非、西非(塞内加尔,尼日利亚和冈比亚)和南欧的一些国家爆发和流行[3]。世界动物卫生组织(OIE)将AHS 列为法定报告的动物疫病,我国将其列为一类动物疫病和重点防范的外来动物疫病。目前虽然我国尚无AHSV 感染病例的报道,但随着马相关体育竞技、悠闲娱乐、健身等活动逐渐增多,以及国际国内赛马和马术赛日益频繁,我国存在AHS传入风险。因此,建立快速诊断检测方法对于防止AHS传入我国具有重要意义。
目前,国内外AHS 病原诊断方法有病毒分离鉴定[4]、RT-PCR[5-6]、荧光定量RT-PCR[7-8]等。国外也建立了基于扩增曲线判定反应结果的AHSV 血清群特异性反转录环介等温扩增方法(Reverse transcription loop-mediated isothermal amplification, RTLAMP)[9],但该方法只能在实验室进行检测;而国内建立的RT-LAMP 方法[10]仅可检测少数几个血清型AHSV,可用于全部9 个血清型AHSV 的RT-LAMP现场检测方法未见国内外报道。本研究根据AHSV VP7 基因保守序列设计型特异性引物,并通过全部9 个血清型AHSV RNA 特异性验证,建立AHSV 血清群特异性可视化RT-LAMP 检测方法,以期为我国AHS 的早期快速现场诊断以及马的出入境提供技术储备。
1 材料与方法
1.1 病毒、核酸及临床样品9 个血清型AHSV(AHSV-1~9)均来自南非Onderstepoort 兽医研究所AHS 参考实验室制备的灭活冻干疫苗; 蓝舌病病毒16 型(Bluetongue virus type 16,BTV-16)RNA 由云南出入境检验检疫局艾军博士惠赠;马流感病毒(Equine influenza virus, EIV)、马传贫病毒(Equine infectious anemia virus,EIAV)和 马 动 脉 炎 病 毒(Equine arteritis virus,EAV)的RNA 均由中国农业科学院哈尔滨兽医研究所相文华研究员惠赠;30份马血样品来自内蒙;5份马血和5份驴样品血来自云南。
1.2 主要试剂柱式病毒RNA 抽提纯化试剂盒购自生工生物工程(上海)股份有限公司;Bst 2.0 WarmStart DNA polymerase 购 自New England Biolabs 公司;PrimeScript One Step RT-PCR Kit Ver.2、AMV 反转录酶和dNTP Mixture 均购自宝生物工程(大连)有限公司;硫酸镁(MgSO4)、甜菜碱(Betaine)和氯化锰(MnCl2)均购自北京索莱宝科技有限公司;钙黄绿素(Calcein)购自合肥巴斯夫生物科技有限公司。
1.3 引物设计利用DNAStar 软件包中的MegAlign软件对本实验室保存的9 个血清型AHSV 以及NCBI中AHSV VP7基因(KM820855)序列进行对比分析,选择保守序列,以南非AHSV-4 HS32/62 10S-10BHK-3LP-5Vero-1S 分离株的VP7 基因为靶基因,利用在线 软 件PrimerExplorer 4(http://primerexplorer.jp/elamp 4.0.0/index.html)设 计1 对 外 引 物(AHSV-F3/ AHSVB3)和1 对内引物(AHSV-FIP/AHSV-BIP),引物序列见表1。参考文献[6]合成AHSV 普通RT-PCR 引物I-VP7-1:CTTTTGTCACCGTTGATGGAG/I-VP7-2:AGC ACAAGAGCTCTGTTGAT(扩增片段415 bp,退火温度56 ℃)。引物均由北京擎科生物科技有限公司昆明分公司合成。
表1 AHSV RT-LAMP 引物序列Table 1 The primers sequences of AHSV RT-LAMP
1.4 可视化RT-LAMP 反应体系及反应条件的优化参考文献[11-12]的RT-LAMP 反应体系设立25 μL基础反应体系:ddH2O 8.8 μL、10×Isothermal amplification buffer 2.5 μL、dNTP Mixture(10 mmol/L)1.5 μL、Bst 2.0 WarmStart DNA polymerase(8 U/μL)1 μL、AMV(5 U/μL)0.5 μL、Betaine(10 mol/L)2 μL、MgSO4(100 mmol/L)1.5 μL、 Calcein(200 μmol/L)3 μL、MnCl2(25 mmol/L)0.8 μL、 AHSV-F3(20 μmol/L)0.6 μL、AHSV-B3(20 μmol/L)0.6 μL、AHSV-FIP(20 μmol/L)0.6 μL、AHSV-BIP(20 μmol/L)0.6 μL 和AHSV RNA 模板1 μL。并设立基础反应条件为60 ℃反应1 h。在此反应体系和反应条件下,利用棋盘法分别优化MgSO4浓度(20~2-10稀释)、MnCl2浓度(20~2-5稀释)、内外引物比例(1∶1、2∶1、3∶1、4∶1 和5∶1)、反应温度(60 ℃、62 ℃、64 ℃和66 ℃)和反应时间(40 min、50 min、60 min、70 min、80 min 和90 min),确定最佳反应体系和条件。
1.5 特异性试验利用病毒RNA 抽提纯化试剂盒分别提取灭活疫苗中AHSV-1~9 的RNA 以及BTV、EIV、EIAV 和EAV 的RNA,用紫外分光光度法分别测定各RNA 的浓度,以其为模板,采用本实验建立的RT-LAMP 方法进行检测,分析该方法的特异性。
1.6 敏感性试验用ddH2O 将1.5 中的ASHV-4 RNA调整浓度至3.2×10-2ng/μL 作为检测样品,并将其10倍倍比稀释10 个梯度(100~10-9)后分别作为模板,同时利用本实验建立的RT-LAMP 和普通RT-PCR[6]进行检测,分析该RT-LAMP 方法的敏感性。
1.7 临床样品检测利用病毒RNA 抽提纯化试剂盒分别提取30份马血、5份驴血和5份AHSV灭活疫苗实验室人工污染的马血样品(其制备方法为200 μL 马抗凝血中加入ASHSV-4 灭活疫苗液10 μL)的RNA,分别作为模板,同时进行RT-LAMP 和普通RT-PCR 检测,比较二者的检测结果,并计算二者的符合率。
2 结 果
2.1 可视化RT-LAMP 反应体系及反应条件的优化结果经棋盘测定法所得该方法的最佳反应条件为: ddH2O 7.6 μL、10×Isothermal amplification buffer 2.5 μL、dNTP Mixture(10 mmol/L)1.5 μL、Bst 2.0 WarmStart DNA polymerase(8 U/μL)1 μL、AMV(5 U/μL)0.5 μL、Betaine(10 mol/L)2 μL、MgSO4(0.20 mmol/L)1.5 μL、Calcein(200 μmol/L)3 μL、MnCl2(6.25 mmol/L)0.8 μL、AHSV-FIP(20 μmol/L)1.2 μL、AHSV-BIP(20 μmol/L)1.2 μL、AHSV-F3(20 μmol/L)0.6 μL、AHSV-B3(20 μmol/L)0.6 μL 和AHSV RNA 模 板1 μL。反应条件为62 ℃1 h。在RT-LAMP 反应后,AHSV RNA 样品反应液的颜色由橘黄色变为黄绿色,反应产物电泳出现梯度条带,显示为阳性;阴性对照样品反应前后反应液颜色保持橘黄色不变,反应产品电泳无梯度条带,显示为阴性(图1),表明可视化检测结果良好。
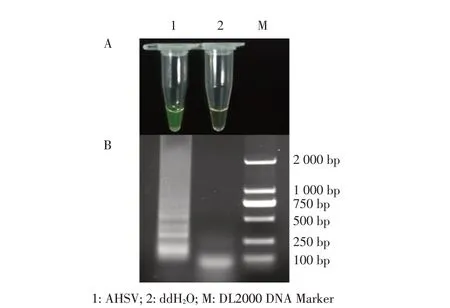
图1 AHSV RT-LAMP 最佳反应体系和反应条件下的试验结果Fig.1 The reaction results of AHSV RT-LAMP under optimal system and conditions
2.2 特异性试验结果经紫外分光光度法测定AHSV-1~9、BTV、EIV、EIAV 和EAV 的RNA 样品的 浓 度 分 别 为12.1 ng/μL、7.8 ng/μL、2.7 ng/μL、3.2 ng/μL、6.4 ng/μL、11.5 ng/μL、2.1 ng/μL、0.9 ng/μL、2.2 ng/μL、9.7 ng/μL、1.2 ng/μL、2.3 ng/μL 和1.8 ng/μL。采用建立的RT-LAMP 方法分别对13 株病毒的RNA样品进行检测,结果显示仅AHSV 检测结果为阳性,BTV、EIV、EIAV 和EAV 检测结果均为阴性(图2),表明该方法特异性较强。

图2 AHSV RT-LAMP 特异性试验结果Fig.2 Specificity test results of AHSV RT-LAMP
2.3 敏感性试验结果用建立的RT-LAMP 方法和RT-PCR 方法同时对不同稀释度AHSV RNA 样品进行检测,结果显示RT-LAMP 最低RNA 检测浓度为3.2×10-9ng/μL(图3 A、B);RT-PCR 最低检测RNA浓度为3.2×10-6ng/μL(图3C),RT-LAMP 敏感性为RT-PCR 的1 000 倍。表明该RT-LAMP 的敏感性较高。
图3 AHSV RT-LAMP 敏感性试验结果Fig.3 Sensitivity test results of AHSV RT-LAMP
2.4 临床样品检测结果利用建立的RT-LAMP 方法和普通RT-PCR 同时检测30 份马血和5 份驴血样品,结果显示均为阴性;同时用两种方法检测5 份AHSV 疫苗污染的马血样品,结果显示均为阳性。两种检测方法的阳性和阴性符合率均为100%。对1份ASHV 疫苗液人工污染马血样品进行敏感试验,结果显RT-LAMP 检测为阳性的最低RNA 浓度为8.7×10-9ng/μL,而该方法检测ASHV 疫苗样品为阳性的最低RNA 浓度为3.2×10-9ng/μL,敏感性有所下降,分析原因为马血成分干扰了AHSV RNA 的提取以及RT-LAMP 反应的缘故。以上结果表明该方法可用于临床样品检测。
3 讨 论
AHS 是马属动物的一种高致死性病毒性传染病,也是我国重点防范的一种外来动物疫病,其快速现场诊断方法成为近年来研究的热点。2016 年,英国Fowler 等首次建立AHSV RT-LAMP 检测方法[9],虽然该方法能对全部9 个血清型AHSV 进行检测,但其反应必须在复杂昂贵的荧光定量PCR 仪上进行,不能用于现场诊断。2017 年国内首次建立了AHSV 可视化RT-LAMP 检测方法,但该方法存在诸多缺陷:(1)该方法未用全部9 个血清型AHSV RNA进行特异性验证,也没有对马的其它主要RNA 病毒(EIV、EIAV 和EAV 等)进行特异性验证,这就大大限制了其特异性。(2)该方法结果判定需要在反应结束后,打开反应管另外加入SYBR Green Ⅰ荧光染料,在紫外灯照下观察反应结果。由于LAMP 方法是一种非常敏感的方法,打开反应管很容易使反应产物污染试验场所,导致出现大量的假阳性试验结果,这也限制了该方法的实际应用。本研究建立的RT-LAMP 方法克服了以上2 种方法的不足之处,具有诸多优势:(1)不仅能对全部9 个血清型AHSV 进行检测,而且与马重要的RNA 病毒EIV、EIAV 和EAV 无交叉反应,与AHSV 同属的BTV 病毒也无交叉反应,显示了较强的特异性。(2)反应可在水浴锅中进行,不需复杂昂贵设备,可用于现场检测。(3)反应结果判断定不需打开反应管,直接肉眼观察反应液颜色变化判断反应结果,避免污染和假阳性结果。
在反应条件优化试验中,该RT-LAMP 反应受诸多因素的影响:首先,MgSO4浓度是一个关键因素, 当MgSO4浓 度≥3.13 mmol/L(2-5稀 释)时,RT-LAMP 反应完全被抑制;当1.56 mmol/L≥MgSO4浓度≥0.10 mmol/L 时,RT-LAMP 扩增都较好,为保证足量MgSO4激活Bst DNA 聚合酶,同时保证MgSO4不过量使反应前反应液中Calcein 的黄绿色容易被MnCl2所淬灭而呈现橘黄色,故选择0.20 mmol/L(2-9稀释)作为最佳MgSO4浓度。由此推断过高的MgSO4浓度会抑制RT-LAMP 反应,此结论与本研究团队之前报道的结论一致[12]。其次,内外引物比例也是该RT-LAMP 反应的又一个关键因素,当固定外引物体积0.6 μL 不变,将内外引物体积比例分别调整至1∶1、2∶1、3∶1、4∶1 和5∶1 时,RT-LAMP 均有扩增,且当内外引物比例≥2∶1 时,扩增效果都较好,为节约内引物的用量,故选择2∶1 作为内外引物最佳比例。再次,RT-LAMP 反应前AHSV RNA 样品的预变性也是该方法成败的一个重要因素,这是由于AHSV 属呼肠病毒科(Reoviridae)环状病毒属(Orbivirus),是一种有10 个节段(L1~L3,M4~M6,S7~S10)的双链RNA 病毒,其双链RNA 很稳定,低温时难于解链,导致RT-PCR 和RT-LAMP 方法失败。在实验中以未预变性的AHSV RNA 样品作为模板,进行RT-PCR 和RT-LAMP 反应均不能进行扩增,而以预变性的AHSV RNA 样品作为模板,二者均扩增良好。本研究对AHSV RNA 样品采用98 ℃作用3 min 后立即放入冰水混合物中冰浴5 min 的方法进行预变性,取得了良好的试验效果。
本研究根据全部9 个血清型AHSV 的VP7 基因保守序列,设计2 对兼并引物AHSV-FIP/ AHSV-BIP、AHSV-F3/AHSV-B3,通过反应体系和条件的优化,建立了能够检测全部9 个血清型的AHSV 可视化RT-LAMP 现场检测方法。 该方法具有较强的特异性,敏感性是本课题组之前报道的RT-PCR 方法[10]的1 000 倍;临床马组织样品检测结果表明该RT-LAMP 方法与RT-PCR 方法的阳性和阴性符合率均为100%。临床样品检测实验表明本研究建立的RTT-LAMP 方法可用于马临床样品的快速可视化现场检测。本研究于国内外首次建立了检测全部9 个血清型AHSV 的可视化RT-LAMP 现场检测方法,为马ASHV 快速可视化现场检测提供了技术支持。
