食源性单核细胞增生李斯特菌毒力岛4 携带株的分型、毒力及生物被膜形成能力的测定
2020-08-06刘扬扬康立超李红欢钱凌霄
刘扬扬,康立超,马 勋*,王 静*,李红欢,钱凌霄
(1. 石河子大学 动物科技学院,新疆 石河子 832003;2. 新疆农垦科学院 分析测试中心,新疆 石河子 832003)
单核细胞增生李斯特菌(Listeria monocy togenes,LM)是重要的食源性人兽共患李斯特菌病的病原菌,与大肠杆菌、沙门氏菌、志贺氏菌并称为世界四大食源性致病菌[1]。LM 属于胞内寄生菌,可突破宿主的肠道屏障,血脑屏障和血胎屏障,临床上引起人和多种动物的脑炎、脑膜炎、败血症、流产以及发热性胃肠炎等[2]。李斯特菌病具有较高的死亡率,免疫功能不全者、孕妇、新生儿以及胎儿均是李斯特菌病的易感群体,该病在动物中主要见于牛、羊、骆驼等反刍动物[3-5]。
LM 基因组中存在多个毒力因子基因簇,这些基因簇编码的蛋白在感染机体过程中发挥重要作用。其中LM 毒力岛4(Listeria monocytogenes pathogenicity island 4,LIPI-4)由6 个基因组成,分别是膜透性酶Ⅱ(EⅡA315bp、EⅡB357bp、EⅡC1302bp),与LIPI-4 有关的未知蛋白747 bp,抗转录终止子1 917 bp,麦芽糖-6'-磷酸葡萄糖苷酶1 308 bp,其本质上是一个磷酸烯醇式丙酮酸(PEP)磷酸转移酶系统(PTS),PTS 系统属于原核生物和古细菌独有的碳水化合物和糖醇的转运模式,涉及20 多种不同碳水化合物和糖醇的磷酸化和跨膜转运。2016 年Maury 等对LIPI-4 进行了初步研究,发现LIPI-4 是与中枢神经系统感染和母胎感染密切相关的特异性毒力因子[6]。
本研究拟对5 株新疆地区食品源单核细胞增生李斯特菌LIPI-4 携带株进行血清型分组、多位点序列分型、小鼠的半数致死量和生物被膜形成能力的测定,为进一步研究LM LIPI-4 的致病性及其致病机理奠定基础。
1 材料与方法
1.1 主要实验材料5 株食品源LM LIPI-4 携带株分离自新疆各师局2014 年~2017 年常规送检的1027份样品中, 菌株标号分别为LM461、 LM873、LM928、LM2947 和LM5573;8 周龄健康昆明系小鼠由石河子大学实验动物中心提供。2×PCR Mix、ddH2O、DL2000 DNA Marker 均购自广州东盛生物科技有限公司;脑心浸液培养基(BHI)购自青岛高科技园海博生物技术有限公司;细菌基因组DNA 提取试剂盒购自天根生化科技(北京)有限公司;琼脂糖凝胶DNA 回收试剂盒购自天根生化科技(北京)有限公司。
1.2 分离菌株多重PCR 血清型分组将分离菌株LM461、LM873、LM928、LM2947 和LM5573 分别接种于BHI 液体培养基,37 ℃振荡培养16 h~18 h 后,利用DNA 提取试剂盒提取各菌株全基因组DNA。参考文献[7]设计5 对引物分别特异性扩增单核细胞增生李斯特氏菌基因lmo0737、lmo1118 基因的开放阅读框orf2819 和orf2110,以及李斯特氏菌属共有基因prs(表1)。引物由北京华大基因公司合成。PCR扩增体系为:2×PCR mix 25 μL;lmo0737、orf2819 和orf2110 基因的上、下游引物(20 μmol/L)各1 μL,lmo1118 基因上、下游引物(20 μmol/L)1.5 μL,prs 基因上、下游引物(20 μmol/L)0.5 μL;模板DNA 4 μL;用超纯水补足50 μL 体系。PCR 扩增程序: 95 ℃3 min,94 ℃24 s、53 ℃75 s、72 ℃90 s,共35 个循环,72 ℃10 min。PCR 扩增产物进行琼脂糖凝胶电泳,根据图谱确定血清型分组,分型引物见表1。
1.3 分离菌株的MLST 鉴定参考法国巴斯德研究所的单增李斯特菌多位点序列分型数据库https://bigsdb.pasteur.fr/listeria/primers_used.html 操 作 方 案 和 引物序列,对确定用于分型的7 个管家基因abcZ、bglA、cat、dapE、dat、ldh 和lhkA 进 行PCR 扩 增,引物由北京华大基因公司合成(表2)。PCR 扩增体系: 各菌株全基因组DNA 4 μL;上、下游引物(表2)各2 μL;2×PCR Mix 27 μL,然后加ddH2O 至体积50 μL。PCR 扩 增 程 序:96 ℃5 min,96 ℃30 s,47 ℃40 s(abc-Z 和ldh)或56 ℃40 s(cat、dat、dapE、bglA和lhkA),72 ℃1 min,共35个循环,72 ℃10 min。PCR 扩增产物经琼脂糖凝胶电泳检测,利用琼脂糖凝胶回收试剂盒纯化回收目的条带,并送公司测序。测序结果与单增李斯特菌MLST 数据库(https://bigsdb.pasteur.fr/cgi-bin/bigsdb/bigsdb.pl?db=pubmlst_listeria_seqdef_public&page=sequenceQuery)进行比对,确定每个管家基因的序列号。将菌株所得的管家基因相对应的管家基因数值按abcZ 、bglA、cat、dapE、dat、 ldh 和lhkA 顺序提交至单增李斯特 菌MLST 数 据 库(https://bigsdb.pasteur.fr/listeria/),获得每株菌的等位基因图谱即为该菌株的ST 型,按照数据库的信息,明确CC 克隆群及其所属谱系(https://bigsdb.pasteur.fr/cgi-bin/bigsdb/bigsdb.pl?db=pubmlst_listeria_seqdef)。

表1 血清PCR 分型引物信息Table 1 Serum PCR typing primers information

表2 多位点序列分型引物信息Table 2 Multilocus sequence typing primers information
1.4 分离菌株对小鼠半数致死量(LD50)的测定将5 株菌单菌落分别接种BHI 液体培养基,37 ℃,180 r/min,培养16 h, 8 000 r/min 离心5 min,收集菌体,无菌PBS 清洗两遍后10 倍倍比稀释,按照常规方法进行平板计数。将8 周龄昆明系小鼠随机分成25 组,每组6 只,分别腹腔注射稀释后为109cfu/mL、108cfu/mL、107cfu/mL、106cfu/mL、105cfu/mL 的菌液,0.5 mL/只,连续观察10 d,统计小鼠死亡数并观察记录小鼠的精神状态。利用寇氏法[8]计算分离菌株对小鼠的LD50。
1.5 分离菌株生物被膜测定将5 株菌分别培养至OD600nm约等于0.2 时,以每孔180 μL BHI 和20 μL 培养物接种至96 孔细胞培养板,37 ℃静置培养,每间隔2 h,吸出96 孔板中的液体,PBS 洗3 遍,55 ℃烘干30 min,加入200 μL 1%结晶紫水溶液染色30 min,PBS 洗涤5 次,55 ℃干燥,每孔加入200 μL 的95%酒精脱色45 min,测OD600nm的值。
2 结 果
2.1 分离菌株多重PCR 血清分型鉴定结果多重PCR 血清型分组结果显示:5 个分离株均仅扩增出2条带,大小分别为471 bp 和370 bp,分别对应ORF2819 和prs 基因(图1)。表明分离菌株全部为李斯特氏菌属成员,且均为第1 组(GP1),血清型为1/2b、3b 和7。

图1 分离菌株多重PCR 扩增结果Fig.1 Multiplex PCR amplification results of the isolated strains
2.2 分离菌株多位点序列分型鉴定结果对分离菌株7 个管家基因扩增,结果显示,分别为453 bp的ldh 基 因、486 bp 的cat 基 因、462 bp 的dapE 基因、537 bp 的abcZ 基因、471 bp 的dat 基因、480 bp的lhkA 和399 bp 的bglA 基因,与预期相符(图2)。测序比对得到abcZ 、bglA、cat、dapE、dat、 ldh 和lhkA 管家基因对应的等位基因数值分别为12、1、4、14、3、39、4,对照数据库信息,其序列分型为ST87。表 明LM461、 LM873、 LM928、 LM2947 和LM5573 的多位点序列型均为ST87 和CC87 克隆群。
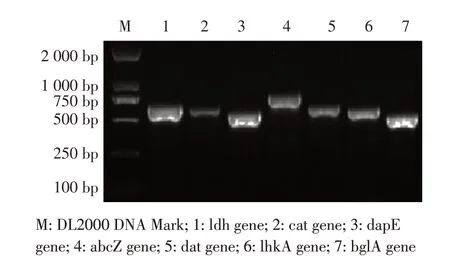
图2 管家基因PCR 扩增结果Fig.2 PCR amplification results of housekeeping genes
2.3 分离菌株对小鼠LD50测定结果小鼠腹腔注射不同浓度的菌液10 d 后的死亡情况见表3,根据寇氏法计算得出,LM461、LM873、LM928、LM2947 和LM5573 的LD50分 别 是107.5cfu、108.6cfu、107.2cfu、107.2cfu、107.3cfu。表 明 分 离 菌 株LM928 和LM2947毒力最强,其次分别是LM5573、LM461 和LM873。

表3 LM461、LM873、LM928、LM2947 和LM5573对小鼠LD50的测定结果Table 3 LD50 measurement results of LM461、LM873、LM928、LM294 and LM5573 in micen
2.4 分离菌株生物被膜测定结果利用结晶紫染色法检测分离菌株生物被膜形成情况,结果显示,5株LIPI-4 携带株均能形成生物被膜,但形成能力存在差异。LM2947 和LM928 株12 h 之后OD600nm值开始迅 速 升 高,36 h 分 别 达 到 最 高 值2.1882 和2.1408,然后逐渐下降;LM5573 和LM461 12 h 之后OD600nm值开始升高,48 h 分别达到最高值1.8398 和1.8,然后逐渐下降;LM873 4 h 之后OD600nm值开始逐渐升高,48 h 达到最大值1.3692,然后逐渐下降(图3)。表明分离菌株LM928 和LM2947 生物被膜的形成能力最强,其次分别是LM5573、LM461 和LM873。

图3 分离菌株生物被膜形成能力测定结果Fig.3 Determination of biofilm formation ability of the isolated strains
3 讨 论
越来越多的研究表明LM 的型别与其致病性和毒力存在相关性,通常谱系I 或血清型4b LM 的临床分离株致病性和毒力明显高于谱系II 或血清型为1/2a、1/2b、1/2c 的LM 菌株[8-9]。本实验对5 个LM LIPI-4 携带株的生物被膜形成能力和小鼠LD50进行了测定,结果发现5 株菌均能致死小鼠,且能形成生物被膜,而且形成生物被膜能力最强的LM2947 和LM928株,其对小鼠的毒力也最强,LD50均为107.2cfu,表明LM 毒力和生物被膜的形成能力存在正相关性。生物被膜是导致这些细菌性疾病久治不愈和反复发作的主要原因,形成生物被膜的细菌间有着严密的化学信号传导,致密的三维立体空间结构,能逃避宿主免疫系统的攻击,并对抗菌药物产生耐药性[10-12]。研究表明生物被膜形成能力强的细菌同时其毒力也较强[13-16],本实验结果与此一致。
LIPI-4 是近年来推测的与LM 导致神经系统感染和母胎感染有关的毒力因子,为CC4 克隆群所特有[6],本实验以5 株食品源LM LIPI-4 携带株为对象,多重PCR 结果显示分离菌株LM461、LM873、LM928、LM2947 和LM5573 的 血 清 型 为1/2b、3b 和7,MLST 分析表明均为ST87,也是CC87 克隆群,均属于谱系I。由于目前CC4 克隆群中只包含ST219、ST815、ST817、ST397、ST4、ST816、ST861、ST783型的菌株[17]。因此,本实验的结果扩大了LIPI-4 所在的CC 群,并首次明确了LIPI-4 不仅仅存在于LM CC4 克隆群,同时也存在于ST87 型, CC87 克隆群。ST87 型曾是2009 年~2014 年西班牙2 次李斯特菌病的暴发元凶[18],而本实验分离菌株来自食品。我国食品源LM 的MLST 分析表明ST7、ST8、ST9、ST87、ST121 菌株是最为常见的食品源分离株[19],表明ST87 型菌株既能来源于临床分离,又能来自食品。因此,开展对携带LIPI-4 的ST87 型LM 的研究具有重要的意义。
