郑州市23例SARS-CoV-2核酸单靶标阳性标本的跟踪检测分析
2020-08-05牛卫东许太彬孙丽梅赵瑞臻
牛卫东,许太彬,孙丽梅,安 戈,史 军,李 羿,赵瑞臻
(郑州市疾病预防控制中心,河南 郑州 450007)
2019年12月,武汉市出现了由严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)引发的新型冠状病毒肺炎(corona virus disease 2019,COVID-19)[1]。SARS-CoV-2是一种β属冠状病毒,属于单链RNA病毒,有包膜[2],其 基因特征与严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome-related coronavirus,SARSr-CoV)和中东呼吸综合征冠状病毒(middle east respiratory syndrome-related coronavirus,MERSr-CoV)有明显区别[3-4]。目前,实时荧光逆转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)仍是COVID-19疑似病例的主要确诊方法[5]。实时荧光RT-PCR主要检测SARS-CoV-2基因组中开放读码框1ab(open reading frame 1ab,ORF1ab)和核壳蛋白(nucleocapsid protein,N)[5]。在SARSCoV-2核酸检测过程中会出现核酸单靶标阳性的情况,虽然在最新版《新型冠状病毒肺炎实验室检测技术指南》[5]中明确了SARS-CoV-2核酸单靶标阳性的判定规则,但仍需对SARS-CoV-2核酸单靶标阳性的情况进行分析和探讨。截至2020年3月11日,郑州市疾病预防控制中心实验室针对全市COVID-19疑似患者和密切接触者共做了4 375次的SARS-CoV-2核酸检测,其中有23例COVID-19疑似患者和密切接触者首次检测(以下简称首检)出现了SARS-CoV-2核酸单靶标阳性的情况,本研究拟对这23例标本进行跟踪检测,以期为实验室检测提供参考。
1 材料和方法
1.1 标本来源
收集2020年1月20日—3月11日,郑州市COVID-19疑似患者、密切接触者的鼻拭子或咽拭子标本。所有标本均严格按照《新型冠状病毒肺炎防控方案》采集并转运至郑州市疾病预防控制中心微生物检验所病毒实验室。
1.2 试剂与仪器
病毒核酸提取试剂盒(EX-RNA/DNA病毒)和GeneRoteX 96全自动核酸提取仪均购自西安天隆科技有限公司。Heidolph-Multi Reax多位试管振荡器购自德国海道夫公司。Parafilm封口膜购自美国BEMIS公司。采用实时荧光RTPCR检测SARS-CoV-2,试剂盒购自上海伯杰医疗科技有限公司,检测仪器为CFX96实时荧光定量PCR仪(美国Bio-Rad公司)。
1.3 标本的处理与检测
将鼻拭子/咽拭子病毒采样管用封口膜密封后,置于试管振荡器上,振荡10 min。按照SARS-CoV-2核酸提取试剂盒说明书要求完成核酸提取,吸取5 μL标本,加入到20 μL分装好的核酸检测液中,将剩余标本置于-20 ℃保存。
实时荧光RT-PCR反应条件为:逆转录50 ℃10 min,预变性95 ℃ 5 min;95 ℃ 10 s,55 ℃40 s,45个循环。ORF1ab基因检测通道为FAM,N基因为HEX/VIC,内参基因为ROX。
1.4 结果评价
1.4.1 质控标准 在同一检测中必须同时满足:阳性对照3个通道扩增循环阈值(cycle threshold,Ct)均≤30,阴性对照均无Ct值,否则本次检测无效。
1.4.2 结果判读 若ROX通道Ct值>38,则判定标本不合格。若ROX通道Ct值≤38,FAM通道、HEX/VIC通道均无Ct值,则判定为阴性。FAM通道、HEX/VIC通道Ct值≤38,则判定为阳性。FAM通道、HEX/VIC通道均有Ct值,且有Ct值>38,或仅有单个通道出现明显扩增曲线时,判定为不确定,建议复测。本研究以仅单个通道出现明显扩增曲线作为单靶标阳性。对单靶标阳性的标本,重新采样检测间隔时间不少于24 h。
1.5 统计学方法
采用SPSS 20.0软件进行统计分析。计数资料以率表示,组间比较采用χ2检验;如果<5的预期值>总数的1/5,且样本数<40,则用Fisher精确概率法进行比较。以P<0.05为差异有统计学意义。
2 结果
2.1 检测概况
对23例首检为SARS-CoV-2核酸单靶标阳性者重新采样检测,其中有8例(34.78%)SARSCoV-2核酸为阳性,15例(65.22%)为阴性。见表1。
2.2 重新采样检测阳性率
在23例首检为SARS-CoV-2核酸单靶标阳性的标本中,有6例为ORF1ab基因单靶标阳性,占26.09%,其中有1例重新采样检测后被确认为阳性,重新采样检测阳性率为16.67%;有17例为N基因单靶标阳性,占73.91%,其中有7例重新采样检测后被确认为阳性,重新采样检测阳性率为41.18%。2个基因之间重新采样检测阳性率差异无统计学意义(χ2=1.174,P>0.05)。见表2。
2.3 检测次数
从整体来看,23例COVID-19疑似患者和密切接触者中,有16例进行了2次采样检测,6例进行了3次采样检测,1例进行了5次采样检测,方得到最终可判定的结果。从基因型别来看,6例ORF1ab基因单靶标阳性者均进行了2次采样检测,方得到最终可判定结果;17例N基因单靶标阳性者中,10例进行2次采样检测,6例进行3次采样检测,1例进行了5次采样检测,方得到最终可判定的结果。从最终确诊情况来看,8例确认为SARS -CoV-2核酸阳性的患者中,7例进行了2次采样检测,1例进行了3次采样检测;15例SARS-CoV-2核酸阴性者中,9例进行了2次采样检测,5例进行了3次采样检测,1例进行了5次采样检测。如果按最新版检测方案[5]判定,将会产生6例假阳性结果,6例均为N基因单靶标阳性。见表2。

表1 23例SARS-CoV-2核酸单靶标阳性者跟踪检测Ct值结果
2.4 Ct值分布
首检单靶标阳性标本整体的C t值为36.00~36.99时出现高峰,首检ORF1ab基因单靶标阳性的Ct值集中分布于36.00~38.00。首检单靶标阳性转阳标本的Ct值分布比较分散。有1例Ct值为40.68的标本在第2次检测后被确认为阳性。见图1。

表2 得到最终可判定的结果所用检测次数 例
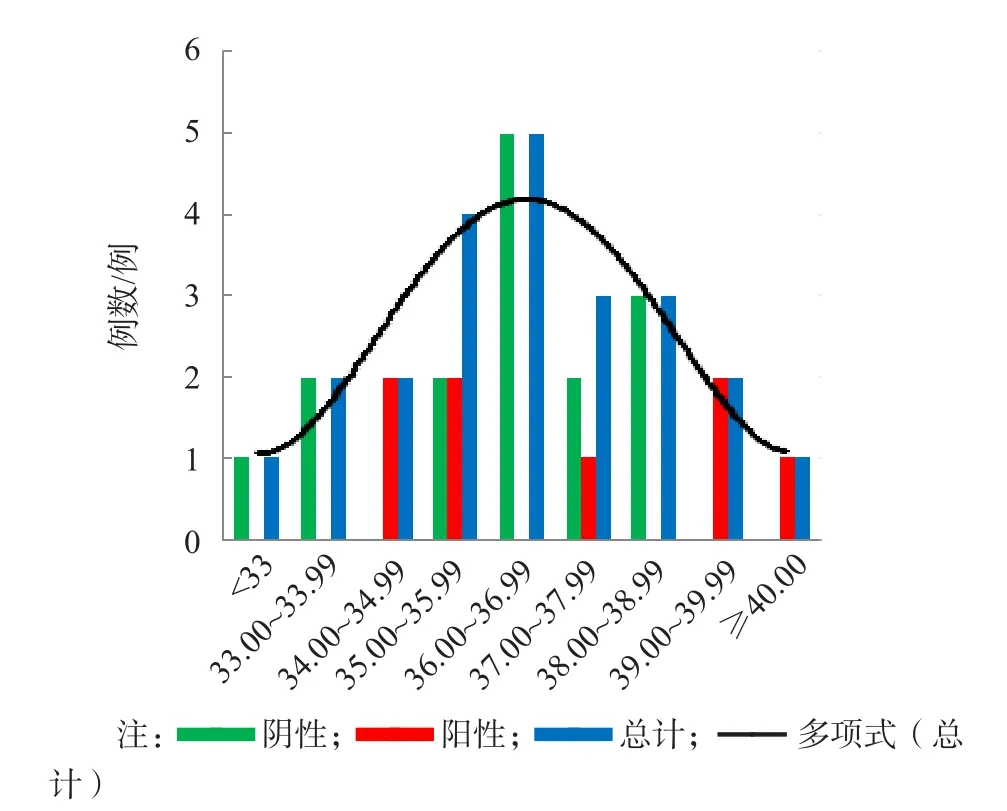
图1 SARS-CoV-2核酸单靶标阳性标本Ct值分布
3 讨论
自2019年12月COVID-19疫情在武汉暴发以来,涌现出了各种针对SARS-CoV-2的检测方法,但实时荧光RT-PCR仍是COVID-19的主要确诊方法[5]。按照相关试剂盒说明书要求,单靶标阳性标本应该判定为不确定。本研究对23例首检单靶标阳性标本的跟踪检测结果显示,有34.78%的单靶标阳性标本在跟踪检测中被确认为阳性。提示单靶标阳性标本应该进行跟踪检测,以免造成假阴性结果,增加疫情扩散风险。
COVID-19疫情突然暴发,临床检测需求增加,但很多检测试剂的灵敏度、稳定性和可靠性还有待进一步验证[6],有些试剂ORF1ab基因和N基因的检测灵敏度之间有差异,可能会出现单靶标阳性结果[7]。还有研究结果显示,实时荧光定量PCR检测N基因的灵敏度更高[8]。有研究结果显示,COVID-19潜伏期长达14 d,在感染早期临床表现不典型[9],病毒复制数量达不到试剂盒检测阈值时,可能会出现假阴性或单靶标阳性[10]。
假阴性和单靶标阳性结果的出现也可能与标本采集质量有关[10],大量非呼吸专业医护人员不熟悉鼻/咽拭子的采集规范,可能会造成采集部位不准确[10]、采集手法不到位等情况,影响采集标本的质量。还有研究表明,痰液的检出率明显高于鼻/咽拭子,说明多种标本同时采集可以提高新冠病毒检出率[11]。
ORF1ab基因中序列同一性在SARS-CoV-2和乙型冠状病毒其他成员之间<90%,是区分SARS-CoV-2与其他冠状病毒的重要靶标[4],ORF1ab基因特异性强,因此23例单靶标阳性标本中,仅有6例为ORF1ab基因单靶标阳性。
在冠状病毒的结构蛋白中,N蛋白是最保守和最稳定的蛋白,因此N基因相对保守[4,12],易与其他发生交叉反应,因此一些试剂检测N基因的灵敏度更高[8]。23例单靶阳性标本中,73.91%为N基因单靶标阳性,且有10例转为阴性,可能是与其他病毒发生交叉反应。N基因单靶标阳性标本中有7例转为阳性,重新采样检测阳性率为41.18%。
从整体的检测次数来看,绝大多数首检单靶标阳性者在连续2次跟踪检测后,就能够得到明确结果,但仍有部分单靶标阳性者需要检测3~5次。多次检测后,N基因仍出现单靶标阳性者也可能是其他冠状病毒感染[13]。按照《新型冠状病毒肺炎实验室检测技术指南》中实验室确认阳性标本的标准,23例单靶标阳性的标本中将出现6例假阳性标本,且6例假阳性标本均为N基因单靶标阳性,提示同种类型标本2次采样检测中均出现单靶标阳性的检测结果时,应该慎重对待,并重新采样跟踪检测。
从重新采样检测阳性标本的Ct值分布来看,有1例Ct值为40.68的首检单靶标阳性标本在第2次检测时被确认为阳性,提示单靶标阳性标本的Ct值不论是高是低均应重新采样检测。
